电解刺激技术对E.dissolvens 生长代谢的研究
2013-08-07侯怡铃
宋 波,侯怡铃,丁 祥
( 西华师范大学生命科学学院,四川南充637002)
微生物细胞的电解刺激培养是电化学与生物工程交叉领域的一个重要课题,近年来受到研究者日益增长的关注。这一技术利用直流电或交流电在液相或泥浆体系中引发电极反应,从而达到促进细胞生长及活性的目的。目前已成功应用于酵母发酵[1]、生物脱氮[2]以及铁细菌[3]E.dissolvens[4-5]等微生物的培养过程。如杨金水等[6]研究了弱直流电场条件对铜绿假单胞菌的影响,表明不同的电流可改变细胞通透。此外直流电和交流电的电场刺激对大肠杆菌和phanerochaete chrysosporium 蛋白的表达和酶活通透性等都有影响[7-8]。但一直以来,微生物的电解刺激技术多关注于外加电场对细胞的培养过程的研究,而对于直流电和交流电产生的不同效应没有进行深入的研究。本文将肠细菌E.dissolvens 的电解刺激培养过程进一步拓展至直、交流电条件下,检测细胞生长、活性以及底物代谢等方面变化,并与直流电条件下所取得相关结果进行对比外,也考察了两种电流条件下电解水产生羟基自由基和过氧化氢等中间产物的能力差异。其结果有助于增进对于直、交流电解刺激过程的认识,同时也是前期所开展直流电解刺激研究的有益补充。
1 材料与方法
1.1 材料与仪器
实验所用细菌 油田污染水样。通过以菲为唯一碳源进行限制性培养后纯化获得。该菌经测试最终鉴定为肠杆菌Enterobacter dissolvens,属革兰氏阴性菌。该细菌也能降解葡萄糖将此菌培养在以葡萄糖为唯一碳源条件下进行,培养基中同时添加常用无机盐类,浓度分别为(g/L 去离子水):葡萄糖15,K2HPO40.8,KH2PO40.2,NH4NO30.8,MgSO40.25,FeSO4·7H2O 0.01,CaCl20.032。进行电解刺激实验之前,首先对E.dissolvens 进行预培养[9]以获取具有较高活力的纯菌液,具体步骤为:从-25℃低温冰箱中保存的甘油管中取出0.1mL 种子菌液,接种至盛有150mL 经过滤灭菌培养基的三角瓶(500mL 容积)中,于30℃恒温摇床(150r/min)中培养约10h。葡萄糖 北京益利精细化学品有限公司,分析纯;DNS、TTC、RNO Sigma,分析纯;其余试剂均为分析纯。
DYY-III 2 直流电电泳仪 北京六一仪器厂;交流电变频电源 艾诺仪器公司。
1.2 电解刺激实验装置
直流及交流电解刺激实验在如图1 所示的玻璃电解瓶中进行,瓶体为两层玻璃层,内层装细菌液,容积为100mL;外层通水以保持恒温。两根铂丝(直径0.2mm)从顶端插入并沿对称方向固定在内层的两侧作为电极。实验前将3 个完全一致的电解瓶及其他实验材料经高压蒸汽灭菌,然后将经过预培养的300mL 菌液平均分为三份,分别转移至各个电解瓶,1 个不加电用作参比,另2 个分别施加直流电和交流电进行电解刺激实验。实验时三个电解瓶内分别放置一个完全相同的磁力转子,并置于一台多头磁力搅拌器上以恒定速率进行搅拌,从而保持瓶内菌液的均匀混合[4]。
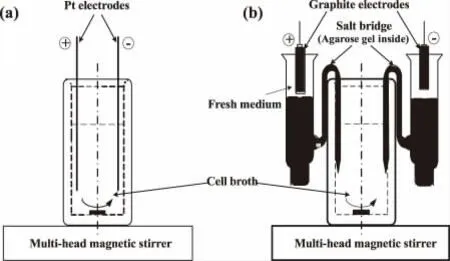
图1 细胞电解瓶实验装置图Fig.1 Schematic diagram of the electrolytic vessel
1.3 电极水解反应中间产物分析
电解刺激过程中·OH(羟基自由基)和H2O2(过氧化氢)两种水解中间产物的检测根据Wabner 等提供的方法修改而来[10]。其原理是利用对亚硝基二甲基苯胺(RNO)作为捕捉试剂在中性溶液中与·OH 进行选择性反应,而使自身所带黄色逐渐褪去。这一变化可通过测量溶液在440nm 处的吸光度(OD440)进行实时监测。H2O2则利用外加Fe2+离子转化为·OH后(Fenton 反应[11]),同样通过监测溶液的OD440变化进行确定。以上实验的具体操作,分述如下:
1.3.1 ·OH 含量分析 在图1 所示电解瓶中加入100mL 含有RNO(50μmol/L)的磷酸盐缓冲液,其K2HPO4与KH2PO4含量与前述细菌培养基相同。电流通过从顶端沿对称方向插入的铂片电极(阳极,1cm2)和铂丝电极(阴极)施加。加电后利用蠕动泵将溶液从电解瓶中以恒定流速抽出,在经过1 台配有流动池的分光光度计(Agilent 8453 UV-Visible Spectrophotometer)后回流至电解瓶中。因此不同时刻测得OD440值与初始吸光度值进行比较,即可计算出溶液中RNO 的残余百分比,其变化斜率可反映出溶液中·OH 的产生情况。
1.3.2 H2O2含量分析 实验操作与·OH 的分析步骤相同,只是磷酸盐缓冲液中除加入RNO 外,同时加入了0.1mmol/L 的FeSO4。因此在相同电流条件下比较加入Fe2+离子与不加Fe2+离子所获得的RNO降解速率,可以判定溶液中是否有额外·OH 生成,进而判断H2O2的产生情况。
1.3.3 细胞脱氢酶活测定 采用TTC(2,3,5-三苯基氯化四氮唑)显色法进行。每隔2h 取样一次,测定脱氢酶时,取20mL 的试管,分别加入1mL TTC 溶液(0.5%),Tris-盐酸缓冲液(pH8.4),葡萄糖溶液(0.1mol/L)和1mL 的样品液。混匀后放于30℃恒温培养箱中温育3h,然后滴入2 滴浓硫酸以终止反应。加入5mL 甲苯萃取酶促反应生成的红色产物TPF(2,3,5-triphenyl tetrazolium chloride formazan),并以纯甲苯为参比于490nm 波长处测定萃取液的吸光度(A490)。
1.3.4 氧化还原电位测定 采用氧化还原电极(Pt4865-50-S7,Mettler Toledo)测定。
1.3.5 其他参数的测定 在10mA 条件下平行开展了细胞的交、直流电解刺激培养实验。监测了细胞菌浓、残糖浓度、溶液物化性质(pH 和氧化还原电位)诸参数随时间的变化情况。
2 结果与讨论
2.1 细胞的交、直流电解刺激培养过程研究
为便于比较,以上结果均显示于图2、图3 中,并分为参比、直流以及交流三组进行对比。
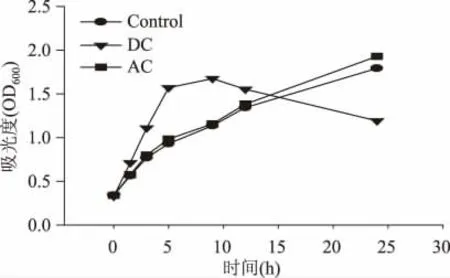
图2 细胞菌浓随电流的变化Fig.2 Time course profiles of the cell growth
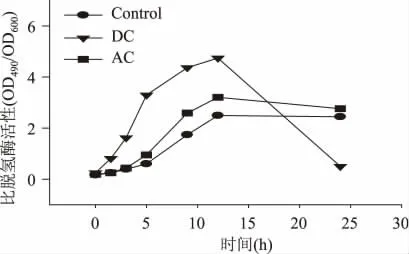
图3 细胞比脱氢酶活性随电流的变化Fig.3 Time course profiles of cell dehydrogenase activity
图2 所示为细胞菌浓随时间的变化。与不加电的参比样(Control)相比,受直流电作用细胞的生长周期明显提前,约5h 后进入平台生长期,10h 后开始逐渐下降。与此形成对照的是,交流电的施加未导致细胞生长出现明显变化,只在后期略有增长。但是值得注意的是在直流电刺激下,细胞的生长提前进入了衰亡期。细胞脱氢酶活的变化如图3 所示:施加直流电和交流电均导致细胞脱氢酶活升高,但直流电的刺激效果更为明显。在电刺激12h时刻,受直流电刺激细胞的比脱氢酶活(总显色度(OD490)/细胞菌浓(OD600))较参比值提高了0.9倍,而交流电条件下这一增幅为0.3 倍。但在12h之后,交、直流电流作用下细胞的脱氢酶活变化趋势体现出显著的差异,前者停止增长而逐渐走平,与参比一致;后者则出现急剧下降,与图2 中所示同时期菌浓的下降形成对应。图4 所示为菌液中残糖浓度随时间的变化,可以看出直流电条件下葡萄糖的降解速度最快,交流电次之,但略强于参比值。这一结果与细胞生长及脱氢酶活的变化规律相一致,表明细胞菌浓与活力的提升的确可以加快底物代谢。

图4 细胞葡萄糖含量随电流的变化Fig.4 Time course profiles of residual glucose
2.2 细胞的交、直流电解刺激对生长环境的影响
细胞培养过程中也对菌液的pH 和氧化还原电位(Eh)进行了监测,分别如图5 和图6 所示。细胞培养过程中参比菌液的pH 持续下降,原因估计为葡萄糖受肠杆菌代谢时生成的有机酸所致[1]。与之相比,直流电解条件下pH 下降更为快速,而交流电解条件下菌液pH 未出现明显差异,表明两种电流条件下菌液中酸性物质的累积浓度具有差异。氧化还原性方面,加电与参比菌液的Eh 值均呈现出先下降后上升的特征,其中参比菌液中Eh 值的下降应主要由于菌液中的溶氧限制所致(采用溶氧电极测得的溶氧值始终为0),而加电条件下的Eh 值则明显受到了电极反应的影响:受电解菌液的Eh 值在加电后急剧降低,并在整个培养周期内显著低于参比菌液。由于前期在同一实验体系中已经利用循环伏安法鉴别出水解反应为主要电极反应,且菌液Eh 值的降低主要由阴极生成的氢气所导致,因此以上结果表明,交流电解刺激培养与直流电解刺激培养在过程机理具有相似性,其实质均是利用水解反应影响细胞生长及活性,但在同等电流强度下,交流电激发电极反应的能力弱于直流电。
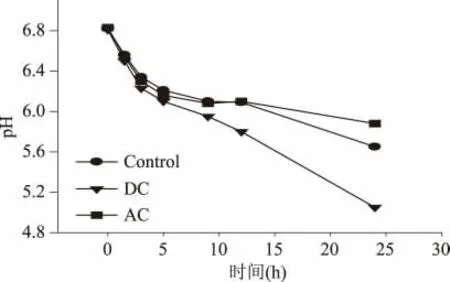
图5 pH 随时间的变化Fig.5 Time course profiles of pH
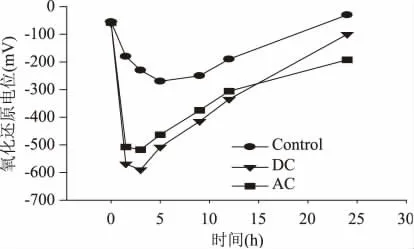
图6 氧化还原电位随时间的变化Fig.6 Time course profiles of redox potential
2.3 交、直流条件下水的电解中间产物分析
电解水反应的终产物是氢气和氧气。Sanetaka等人研究了直流电条件下的水电解反应过程,发现其中同时伴随生成H2O2和·OH 等氧化性中间产物[12],而这些中间产物对细胞的生理活性具有抑制性作用。但对于交、直流电解水反应之间的潜在差异,目前尚未见文献明确报道。为此我们采用同样利用亚硝基二甲基苯胺(RNO)作为电子捕捉试剂[10],分别在同电流和同电压两种条件下考察了交、直流电解水反应过程中铂电极上H2O2和·OH 的产生情况,结果如图7 所示。
由图7(a)可以看出,在直流电刺激下,即使是1V 的电压下,随着刺激时间的增加,电极产物对RNO 的降解率逐渐提高。比较两个发生电极反应的溶液,在电刺激的前5min,溶液中有无FeSO4没有明显的差异,溶液中RNO 的降解率均为5%左右,这说明了溶液中没有H2O2产生;值得注意的是在电刺激20min 左右,没有添加FeSO4的溶液的降解率是13%,而添加了FeSO4的降解率是17%左右,这充分说明了在直流电的刺激下,含FeSO4的溶液中产生了H2O2,而H2O2对细胞有毒害作用,正是由于过多的H2O2的产生,所以在细菌生长的后期,电流下对细菌的刺激效应表现为杀菌的效应。
同时对照交流电下的电极反应图7(b)可以发现,在1V 的电压刺激下,几乎没有电极反应发生,在溶液中添加FeSO4和不添加FeSO4对RNO 几乎都没有明显的降解率,这说明,在低电压下,交流电刺激,不足以产生电极反应。而当电压强度增加到5V 时,从图7(c)可以看出,对RNO 的降解率随着刺激时间的加长逐渐上升。在20min 时达到7%左右的降解率,这充分说明了5V 电压下溶液发生了电极反应。同时发现,添加FeSO4和不添加FeSO4的溶液对RNO 的降解率没有明显的差异,这一点暗示了交流电刺激下溶液中没有产生H2O2。
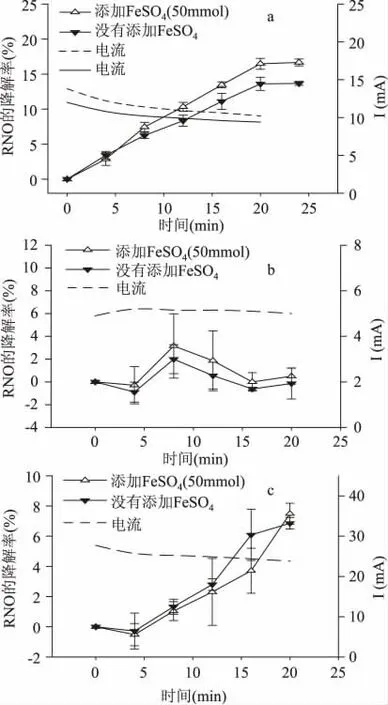
图7 利用铂电极进行细胞外加电场电解培养时的电极反应产物分析图Fig.7 Time course profiles of the analysis of electro analysis direct current
比较整个外加电场对细菌的电刺激情况,可以清楚地认识到直流电和交流电的电极产物是不同的,直流电的电极产物中·OH,O2和H2O2而交流电的产物中仅含有·OH,O2并没有H2O2,这一点似乎可以解释直流电和交流电10mA 电流下,对细菌Enterobacter dissolvens 生长和代谢的不同。直流电刺激的后期产生的H2O2对细胞产生毒害作用,最终导致了细胞的死亡。
3 结论与展望
在细菌E.dissolvens 的批式培养过程中,应用直流电和交流电均能对细胞的生长及脱氢酶活产生正面刺激作用,且在相同电流强度下直流电的刺激效果显著强于交流电。对于平台期细胞,施加直流电亦导致了细胞结构和活性出现明显受损和下降,而采用交流电则未体现出这一抑菌作用。对·OH 和H2O2两种电解水中间产物的检测表明,交流电产生以上抑菌性物质的能力远低于直流电,这可能是两种电流对细胞培养过程的影响出现差异的主要原因。
目前关于微生物细胞的电解刺激培养研究大多采用直流电进行,对于交流电应用于此过程的可行性和效果尚未见相关文献报道。根据本文结果可以看出,同等强度下交流电与直流电相比,在激发电极反应的效能方面具有劣势,但交流电解水过程中由于不生成H2O2等有害中间产物,对细胞不会产生明显的损伤作用,对于具有较长生长周期的微生物细胞培养过程具有一定应用潜力。
[1]Nakanishi K,Tokuda H,Soga T,et al.Effect of electric current on growth and alcohol production by yeast cells[J].J Ferment Bioeng,1998,85(2) :250-253.
[2]Beschkov V,Velizarov S,Agathos S N,et al. Bacterial denitrification of waste water stimulated by constant electric field[J].Biochem Eng J,2004,17(2) :141-145.
[3]Norio Matsumoto,Satoshi Nakasono,Naoya Ohmura,et al.Extension of logarithmic growth of thiobacillus ferrooxidans by potential controlled electrochemical reduction of Fe( III) [J].Biotechnology and Bioengineering1999,64:716-721.
[4]佘鹏,宋波,邢兴会,等.细菌Enterobacter dissolvens 的直流电解刺激过程[J].过程工程学报,2006,6(1) :71-76.
[5]宋波.溶解肠杆菌的交流电电解刺激过程[J].生物技术通报,2009(3) :123-126.
[6]杨金水,刘辰,王光溢,等.直流电场对铜绿假单胞菌PKE117 产酶及降解性能的影响[J].生物技术通报,2010,6:185-188.
[7]孙西同,马洁,孙晓彦,等.大肠杆菌的直流电刺激过程[J].微生物学通报,2010,37(10) :1440-1446.
[8]王福远,苗长春,韩慧龙,等.电场对黄孢原毛平革菌生长、细胞通透性、胞外酶反应的影响[J].过程工程学报,2007,2(7) :385-389.
[9]Qishi Luo,Hui Wang,Xihui Zhang,et al.Effect of direct electric current on the cell surface properties of phenol-degrading bacteria[J].Applied and Environmental Microbiology,2005,2:423-427.
[10]Wabner D,Grambow C. Reactive intermediates during oxidation of water at lead dioxide and platinum electrodes[J].Journal of Electroanalytical Chemistry,1985,195(1) :95-108.
[11]雷乐成,何锋.均相Fenton 氧化降解苯酚废水的反应机理探讨[J].化工学报,2003,54(11) :1592-1597.
[12]Sanetaka S,Shigeru K,Mariko N,et al.Electrolyzed-reduced water scavenges active oxygen species and protects dna from oxidative damage[J].Biochem Biophys Res Commun,1997,234(1) :269-274.
