一株酯化功能菌分离鉴定及酶学特性研究
2013-08-07郭明遗霍丹群侯长军王洪彬唐玉明任道群卢中明
郭明遗,霍丹群,* ,侯长军,王洪彬,唐玉明,任道群,邓 波,卢中明,
(1.重庆大学生物工程学院,重庆400044;2.四川省泸州市酿酒科学研究所,四川泸州646000;3.国家固态酿造工程技术研究中心,泸州老窖股份有限公司,四川泸州646000)
我国酿酒历史悠久,工艺独特,在世界酿酒史上独树一帜。中国白酒年销售收入上千亿元,浓香型白酒属于中国白酒四大香型之一,其产量在几大香型白酒中名列前茅,其销售量占全国白酒总量的70%左右[1]。己酸乙酯是浓香型白酒中最重要的主体香味成分,其含量高低与酒的风味和质量密切相关。利用微生物的酯化功能来提高酒中酯含量的研究与应用是近年来酿酒行业的热点[2-5]。红曲霉是非常重要的酿酒有益菌群,按真菌学的分类方法,红曲霉录属于真菌门(Eumycophyta),子囊菌纲(Ascomycetes),真子囊菌亚纲(Euascomycetes),散子囊菌目(Eurotiales),红曲菌科(Monascaceae),红曲霉属(Monascus)[6],所产酯化酶具有较强的催化己酸乙酯合成能力,是浓香型白酒酿造中一类重要的酯香菌种[7-8]。老窖出好酒,原因之一是酿酒微生物经长期驯化后,优良酿酒特性得到了很好的积淀和增强。传统的酿酒微生物分类鉴定主要集中在观察其形态和习性的水平,生理生化特征、培养特征、生态特征等方法[9-12]。使得中国传统固态酿酒微生物研究水平尚低,酿酒机理研究解释不足。随着分子生物学技术的深入发展及其在分类鉴定中的应用[13-18],如DNA 信息分析法(尤其是ITS(ITS1-5.8SrDNAITS2))分析[19-23],依托功能强大的生物信息学数据库,利用计算机进行数据分析,自动化和标准化程度高,大大简化了鉴定程序,为菌株的快速、准确、简便鉴定、以及利用提供了新型研究手段,将从根本上提升酿酒微生物菌种的分类鉴定与菌株区分,从而提升传统行业的科技水平,推动发酵工业领域发展。本研究对得到的优良酿酒功能菌分类鉴定,酶学特性分析,以期对具有中国传统特色的白酒酿造窖池中的微生物资源进行挖掘与保护,为进一步研究功能菌、利用功能菌、优化生产奠定基础。
1 材料与方法
1.1 材料与仪器
酯化功能菌LZLJ 2103,分离筛选自泸州老窖“1573 国宝窖池”。经实际应用生产实验,显示具有较强的己酸乙酯酯化能力,酯化力约为目前生产用低温曲和次高温曲的2.1 倍、高温曲的12.5 倍。
MyCycler PCR 仪 美 国 Bio - Rad 公 司;GelDocXR 核酸/蛋白凝胶图像分析管理系统 美国Bio-Rad 公司;GenomeLab GeXP(测序)分析系统 美国贝克曼库尔特有限公司;VEGA3 XMH 扫描电子显微镜 捷克TESCAN 公司。
1.2 实验方法
1.2.1 菌体培养 麦芽汁琼脂(Wa)培养基,30℃,平皿培养7d,观察菌丝体及菌落形态。麦芽汁培养基,30℃,120r/min,培养4d,过滤收集菌丝,用PBS 缓冲液冲洗3 次,纱布吸干残余水分,-20℃保存备用。
1.2.2 形态观察 平板培养,对菌落整体特征进行观察鉴定。并挑取培养后长势良好的菌丝体,固定于洁净的硅片上,真空冷冻干燥,镀金[24],采用VEGA3 TESCAN 扫描电子显微镜观察。
1.2.3 总酯的皂化法测定 取50.00mL 样液于250mL 回流瓶中,加两滴酚酞指示剂,以NaOH 标准滴定溶液滴定至粉色,记录消耗NaOH 标准滴定溶液的毫升数。再准确加入NaOH 标准滴定溶液25.00mL,摇匀,放入3 颗沸石,装上冷凝管,于沸水浴上回流30min,取下,冷却。将样液移入100mL 烧杯中,用10mL 水分次冲洗回流瓶,洗液并入烧杯。插入电极,放入一枚转子,置于电磁搅拌器上,开始搅拌,滴加硫酸标准滴定溶液,当pH9.00 后,放慢滴定速度,每次滴加半滴溶液直至pH8.70 为其终点,记录消耗硫酸标准溶液的体积。同时,吸取乙醇(无酯)溶液50.00mL,按同样操作做空白实验。计算出总酯含量。
1.2.4 酯化酶活力的测定 取25mL 酶液,加0.3mL己酸、3mL 无水乙醇、1.7mL 纯水(pH7.0),37℃酯化7d,采用皂化法测定总酯[25],计算出酶活力。
1.2.5 菌株所产酯化酶最适温度的测定 设定反应温度为10、20、30、40、50、60℃温度梯度。测定不同温度下的酶活力,以确定最适作用温度。以最高酶活为对照记做100%。(每个梯度设置3 组重复)
1.2.6 菌株所产酯化酶最适pH 的测定 采用磷酸盐(磷酸氢二钠-柠檬酸缓冲体系、磷酸二氢钠-磷酸二氢钾缓冲体系),调节酶液与底物反应体系pH 分别为3.0、4.0、5.0、6.0、7.0、8.0,于最适作用温度下,测定不同pH 下的酶活力,以确定最适作用pH。以最高酶活为对照记做100%。
1.2.7 金属离子对菌株所产酯化酶活力的影响 在酶液中添加Na+、K+、Ca2+、Fe2+、Cu2+、Mg2+各金属离子,使体系中各金属离子终浓度为1mmol·L-1,最适温度、pH 条件下,测定酶活性。以未加金属离子的酶活性为100%,比较得出金属离子的影响程度。
1.2.8 菌丝体基因组DNA 的提取及ITS 序列扩增 取菌丝体,液氮研磨后,采用改进的氯化苄法[26]提取基因组DNA,PCR 扩增ITS(ITS1-5.8SrDNA-ITS2)序列,1.5% 琼脂糖凝胶200V、15min 电泳,Glodview核酸染料染色紫外检测。扩增引物:通用引物ITS1 primer(5' - TCCGTAGGTGAACCTGCGG - 3')、ITS4 primer(5'- TCCTCCGCTTATTGATATGC-3')。PCR反应体系(25μL):DNA 模板3.0(L、10(PCR buffer 2.5μL、d-NTP mix 1.0μL 上游引物0.5μL、下游引物0.5μL、Tap 聚合酶0.5μL、双蒸水17.0μL。反应程序:95℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸2min,35 个循环;72℃补平10min。
1.2.9 序列测定、比对及系统发育分析 纯化后的PCR 产物,经TA 克隆后,采用GenomeLab GeXP 分析系统测序。对测得的供试菌的ITS 序列,用NCBI GeneBank 数据库BLAST 工具软件在DNA 序列数据库中搜索同源DNA 序列进行比对分析,选取与供试菌株亲缘关系相近的代表菌株用ClustalX2.0 和DNAMAN 软件进行比对分析,用Mega5 软件构建NJ(Neighbor-joining)系统树,同时采用DNAstar 软件进行系列间距离系数的计算。
2 结果与讨论
2.1 培养性状及形态特征
在Wa 培养基上,30℃,7d 菌落直径12~22mm,平坦,稀疏至丰厚,表面质地呈丛卷毛状,淡玫瑰粉色[27],有辐射纹;气生菌丝体初白色随菌落成熟而变成粉红色,絮状;菌丝不规律地分枝,宽度3~5μm,个别菌丝粗壮,菌丝体顶端着闭囊壳,直径15~30μm,分子孢子罕见,子囊孢子无色、卵形;菌落表面具有小而清楚的橙色渗出液;正反面具有差别,背面褶皱,燕颔红[26]。
2.2 PCR 产物克隆测序结果
测得ITS 序列长度为579bp,提交NCBI 中的GeneBank 获得Accession number 为JN869464,详细序列信息为 Internal transcribed spacer 1 + 5.8S ribosomal RNA gene +Internal transcribed spacer 2,其序列如下:
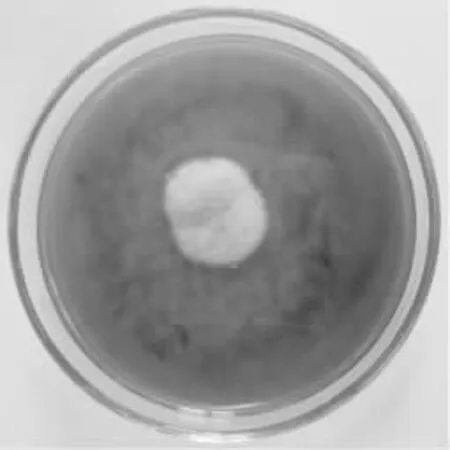
图1 LZLJ 2103 菌株菌落形态Fig.1 Colonial morphology of LZLJ 2103
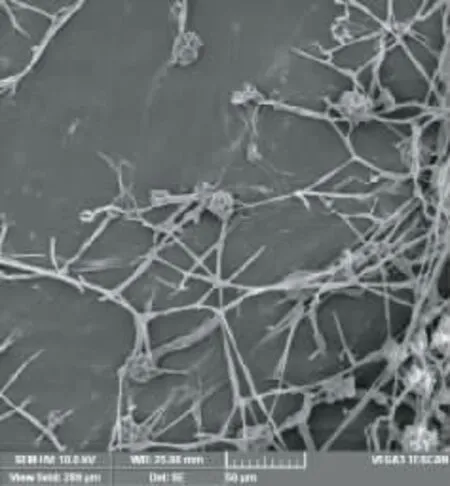
图2 LZLJ 2103 菌株扫描电镜图谱Fig.2 Scanning electron micrograph of strain LZLJ 2103

2.3 系统发育分析
通过Blast 程序与GeneBank 中核酸序列进行比对分析,结果显示LZLJ 2103(GenBank:JN869464)与红曲霉属Monascus spp.普遍具有较高的同源性。筛选的Monascus 属典型菌株用于系统发育分析(表1)。rDNA ITS 序列相似性>95%,可初步鉴别为相同属;序列相似性≥99.5%,可初步鉴定为相同种[28]。DNAstar 分析(图3)显示LZLJ 2103 ITS 序列与DQ978997.1 和HQ158608.1 相似性最高(≥99.5%),离散度小于0.5%。(G +C)%含量分别为57.34%、57.17%、57.17%,三者间有3 个碱基的差异。同时,结合进化树(图4)分析可以看出,该菌与HQ158608.1处于同一分支,与其发育关系最近。

表1 用于系统发育分析的典型菌种Table 1 Names and accession numbers of strains used for phylogenetic analysis
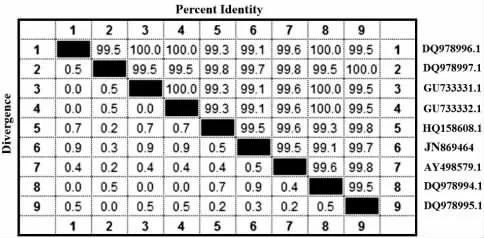
图3 基于ITS 序列的距离矩阵Fig.3 Distance matrix of LZLJ 2103 based on sequence of ITS
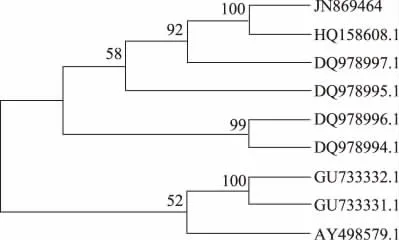
图4 基于ITS 序列的系统进化树Fig.4 Phylogenetic tree of LZLJ 2103 based on sequence of ITS
2.4 菌株所产酯化酶的酶学特性
2.4.1 最适作用温度的测定 测定菌株LZLJ 2103 所产酯化酶与底物在不同反应温度下的酶活力,如图5所示。表明该酯化酶在20~40℃时活力较高,在40℃时达到最高,为该酶最适作用温度。(p <0.05)
2.4.2 最适作用pH 的测定 pH 可改变酶构象,引起酶分子中活性中心结构变化,从而改变酶活力。图6 酶活力结果表明,在偏酸性环境下该酶活力较高,反应的适宜pH 范围为4.0~6.0,pH 为5.0 时,酶酯化活力最高。(p <0.05)
2.4.3 金属离子的影响 金属离子可以参与结合酶的活性部分,从而影响酶活。金属离子对菌株所产酶化酶活力影响见图7。结果显示金属离子Na+、K+、Mg2+、Fe2+对该酶有明显的促进作用,而Ca2+、Cu2+对该酶有抑制作用。
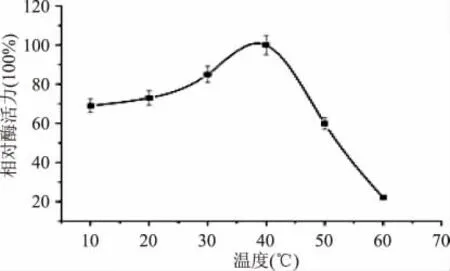
图5 温度对酶活力的影响Fig.5 Effect of temperature on esterifying activity of the crude esterase from LZLJ 2103
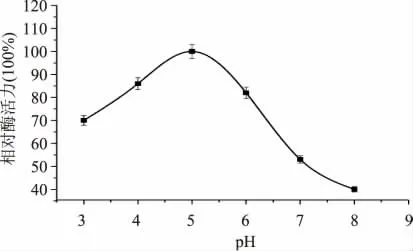
图6 pH 对酶活力的影响Fig.6 Effect of pH on esterifying activity of the crude esterase from LZLJ 2103
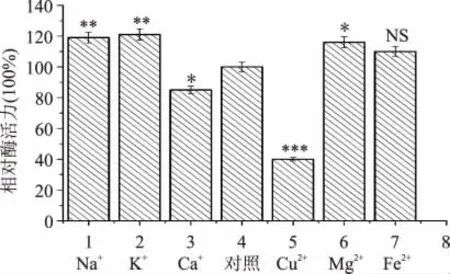
图7 金属离子对酶活力的影响Fig.7 Effect of metal ions on esterifying activity of the crude esterase from LZLJ 2103
3 结论
优良酯化功能菌LZLJ 2103 在麦芽汁琼脂培养平皿上形成菌落形态特征与Monascus purpureus 类菌在麦芽汁培养基条件下的菌落特征相似[29]。对LZLJ 2103 的ITS 序列进行分子解析,遗传距离矩阵分析显示,LZLJ 2103 与Monascus purpureus 类典型菌种具有较高的同源性,且进化距离离散度为1%以下;同时进化树结果显示处于同一分支。因此,根据形态学特征支持以及分子解析结果,基本可以判断LZLJ 2103 菌株为Monascus 属purpureus 种的一株新型优良菌株,命名为Monascus purpureus LZLJ 2103。
菌株LZLJ 2103 所产酯化酶酶学特性研究表明,最适作用温度为40℃;最适作用pH 为5.0;金属离子Na+、K+、Mg2+、Fe2+对该酶有明显的促进作用,而Ca2+、Cu2+对该酶有抑制作用。无机离子是微生物生长不可缺少的营养元素,在制曲、发酵生产中,兼顾总体平衡下,适当添加有益无机盐,控制不利因素,积极为重要功能有益菌创造最适生长条件和产酶条件,促进酯化生香,可能将对提高发酵产品质量方面提供积极的作用。
对该菌的鉴定和特性分析,为开发利用这一新型的发酵功能菌资源提供了基础数据,能为生产应用提供一定的指导。对酯化功能微生物的功能基因解析,调控模式分析,代谢通路的剖析等,有待进一步研究。
[1]中国白酒市场投资分析及前景预测报告2009-2012.中国经济信息网.http: //www.cei.gov.cn/.
[2]LiC,Lin S,Wei Z,Wu Y.Alcohol maturing method comprises using ferment with esterifying function to esterify the alcohol,where esterifying reaction is carried out in supercritical carbon dioxide environment to reduce the maturing time:CN,101591612-A[P].2009-12-02.
[3]方春玉,周健,吴华昌,等.高酯化力低产桔霉素的红曲霉诱变育种的研究[J].食品工业科技,2011,32(5) :203-205.
[4]方跃进.酯化红曲在浓香型白酒生产中的应用及实例[J].酿酒,2011,38(2) :75-78.
[5]王牛牛,雷振河,吕利华,等.以红曲霉酯化酶催化合成乳酸乙酯[J].食品工业科技,2011,37(1) :73-77.
[6]郭红珍,杨潞芳.红曲霉的研究进展[J].中国食品添加剂,2003(3) :61-63.
[7]任道群,唐玉明,姚万春,等.浓香型酒酯化酶工程的研究及其应用[J].酿酒,2009,36(4) :36-37.
[8]李钟庆,杨晓暾,郭芳.综观红曲与红曲菌[M].北京:中国轻工业出版社,2009:1-80.
[9]周德庆.微生物学教程[M].第二版.北京:高等教育出版社,2002:338-368.
[10]李红,张磊,张文学,等.一株高产酒精酵母菌的筛选及特性研究[J].中国酿造,2010,215(2) :91-93.
[11]岳元媛,张文学,刘霞,等.浓香型白酒窖泥中兼性厌氧细菌的分离鉴定[J].微生物学通报,2007,34(2) :251-255.
[12]陕小虎.中国固态白酒中酿酒微生物研究进展[A].经济发展方式转变与自主创新——第十二届中国科学技术协会年会( 第三卷) [C].中国福建: 中国科学技术协会学会,2011:1-6.
[13]盛伟,方晓阳,潘传奇.核糖体RNA 基因在蕈菌分子系统学研究中的应用[J].食品科学,2008,29(6) :453-456.
[14]侯军,林晓民,江芸,等.基于ITS 序列分析对疑似白羊肚菌株的分子鉴定[J].食品科学,2009,30(5) :141-144.
[15]谢丽源,张勇,邓科君,等.基于rDNA ITS 序列分析的桑黄真菌菌株分子鉴定[J].食品科学,2010,31(9) :182-186.
[16]Bogomolova T S,PITSIK E V,Mikhaylova Y V,et al.Molecular identification of Malassezia species by rDNA sequencing[J].Mycoses,2011,54(2) :129-130.
[17]Aditya K G,Teun B,Bart T,et al.Identification and Typing of Malassezia Species by Amplified Fragment Length Polymorphism and Sequence Analyses of the Internal Transcribed Spacer and Large-Subunit Regions of Ribosomal DNA[J].Journal of Clinical Microbiology,2004,42(9) :4253-4260.
[18]Ahmed M,Singh M,Bera A,et al. Molecular basis for identification of species/isolates of gastrointestinal nematode parasites[J].Asian Pacific Journal of Tropical Medicine,2011,4(8) :589-593.
[19]Jànos V,Beàta T,Krisztina R,et al.Phylogenetic analysis of Aspergillus section Circumdato based on sequences of the internal transcribed spacer regions and the 5.8S rRNA gene[J].Fungal Genetics and Biology,2000,30(1) :71-80.
[20]Chen Y Q,WangN,Qu L H,et al.Determination of the anamorph of Cordyceps sinensis inferred from the analysis of the ribosomal DNA internal transcribed spacers and 5.8S rDNA[J].Biochemical Systematics and Ecology,2001,29(6) :597-607.
[21]Chen X Y,Qi Y D,Wei J H,et al.Molecular identification of endophytic fungi from medicinal plant Huperzia serrata based on rDNA ITS analysis[J].World Journal of Microbiology &Biotechnology,2011,27(3) :495-503.
[22]Hanssen F,Wischnewski N,Moreth U,et al. Molecular Identification of Fitzroya Cupressoides,Seqoia Sempervirens,and Thuja Plicata Wood Using Taxon-specific rDNA-ITS Primers[J]. Iawa Journal,2011,32(2) :273-284.
[23]Hesham A E - L,Mohamed H M. Molecular Genetic Identification of Yeast Strains Isolated from Egyptian Soils for Solubilization of Inorganic Phosphates and Growth Promotion of Corn Plants[J].Journal of Microbiology and Biotechnology,2011,21(1) :55-61.
[24]Merritt S,David E,Wilford M H,et al.An endophytic Gliocladium sp.of Eucryphia cordifolia producing selective volatile antimicrobial compounds[J]. Plant Science,2003,165 ( 4) :913-922.
[25]中华人民共和国国家标准.白酒分析方法[S].GB/T 10345-2007.
[26]刘艳梅,朱建兰,杨航宇.曲霉基因组DNA 提取方法研究[J].西北农业学报,2009,18(2) :55-58.
[27]全国信息与文献标准化技术委员会出版物格式分技术委员会.设计与印刷国家标准色谱[M].辽宁: 辽宁科学技术出版社,2009:2-50.
[28]Renske L,Paula L,Thomw K,et al.Molecular identification of ectomy-corrhizal myceliumin soil horizons[J].Applied and Environ-mental Microbiology,2003,69(1) :327-333.
[29]李忠庆,郭芳.红曲菌的形态与分类学[M].北京:中国轻工业出版社,2003:1-65.
