小切口后路单纯 Cage 融合治疗慢性腰痛的疗效分析
2013-08-07贾瑞钢朱泽章
贾瑞钢 朱泽章
慢性腰痛是骨科临床常见疾病,但由于其发病机制目前尚不明确,诊断及治疗方法仍在不断探索中。对保守治疗无效的慢性腰痛患者,临床上仍广泛开展融合手术,但传统的融合手术,多采取自体髂骨块植骨或椎间融合器(Cage)辅助椎弓根螺钉固定,手术切除范围、创伤均较大,带来如邻近节段加速退变、继发椎管狭窄等问题。而近年来微创脊柱外科的发展,为慢性腰痛的治疗提供了更多选择的可能。本研究对我院2008 年~2010 年期间,行小切口后路单纯Cage 融合治疗的10 例伴腰椎终板信号改变(Modic 改变)的慢性腰痛患者疗效进行回顾性分析。
1 资料与方法
1.1 一般资料
2008 年6 月~2010 年3 月期间,共10 例慢性腰痛患者在我院行小切口后路单纯Cage 融合手术,其中男6 例,女4 例,年龄33~67 岁,平均(49.1±11.4)岁,病史1~20 年,均有超过6 个月的保守治疗史,主要表现为腰痛,2 例伴有臀部酸胀,1 例出现双足跟疼痛,无下肢神经根损害的阳性体征。术前X 线和(或)CT 提示椎间隙均有明显狭窄,累及节段均为L5/S1,MRI 显示终板Modic改变Ⅰ型7 例,Ⅱ型3 例,均无明显椎间盘突出、腰椎滑脱、椎管狭窄、节段性腰椎不稳, 怀疑关节突源性腰痛的患者,采用关节突关节封闭治疗后无明显改善(表1)。
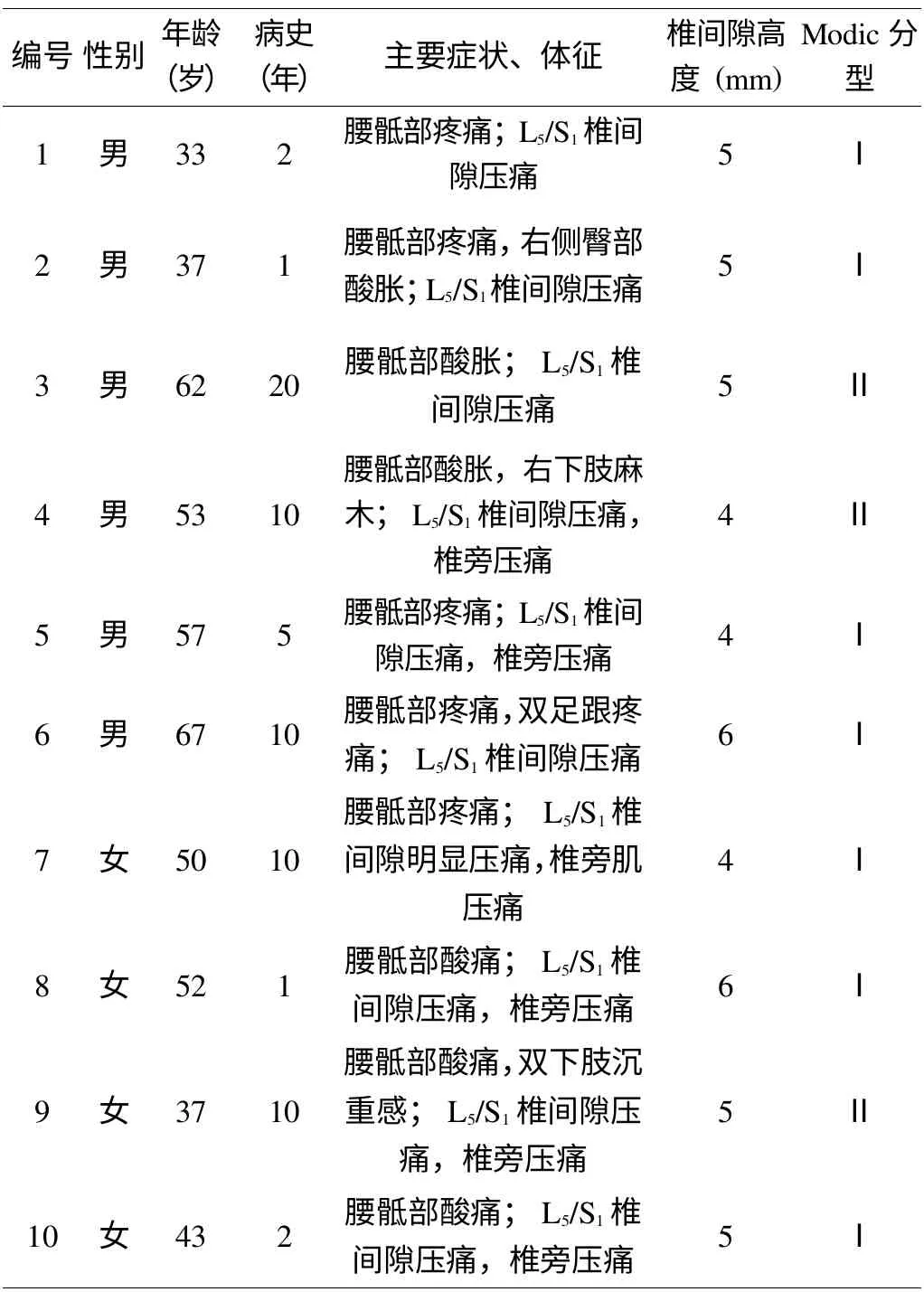
表1 10 例慢性腰痛患者术前基本资料
1.2 植入材料
1 例为钛合金(苏州欣荣公司产品),7 例为碳纤维(Sofamor,Stryker,Depuy 公司产品),2 例为聚醚醚酮(Sofamor 公司产品)。由于腰椎终板带有轻度的上凹与下凹,非金属材料均为解剖型设计(中间厚、两边薄的梭形),以期置入后更好地贴合终板。所有材料均为螺纹融合器,以期获得良好的稳定性。
1.3 手术方法
10 例患者均采用后路,头戴式显微镜下操作,通过两次椎旁最长肌及多裂肌间隙进入,通过牵开装置暴露关节突、椎板,椎板切除小于50%,关节突切除小于50%,尽量维持脊柱骨性结构的稳定性。通过神经钩牵引以保护椎管内神经根,刀片直接沿上下终板软骨切开纤维环,切除椎间盘。刮刀尽量刮除终板软骨,至新鲜出血点,以保证良好的融合床,但要保留骨性终板以预防Cage 沉陷,根据试模确定置入Cage 大小,并通过C-arm 透视证实腰骶部脊柱生理曲度正常,将去除软组织后的骨性组织(其中1 例患者由于减压所取骨组织有限,遂采用自体髂骨)咬除并填塞至Cage 中,压实,生理盐水加压冲洗椎间隙后,打压置入椎间隙,植入深度掌握在Cage 距椎体后缘约3mm,术中均做拔出试验确定Cage 是否稳定。常规椎板外放置引流管。
1.4 术后处理
术后常规给予地塞米松、营养神经药物、抗生素3 天,均佩戴支具行走至少3 个月。
1.5 观察指标及随访
术前测量累及节段椎间隙高度(X线侧位片上椎间隙前缘高度与后缘高度的平均值)。详细记录手术时间、术中失血、术后首次下地时间(翻身手术切口疼痛明显减轻后),记录术后并发症情况。术后拔出引流管后复查腰椎正侧位片,定期门诊复查腰椎正侧位X 线片,术后随访JOA 及ODI 值。术前、末次随访时采用日本矫形学会下腰痛评分法(JOA)、Oswestry 功能障碍指数(ODI)对手术疗效进行评价。
1.6 统计学分析
采用SPSS19.0 软件进行统计学分析。观察指标以均数±标准差表示,采用配对 检验对比临床结果及影像学指标,p<0.05计为有统计学差异。
2 结果
10 例患者术前测量累及节段椎间隙高度为(4.9±0.7)mm(图1),JOA 值(17.0±2.7),ODI 值(35.2±10.2)。手术切口长度25~30mm,平均手术时间、术中出血量分别为(168.5±30.0)分钟、(338.0±152.0)ml,术后初期手术节段椎间隙高度(8.0±0.5)mm,较术前明显增加(<0.01),术后首次下地时间(3.9±1.4)天(表2)。术后随访3~42 个月,平均(27.9±11.4)个月,末次随访时手术节段椎间隙高度(7.8±0.6)mm(图4),随访过程中未见明显丢失(p>0.05);JOA 值(22.4±3.7),ODI 值(18.2±11.3),术前、术后的JOA、ODI 值差异有统计学意义(JOA,=3.446,p=0.007;ODI,t=-3.197,p=0.011)。
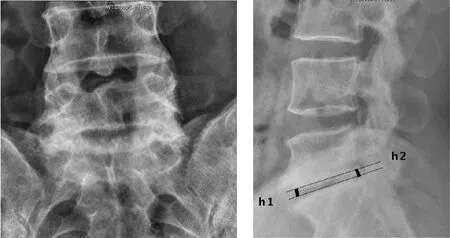
图1 患者4 术前腰椎正、侧位X 线片,提示L5/S1 椎间隙明显狭窄,椎间隙高度约4mm((h1+h2)/2)
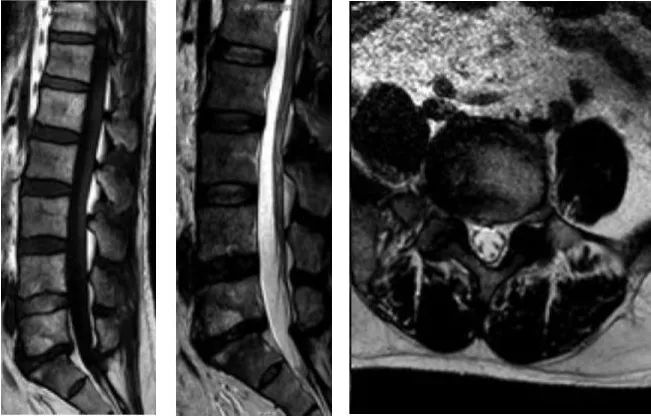
图2 患者4 术前MRI提示L5/S1T1 加权像上上下终板前2/3 高信号,T2 加权像上上下终板前2/3 高信号,无明显椎管狭窄、椎间盘突出
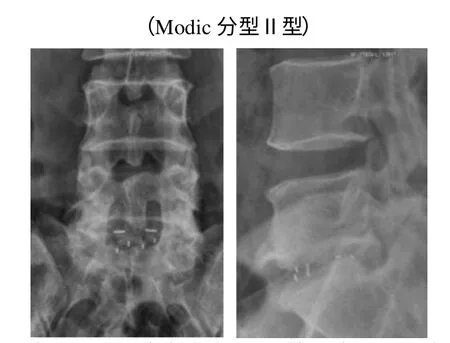
图3 患者4 术后初期X 线片,提示Cage 植入位置,L5/S1 椎间隙高度
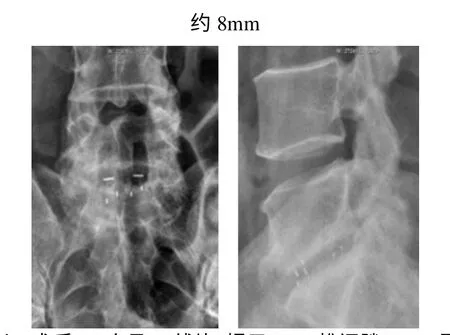
图4 患者4 术后10 个月X 线片,提示L5/S1 椎间隙8mm,融合良好
术后患者腰痛及下肢症状均有不同程度改善,但3 例患者术后早期仍诉有腰部明显酸胀(尤其下地行走时),术后3 个月酸胀感消失。9 例患者JOA、ODI 值有不同程度的改善,但患者7 术前JOA 值术前术后无明显改变,ODI 值甚至增大,即变差。患者7 术后10天开始从事轻度家务劳动,术后2 周出现下肢疼痛,腰部疼痛加重,复查X 线及CT 提示1 枚Cage 向后移位,给予封闭、镇痛治疗无改善,术后9 个月行翻修手术,调整Cage 位置,附加后路椎弓根螺钉、自体髂骨植骨融合后无改善,第二次术后3 个月再次去除内固定,腰部症状好转,下肢仍有疼痛麻木。
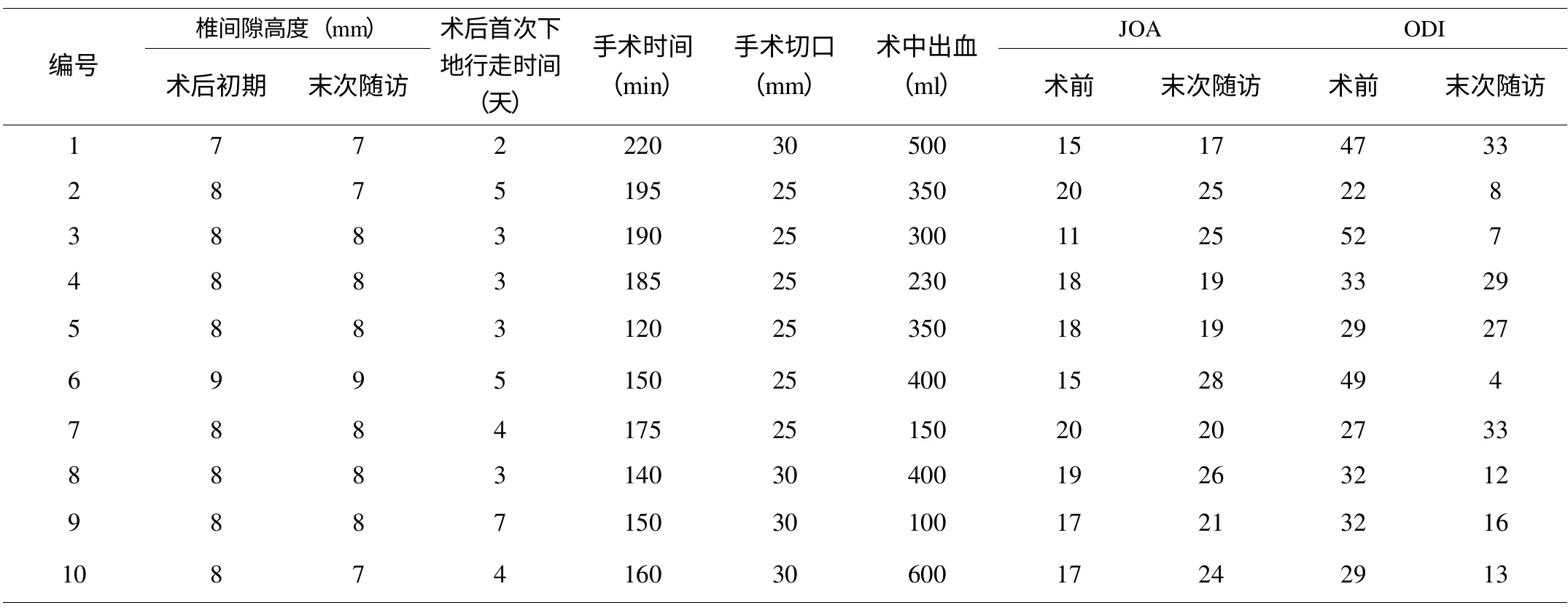
表2 10 例慢性腰痛患者术中、术后及随访情况
3 讨论
3.1 椎间盘退行性改变与慢性腰痛的关系
慢性腰痛是骨科常见疾病,约30%~40%成年人有腰痛的历史,其特点是容易复发,极大的影响了人们的工作和生活。其发生机制复杂,包括结构性病变(椎间盘退变、椎管狭窄、节段不稳定等)、炎症性病变(强直性脊柱炎、类风湿性关节炎等)、代谢性疾病(骨质疏松等)、肿瘤性腰痛等,其中椎间盘退变是主要原因之一。椎间盘退行性改变包括髓核脱水、变性,椎间隙变窄,纤维环破裂、膨出,刺激纤维环表层和后纵韧带中的痛觉纤维,产生腰痛,终板破裂、炎性改变等。事实上,椎间盘退变的发生先于椎间高度降低,X 线片发现椎间隙狭窄意味着椎间盘退变进入后期(无突出或合并突出)[1]。终板的炎性改变也是腰痛的原因之一,体外实验表明多种炎性因子参与软骨终板退变[2],终板富含神经支配[3],在炎症因子作用下可产生疼痛。在影像学上,Modic 等[4]最早系统地描述了在退变的腰椎间盘终板及终板下骨质MRI信号改变的类型、分型标准及相应的组织学变化,即Modic 改变,将终板邻近骨髓信号的变化分为三型:I 型在T1 加权像上为低信号,在T2 加权像上为高信号;Ⅱ型在Tl 加权像呈高信号,T2加权像上表现为等信号或轻度高信号,脂肪抑制像表明该变化主要由大量脂肪沉积所致(图2);Ⅲ型在T1 加权像及T2 加权像上均表现为低信号。Albert HB 等[5]在一项研究中发现随访腰痛患者期间,有9%~29%存在Modic I 型改变,表明Modic 改变(特别是I 型)与腰痛强烈的相关性。本研究中10 例患者均存在L5/S1椎间隙的明显狭窄,有终板的Modic改变,提示椎间盘明显退变,同时,未发现明显椎管狭窄、节段不稳定,因此,椎间盘退变是本研究中患者慢性腰痛的主要原因。
3.2 单纯Cage 融合的优势及适应证
长期临床实践证明腰椎融合手术是治疗腰痛的有效方法,尤其对保守治疗效果不明显的患者[6]。对椎间盘退变所致的慢性腰痛患者,切除椎间盘、终板,去除了退变的椎间盘、存在炎性反应的软骨终板及各种炎性因子,是去除腰痛的病因,同时后路切除椎间盘后,融合稳定因椎间关节、棘上、棘间韧带损伤造成的椎间不稳,有理论上的优势。
Cage是基于“撑开-压缩”原理,即利用Cage置入的撑开力使纤维环、前后纵韧带处于张力状态,结合骶棘肌收缩产生的压缩力使Cage 稳定于椎间隙。单纯应用Cage 融合具有良好的即刻稳定性与疲劳稳定性,不需要结合其他内固定辅助,即可达到临床骨融合所需稳定性[7]。早期的临床实践中,单纯应用Cage 出现较多的问题,Elias WJ 报道[8],单纯应用Cage 的67 例患者中,随访过程中发现2 例Cage 移位,10 例假关节形成。然而早期的Cage 均采用传统的后路椎板切除,对脊柱稳定性破坏较大,可能是远期并发症较多的原因之一。近年有文章报道,单纯应用Cage取得良好的疗效[9]。相比于单纯Cage 融合,使用椎弓根螺钉系统的优势在于可增加椎体的应力和稳定性,但术区显露软组织损伤大,增加了术后腰痛的几率,远期临近阶段退变加速。但临床也观察到附加内固定后仍有Cage 的移位,移位与Cage 形状和大小有关[10]。由此可见,附加椎弓根螺钉并不能完全解决Cage 移位的问题。而Cage 的轻度沉陷,可以认为是终板和Cage 融合的过程,并没有证据表明轻度的沉陷与术后慢性腰痛密切相关。
单纯使用Cage 的适应证包括:狭窄改变较轻、脊柱节段轻度不稳、保留1/2 关节突等[11]。本研究10 例患者术前均无明显椎体滑脱及节段不稳倾向,术中尽量保留关节突关节(不少于50%),未附加内固定,均植入双枚Cage,以提高融合率及稳定性。常规要求患者术后2 个月内不能从事任何体力劳动,第7 例患者出现一侧Cage 向后移位,考虑与患者出院后过早的从事家务劳动有关。
小切口Cage 后路融合有以下优势:(1)Cage 可恢复椎间孔高度,缓解非特异性神经刺激症状,同时可以减少临近关节退变[12];(2)对植骨的取材,仅1 例采用自体髂骨植骨,其余均采用咬除椎板、关节突等骨质,减少供区并发症(包括疼痛、出血、异物反应等),术后随访未见融合失败、假关节形成;(3)小切口对软组织损伤小,减少远期软组织损伤所致的慢性腰痛的发生。
3.3 手术注意事项
彻底切除终板软骨是获得椎间融合成功的基础,保留的骨性终板是椎体负重的主要支撑骨架,软骨终板的彻底去除是获得椎间融合成功的基础,而保留的骨性终板却是已失去软骨终板的椎体负重的主要支撑骨架,术中保护好骨性终板,减少术后沉陷的发生,骨性终板创面要有明显出血点,给融合提供良好的植骨床,但较难掌握。手术中小关节的切除应控制在50%以下,但要注意避免Cage 植入过程中过度牵拉神经根。Cage 要植入一定的深度,10 例患者术中通过C-arm确定植入深度,尽量将植入深度掌握在Cage 距椎体后缘约3mm。
Cage的放置应尽量在椎体中线的两侧各5mm的范围内,如果Cage 植入过于外侧,容易刺激神经根。Cage 大小的选择目前主要根据术者通过试模经验性的选择植入Cage 的大小,植入后要逐一检查是否出现松动。Cage 型号过大,椎间隙的置入空间准备不足,2 枚cage 置入后相互推挤,可导致Cage 位置不佳。过大的Cage 增加椎间隙的压力和继发终板的塌陷[13],带螺纹的Cage 植入过程中更会造成骨性终板界面的破坏。这些导致Cage塌陷风险的增加,而Cage 型号过小,融合失败和假关节形成风险增加。因此合适的Cage 大小选择是Cage 融合手术中重要的一环。X 线研究证实腰骶部脊柱生理曲度等正常,可提示Cage大小选择是否合适[12],本研究10 例患者术前椎间隙高度绝大多数有明显丢失,术中使用大于术前椎间隙高度的Cage,而产生足够的“撑开-压缩”力,很好的咬合终板,增加了Cage的稳定性,术中置入试模后,通过C 型臂透视,如腰骶部脊柱生理曲度正常,提示Cage 选择合适。3 例患者术后3 个月内出现不同程度腰部酸胀感,其椎间隙高度增加4mm,考虑与术后Cage 椎间隙明显撑开有关。
因此,小切口后路单纯Cage 椎间融合术是一种可供选择的治疗慢性腰痛的手术方法。当然,由于本研究患者数较少,随访时间较短,其远期疗效尚有待于进一步研究。
[1] 刘增胜,方明,杨玲,等.腰椎间盘退变与其高度降低的关系[J].中国医学影像技术,2011,27(2):388-91.
[2] Buser Z,Liu J,Thorne KJ,et al.Inflammatory response of intervertebral disc cells is reduced by fibrin sealant scaffold in vitro.J Tissue Eng Regen Med,2012.
[3] Lotz JC,Ulrich JA.Innervation,inflammation,and hypermobility may characterize pathologic disc degeneration:review of animal model data[J].J Bone Joint Surg(Am),2006,88:76-82.
[4] Modic MT,Masaryk TJ,Ross JS,et a1.Imaging of degenerative disk disease[J].Radiology,1988,168:177-186.
[5] Albert HB, Manniche C. Modic changes following lumbar disc herniation[J].Eur Spine J,2007,16:977-982.
[6] Phillips FM,Slosar PJ,Youssef JA,et al.Lumbar Spine Fusion for Chronic Low Back Pain due to Degenerative Disc Disease:A Systematic Review[J].Spine(Phila Pa 1976),2013,38(7):409-22.
[7] 苗军,夏群,张继东,等. 单纯腰椎前路椎间融合器即刻与疲劳稳定性的研究[J].中华医学杂志,2008,88(7):457-60.
[8] Elias WJ,Simmons NE,Kaptain GJ,et al.Complications of posterior lumbar interbody fusion when using a titanium threaded cage device[J].J Neurosurg,2000,93(1 Suppl):45-52.
[9] Costa F,Sassi M,Ortolina A,et al.Stand-alone cage for posterior lumbar interbody fusion in the treatment of high-degree degenerative disc disease:design of a new device for an“old”technique.A prospective study on a series of 116 patients[J].Eur Spine J,2011,20Suppl(1):46-56.
[10] Zhao FD,Yang W, Shan Z, et al.Cage migration after transforaminal lumbar interbody fusion and factors related to it. Orthop Surg,2012,4(4):227-32.
[11] 张绍东,唐天驷,吴小涛,等. 腰椎椎间融和器的翻修手术[J].中华骨科杂志,2004,24(9):530-533.
[12] Tang Sh, Xu W. Does Disc Space Height of Fused Segment Affect Adjacent Disc Degeneration in Anterior Lumbar Interbody Fusion?A Radiological Study[J].Iran Red Crescent Med J,2012,14(3):139-45.
[13] S.Lauber,T.L.Schulte,U.Liljenqvist,et al.Clinical and radiologic 2-4-year results of transforaminal lumbar interbody fusion in degenerative and isthmic spondylolisthesis grades 1 and 2.Spine,2006.31(15):1693-1698.
