大豆11S和7S球蛋白提取工艺优化研究
2013-07-12宋佳陈野郑晓晨韩涛纪绪前于翠柳康净坤
宋佳,陈野,郑晓晨,韩涛,纪绪前,于翠柳,康净坤
(天津科技大学食品工程与生物技术学院,天津 300457)
大豆蛋白具有含量高、氨基酸平衡性好等多种营养性和功能性,在食品工业、化学化工、医药业等领域中得到广泛的应用。大豆蛋白可分为2S、7S、11S 和15S 等4 种组分[1]。11S 组分基本上是单一蛋白质,即大豆11S 球蛋白,分子量为302,000 Da~375,000 Da,约占大豆蛋白总量25%~35%,由6 个不同的亚单位(多肽)组成的非糖蛋白,每个亚单位分别由一个酸性亚基和一个碱性亚基B 通过二硫键连接而成;7S 伴球蛋白主要指β-伴球蛋白的α、α′和β 亚基组成分子量约为180,000 Da~210,000 Da 的三聚体共轭型糖蛋白,7S 组分约占大豆蛋白30%~35%,大豆7S 球蛋白约占7S组分的80%[1]。11S 是一种不均匀的蛋白,有复杂的多晶现象,对构成四级结构有重要作用。7S 具有致密折叠的高级结构,含有的巯基和二硫键较少,而富含赖氨酸和疏水性氨基酸等[1-2]。
大豆11S 和7S 球蛋白在营养和功能特性方面有明显的不同,11S 球蛋白冷沉的特性,采用冷沉淀法,利用NaCl 改变蛋白溶液中的离子强度制备11S 球蛋白[3],此法在分离11S 球蛋白上效果好,但对7S 球蛋白的分离提取方面效果不佳,一般很少采用。11S 球蛋白的等电点为6.4,7S 球蛋白的等电点是pH4.8~4.9。目前主要是根据此原理进行7S 球蛋白和11S 球蛋白的分离[4]。Thanh[5]法分离7S 和11S 组分的方法沿用了很多年,但两种组分中都有交叉成分[6]。雷继鹏[7]等用类似原理对两种球蛋白进行分离,但分离不完全存在交叉成分,且加酸易使蛋白质变性,因此还需进一步完善。Nagano[8]等针对Thanh 法的不足,建立了等电点冷沉法,利用氯化镁、氯化钠和硫酸铵等可分级盐析得到Saios 法,此法操作简便,但纯度较低[6]。陈学玲[9]等比较了Nagano 法、Saio 法与Thanh 法提取分离球蛋白的效果,结果表明Thanh 法提取分离大豆11S球蛋白效果优于Saio 法和Nagano 法,接着对Thanh法进行改进,得出最优提取工艺条件为提取时间2 h、料液比1∶20(g/mL)、提取温度25 ℃。徐丽萍[10]采用Nagano 法确定最佳工艺参数组合为:酸沉pH6.4、Ca2+浓度40 mmol/L 和冰浴时间5 h,对分离效果影响的重要性次序是:酸沉pH>Ca2+浓度>冰浴时间。郑佳[11]等得出浸提大豆蛋白的最佳工艺参数为磷酸盐缓冲液浓度为0.02 mol/L、料液比1∶16(g/mL)、浸泡温度45 ℃、pH 为8.5,可得到最高浸提率89.55%。分离大豆11S球蛋白的最适pH 为6.2,纯度达75.76%;分离大豆7S球蛋白的最适pH 为4.7,纯度达72.99%。Zi Teng[12]等采用Deak 分离法,对比分析了Ca2+和Mg2+对分离两种球蛋白的影响,得出最优化的分馏步骤:添加5 mmol/L MgCl2,10 mmol/L NaHSO3和20 mmol/L NaCl,11S 组分在pH5.8 沉淀,接着在调至pH4.5 沉淀7S 组分。
大豆蛋白分离过程影响因素很多,如缓冲液的种类、缓冲液的pH、温度、离子强度以及还原剂等条件的选择,在一定程度上决定了两种球蛋白提取的不完全,本研究通过对关键提取条件的优化,研究了不同还原剂浓度,金属离子及离子强度、pH 对两种蛋白提取率及提取纯度的影响。
1 材料和方法
1.1 材料与仪器
1.1.1 材料与试剂
低温脱脂大豆粉:廊坊市兴宝食品有限公司。
氢氧化钠(分析纯)、盐酸(分析纯)、磷酸二氢钠、亚硫酸氢钠、无水氯化钙、氯化钾:天津市江天化工技术有限公司;磷酸氢二钠:天津市北方天医化学试剂厂;低分子量标准蛋白:中科院上海生化研究所。
1.1.2 仪器
TDL-5-A 低速台式大容量离心机:上海安亭科学仪器厂;DYY-6C 电泳仪电源、DYCZ-24D 型电泳槽:北京市六一仪器厂;HH 数显恒温水浴锅:金坛市金城国胜实验仪器厂;MODULYOD-230 型冷冻干燥机:美国热电公司;TG328A 分析天平:上海天平仪器厂;PHS-25 型pH 计:上海今迈仪器仪表公司;FW80 型高速万能粉碎机:天津市泰斯特仪器有限公司。
1.2 实验方法
1.2.1 大豆11S 和7S 球蛋白分离流程
采用碱提酸沉法,工艺流程如图1。
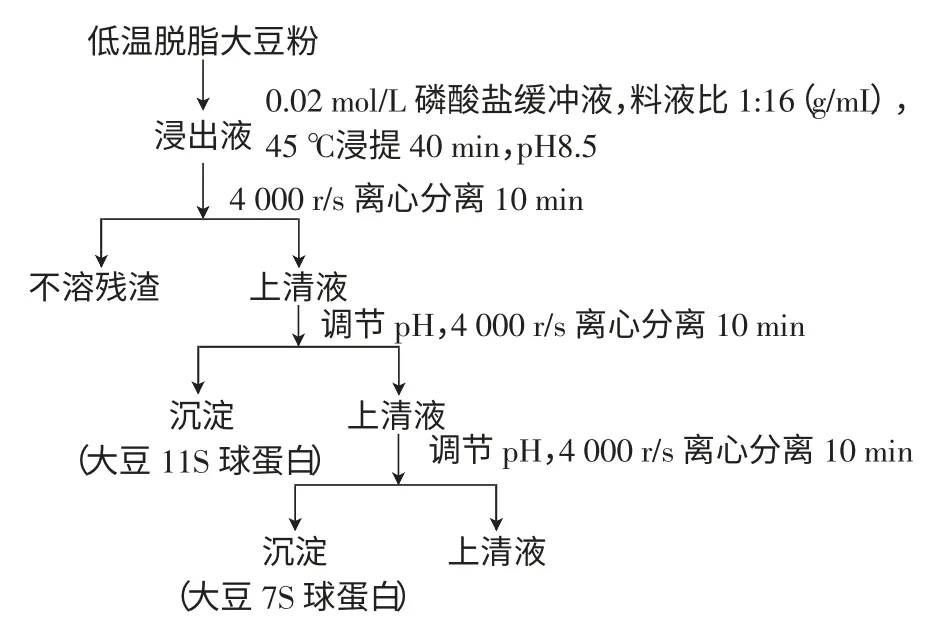
图1 大豆11S 和7S 球蛋白分离流程Fig.1 The extraction process of soybean 11 s and 7 s globulin
1.2.2 NaHSO3浓度对两种球蛋白提取率影响
按照分离流程对原料浸提处理,在调节pH 到6.4之前,离心后的浸出液中分别加入0.02、0.04、0.06、0.08、0.10 mmol/L 还原剂NaHSO3(SBS),提取两种球蛋白。与空白组对照,得出最适SBS 浓度。
1.2.3 金属离子及酸沉pH 对两种球蛋白分离效果影响
离心后的浸提液中,按2.2.4 得出的最适浓度加入SBS,再分别加入0、5 mmol/L、10 mmol/L CaCl2和0、5 mmol/L、10 mmol/L KCl,1 mol/L HCl(或NaOH)调节pH,4 ℃冷沉过夜离心分离,沉淀即大豆11S 球蛋白。pH 分别取6.4、6.2、6.0;上清液1 mol/L HCl(或NaOH)调节pH 离心分离,沉淀即7S 球蛋白。pH 分别取4.8、4.6、4.4。冷冻干燥后计算提取率,利用SDS-PAGE 凝胶电泳评定提取纯度。
1.2.4 SDS-PAGE 凝胶电泳测定分离效果
SDS-PAGE 采用不连续垂直板状凝胶电泳,上样量为15 μL~20 μL,浓缩胶浓度为12%,分离胶浓度为10%。加样完毕后,接通电源,样品进胶前电压调为90 V,样品中溴酚蓝指示剂到达分离胶后,电压升到120 V,待溴酚蓝指示剂达到分离胶端前沿0.5 cm~1 cm 处时即可停止电泳,取出电泳凝胶染色过夜,脱色后对电泳图谱进行分析。
1.2.5 蛋白质提取率计算公式
2 结果与讨论
2.1 还原剂NaHSO3浓度对两种球蛋白提取率影响
还原剂NaHSO3浓度对两种球蛋白提取率影响,见图2。
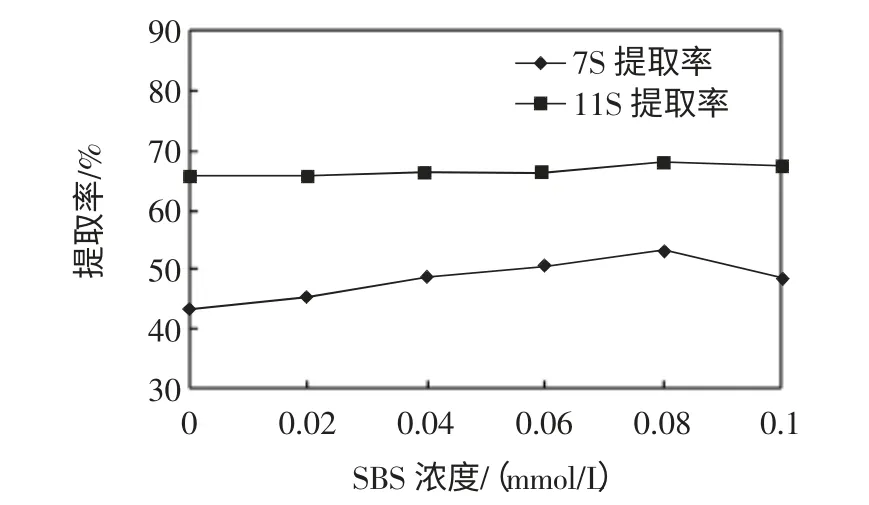
图2 还原剂NaHSO3浓度对两种球蛋白提取率的影响Fig.2 Effect of the concentration of NaHSO3on extraction yield
由图2 可知,随着SBS 浓度的增加,大豆11S 球蛋白提取率逐渐升高,SBS 浓度0.08 mmol/L 达到最高,随着SBS 浓度进一步升高,提取率随着浓度升高而下降;随着SBS 浓度增加,大豆7S 球蛋白提取率平缓增加。随着SBS 浓度升高,11S 球蛋白提取率变化比7S 球蛋白明显,可能由于11S 球蛋白六对亚基均为一个酸性亚基和一个碱性亚基以一个二硫键连接,且各个亚基上还分别含有2 到3 个半胱氨酸和胱氨酸侧链残基,11S 球蛋白易发生二硫键聚合形成大小不同的聚积体,而7S 球蛋白含半胱氨酸残基很少,只有α 和α′亚基分别含有一个-SH;SBS 主要作用于大豆蛋白的二硫键,导致蛋白聚合物解聚,从而增加蛋白质溶解度,所以适度增加SBS 浓度能破坏二硫键聚合,增加大豆11S 和7S 球蛋白之间聚合物的解聚作用,提高蛋白质浓度及溶解度。如果提取液中SBS 浓度不足,蛋白聚合物则不能完全解聚。由图1 可以看出SBS 浓度0.08 mmol/L 对于大豆7S 球蛋白与11S 球蛋白之间的聚合物具有足够强的解聚作用。因此选取SBS 浓度为0.08 mmol/L。
2.2 金属离子及酸沉pH 对两种球蛋白提取分离效果影响
2.2.1 CaCl2浓度、KCl 浓度对大豆11S 球蛋白提取率的影响
CaCl2浓度、KCl 浓度对大豆11S 球蛋白提取率的影响分别见图3、图4。

图3 CaCl2浓度对大豆11S 球蛋白提取率的影响Fig.3 Effect of the concentration of CaCl2on 11S extraction yield
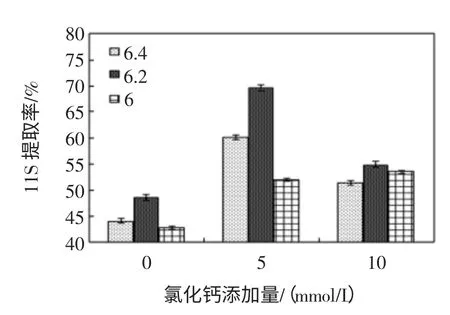
图4 KCl 浓度对大豆11S 球蛋白提取率的影响Fig.4 Effect of the concentration of KCl on 11S extraction yieid
由图3 可知,CaCl2对分馏过程的影响很大程度取决于在第一步沉淀的pH。pH 从6.4~6.2,11S 提取率显著升高,可能由于随着pH 下降蛋白质的溶解度急速下降,当pH6.0 时,提取率下降,这是因为更多的自由氢离子与Ca2+竞争蛋白分子中同一结合位点;当CaCl2添加量为5 mmol/L,11S 提取率显著高于对照组,同时pH6.2 时11S 提取率最高。Zi Teng[12]等,指出Ca2+能增加冷沉蛋白11S 的得率,二价阳离子在pH 6.4 先于7S与11S 联合在一起,可能是由于表面电荷密度的差异。随着CaCl2浓度进一步升高到10 mmol/L,11S 球蛋白的提取率降低,有可能是盐析影响,过量Ca2+导致部分蛋白发生水解或者变性,从而导致提取率又发生下降的趋势。因此添加5 mmol/L CaCl2,pH6.2 提取11S 球蛋白。
由图4 可知,三组试验中pH6.2 时11S 提取率高于其它pH,当KCl 浓度为5 mmol/L 提取率达到最高;随着浓度进一步升高到10 mmol/L,提取率下降,但是均高于对照组。可能是因为在蛋白浸取液中添加金属阳离子K+,改变了溶液中的电荷分布,增加了冷沉蛋白的得率,但K+似乎与大豆球蛋白结合能力较弱。对比图3 可知,pH 6.4~6.0,Ca2+比K+更多的与等效的球蛋白共同沉淀,CaCl2更能有效地提高11S 球蛋白的提取率。这可能是由于Ca2+的离子半径比K+小,从而Ca2+占据蛋白分子更多的结合位点。
2.2.2 CaCl2浓度、KCl 浓度对大豆11S 球蛋白提取纯度的影响
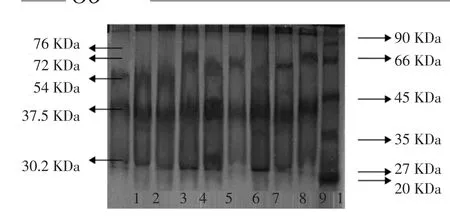
图5 CaCl2浓度、KCl 浓度对大豆11S 球蛋白提取纯度的影响Fig.5 Effect of the concentration of CaCl2and KCl on 11S extraction purity
由图5 可以看出,当pH6.4~6.2 时11S 酸性亚基和碱性亚基相对含量达到最高,之后随pH 降低到6.0而降低。经分析,Lane5 的大豆11S 球蛋白纯度最高,达到78.3%。KCl 对11S 提取纯度的影响没有CaCl2显著,这种结果也与图3、图4 的结果一致。即:CaCl2浓度5 mmol/L,pH6.2,11S 电泳效果最佳。
2.2.3 CaCl2浓度、KCl 浓度对大豆7S 球蛋白提取率的影响
CaCl2浓度、KCl 浓度对大豆7S 球蛋白提取率的影响,见图6、图7。
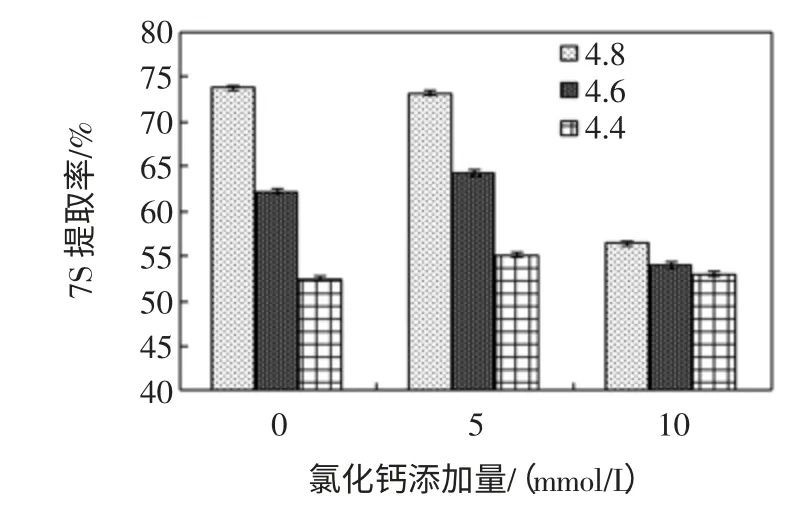
图6 CaCl2浓度对大豆7S 球蛋白提取率的影响(第一次沉淀pH6.2)Fig.6 Effect of the concentration of CaCl2on 7S extraction yield(the first precipitation pH value 6.2)
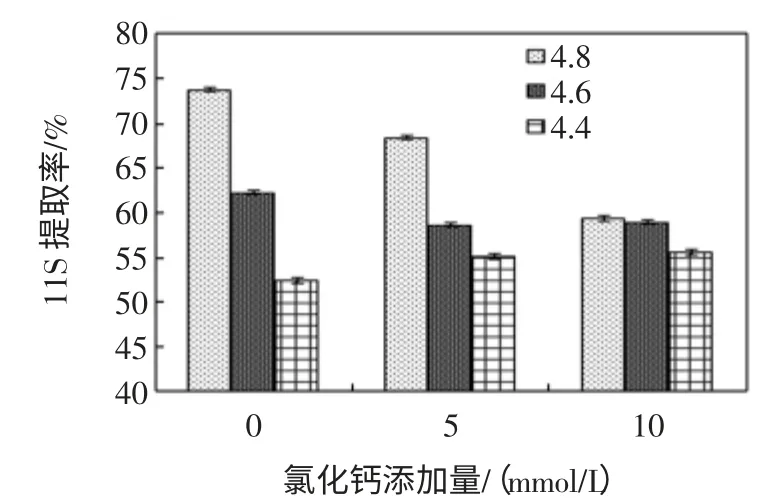
图7 不同pH 值下KCl 浓度对大豆7S 球蛋白提取率的影响(第一次沉淀pH6.2)Fig.7 Effect of the concentration of KCl on 7S extraction yield(the first precipitation pH value 6.2)
由图6 可知,三组试验均表明随着pH 下降,7S 球蛋白提取率也下降,这种趋势与11S 球蛋白相反,这种现象似乎与两种球蛋白在不同pH 的溶解度相一致;当对照组二次沉淀pH4.8,7S 提取率最高;在pH4.8时,随着CaCl2浓度的增加,7S 球蛋白提取率逐渐降低,这与Zi Teng[12]等研究结论一致,当沉淀剂的浓度增加时,伴球蛋白的产量降低纯度增加;在pH4.6 和4.4下,随着CaCl2浓度的增加,提取率变化不明显,但是均低于同浓度下pH4.8 时7S 球蛋白提取率。原因可能是大豆蛋白的静电荷几乎为零,因此阳离子蛋白间的电荷相互作用可以忽略不计。考虑到在pH4.8 时,对照组与添加5 mmol/L CaCl2的7S 球蛋白提取率相差不显著,为使11S 和7S 球蛋白相对含量都达到最优,因此二次沉淀pH 为4.8 提取7S 球蛋白。
由图7 可知,KCl 浓度对二次沉淀阶段不同pH 大豆7S 球蛋白提取率影响同图6 的变化趋势无显著差异。三组试验均表明随着pH 下降,7S 球蛋白提取率逐渐下降;对照组二次沉淀pH4.8 时,7S 球蛋白提取率最高;pH4.8 时,随着KCl 浓度的增加,7S 提取率逐渐降低;在pH4.6 和4.4 下,随着KCl 浓度的增加,7S 提取率变化不显著,但是均低于同样浓度下在pH4.8 下的提取率。结合图6 和7,CaCl2浓度对两种蛋白提取率的影响比KCl 显著,这个结果进一步证实了前面的推论:即钾离子与大豆蛋白的结合能力不如钙离子强。实验结果表明:添加CaCl2不仅有利于两种球蛋白的分离,更有助于增加11S 的提取率。
2.2.4 不同pH 对大豆7S 球蛋白提取纯度的影响

图8 不同pH 对大豆7S 球蛋白提取纯度的影响(第一次沉淀pH6.2)Fig.8 Effect of different pH value on 7S extraction purity(the first precipitation pH value 6.2)
由图8 可以看出,pH4.4~4.8,α、α′和β 亚基相对含量随pH 的升高而升高。经分析,六条泳道中,Lane3的大豆7S 球蛋白纯度最高,达到71.1 %。pH4.8,5 mmol/L KCl 条带酸性亚基含量较高,导致7S 纯度相对较低。因此选择添加5 mmol/LCaCl2条件下二次沉淀pH 为4.8 的7S 电泳效果最佳。
3 结论
本研究以低温脱脂大豆粉作为原料提取大豆11S和7S 球蛋白,采用碱提酸沉法进行两种球蛋白分离,在分离大豆11S 球蛋白前加入浓度为0.08 mmol/L 还原剂SBS 可以增加两种球蛋白间的解聚作用,从而可以提高两种球蛋白提取率;研究不同的金属离子及离子强度对大豆11S 和7S 球蛋白在不同的酸沉pH 下的提取率及提取纯度的影响,从而得出提取分离两种球蛋白的优化方案。结果表明:浸提液离心后添加0.08 mmol/L NaHSO3,再添加5 mmol/L CaCl2,调节pH6.2,4 ℃冷沉过夜,离心分离大豆11S 球蛋白,提取量达到最高值15.5 g,提取率达到82.8%,纯度达78.3%;上清液调节pH4.8,离心分离大豆7S 球蛋白,提取量达到最高值13.7 g,提取率达到73.2%,纯度达到71.1%。新的优化工艺使大豆11S 和7S 球蛋白样品在得率和纯度上均有较大程度的提高。
[1]周瑞宝,周兵.大豆7S 和11S 球蛋白的结构和功能性质[J].中国粮油学报,1998,13(6):39-42
[2]刘珊珊,武小霞,姜振峰,等.大豆7S 球蛋白β-伴大豆球蛋白的研究现状[J].大豆科学,2007,26(3):417-421
[3]陈振家,郝利平.大豆7S 伴大豆球蛋白和11S 球蛋白亚基分析[J].山西农业大学学报,2009,29(2):111-114
[4]Wolf W J.Physical and chemical properties of soybean proteins [J].Am Oil Chemist′s Soc,1997,54(2):112a-117a
[5]Thanh V H,Shibasaki K.Major proteins of soybean seeds,a straight forward fraction and their characterization [J].Agric Food Chem,1976,24:1117-1121
[6]李成贤,周安国,王之盛,等.大豆主要抗原蛋白分离及测定方法的研究[J].大豆科学,2007,26(4):618-622
[7]雷继鹏,田少君,李晓霞.分离7S 和11S 大豆球蛋白的简便方法[J].粮食与石油,2003,23(6):6-7
[8]Nagano T,Hirotsuka M,Mori H.Dynamic viscoelastic study on the gelation of 7S globulin from soybeans[J].J Agric,Food Chem,1992,40:941-944
[9]陈学玲,罗金国,何建军,等.大豆11S 球蛋白提取分离方法研究[J].中国粮油学报,2007(1):35-44
[10]徐丽萍.大豆蛋白11S 组分的分离方法研究[J].中国粮油学报,2007,22(3):47-49
[11]郑佳,石彦国.大豆7S 和11S 球蛋白分离方法的研究[J].中国调味品,2009,34(4):31-35
[12]Zi Teng,Liu Xiaoquan,Lin Li.Fractionation of Soybean Globulins Using Ca2+ and Mg2+:A Comparative Analysis [J].J Am Oil Chem Soc,2009,86:409-417
[13]Rickert D A,Johnson L A,Murphy P A.Improved fractionation of glycinin and beta-conglycinin and partitioning of phytochemicals[J].J Agric Food Chem,2004,52:1726-1734
[14]Wu S W,Murphy P A,Johnson L A,et al.Simpified process for soybean glycinin and beta-conglycinin fractionation[J].J Agric Food Chem,2000,48:2702-2708
[15]邵帅,曲晓波.蛋白质提取分离和结构鉴定技术[J].长春中医药大学学报,2006,2(6):82-83
