CIK细胞治疗恶性实体瘤的临床疗效评价
2013-06-23罗利琼王继红张小丽马玉芳
罗利琼 王继红 霍 丹 张小丽 张 高 胡 林 马玉芳*
(武汉科技大学附属天佑医院肿瘤科,湖北 武汉 430064)
CIK细胞治疗恶性实体瘤的临床疗效评价
罗利琼 王继红 霍 丹 张小丽 张 高 胡 林 马玉芳*
(武汉科技大学附属天佑医院肿瘤科,湖北 武汉 430064)
目的 评价 CIK 细胞治疗恶性实体瘤的临床疗效及安全性。方法 选择恶性实体瘤患者 48 例,分为单纯化疗组、CIK 细胞联合化疗治疗组、CIK 细胞治疗组。采用卡氏评分(Karnofsky)评价生活质量及体力改善状况;通过比较客观有效率和疾病控制率评价近期疗效;从治疗开始至患者死亡或最后 /次随访时间止,观察并记录患者的生存时间;评价 CIK 细胞治疗安全性。结果 CIK 治疗组患者治疗后一般情况有所改善,特别是在改善食欲和睡眠,增加体质量和体力方面。这可能是 CIK 细胞治疗的优势所在。但是三组患者在客观有效率方面和疾病控制率方面,单纯化疗组和 CIK 细胞联合化疗治疗组,与 CIK 治疗组有显著性差异(P< 0.05)。在生存时间方面 CIK 治疗组患者的生存时间低于单纯化疗组和 CIK 细胞联合化疗治疗组(P< 0.05)。在整个临床观察期间,除有 2 例患者出现低热症状外,未出现其他不良反应。结论 CIK细胞免疫治疗能改善患者的一般状况,安全性好,是恶性实体瘤的患者在进行化疗治疗之余的有效辅助治疗手段。
细胞因子诱导的杀伤细胞;过继免疫疗法;恶性实体瘤
肿瘤的生物治疗具有较强的针对性、特异性、有效性,对正常造血及免疫系统、主要器官无负面影响和明显毒性,渐已成为肿瘤治疗的第四种治疗形式。肿瘤生物治疗主要有5类:细胞因子治疗、单克隆抗体及其耦联物技术、基因治疗、过继细胞治疗和肿瘤疫苗治疗[1-6]。CIK细胞治疗可以用于各种各期恶性实体肿瘤在手术、放化疗等治疗后的巩固治疗,以提高机体的免疫功能,抑制肿瘤复发和转移;也可以用于不适宜做手术、放化疗等治疗的肿瘤患者,以提高机体免疫功能和延长生存期。目前,CIK细胞治疗被认为是具有较好的应用前景的过继细胞治疗[7-11]。恶性实体瘤疾病采取了各种治疗措施,患者的预后仍然可能是不佳,生存期短,特别是晚期恶性实体瘤患者的一般情况则是每况愈下,机体消耗明显。目前,越来越多的体内体外实验结果证实:CIK细胞治疗具有毒不良反应少和延长生存期等优点,是一种相对低毒和有效的细胞治疗。本研究比较单纯化疗、化疗联合CIK细胞序贯治疗、CIK细胞治疗的近期疗效和生存期,并评价对恶性实体瘤患者一般情况的改善,为以后的广泛应用提供一定的临床依据。
1 材料与方法
1.1 CIK细胞的制备
CIK细胞由深圳市中美康士生物科技有限公司提供。在深圳市中美康士生物科技有限公司的生物细胞中心GMP实验室进行诱导、培养,每次换液后及细胞回输前进行无菌检测,每次检测结果均为阴性,方可给患者进行回输。CIK细胞需要经过12~14d培养,单次回输细胞量约为(1~2.0)×109。
1.2 病例选择
选择2008年7月至2012年7月医院肿瘤科恶性实体瘤的患者48例分组研究,主要为非小细胞肺癌。患者中位年龄68(44~79)岁;预计生存期≥3个月;KPS评分≥60;无严重心、肝、肾功能损害。
1.3 治疗分组
将所有患者随机分为三组:①单纯化疗组(A组):采用方案化疗,共2~4周期;②CIK细胞联合化疗治疗组(B组):采用化疗治疗(2~4周期)和CIK细胞联合序贯治疗(2~4周期),在化疗结束后1个月开始将制备好的CIK细胞回输入患者体内。回输前给予患者肌内注射盐酸异丙嗪和地塞米松预防过敏。每次回输CIK细胞数为(1.0~2.0)×109左右,间隔4周治疗/次,共回输治疗2~4次。③CIK细胞治疗组(C组):每次回输CIK细胞数为(1.0~2.0)×109左右,间隔4周治疗/次,共回输治疗2~4次。

表2 在2~4周期治疗后三组患者客观缓解率和疾病控制率比较(n=48,χ—±s)
1.4.1 生活质量评估生活质量及体力改善状况
采用卡氏评分(Karnofsky)评价,提高超过10分者为改善,下降超过10分者为恶化,提高或下降少于10分者为稳定。评分总提高率为改善+稳定。
1.4.2 近期疗效评价
按RECIST实体瘤的近期疗效标准分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)4级。每两周期治疗后进行疗效评价。客观有效率(ORR)=(CR+PR)/总例数×l00%,疾病控制率(DCR)=(CR+PR+SD)/总例数×l00%。
1.4.3 生存时间分析
从治疗开始至患者死亡或末次随访时间截至,观察三组患者生存期,无瘤生存状况,以定期进行的影像学检查发现复发病灶为止。
1.4.4 安全性评价
毒副反应观察在静脉回输过程后,密切观察患者的不良反应,特别注意观察患者的发热情况,及时予以处理。
1.5 统计学分析
采用SPSS13.0软件进行统计学处理,数据用均数±标准差(χ—± s)表示,组间比较采用单因素方差分析法,近期疗效比较采用卡方检验,Kaplan-Meier法描述生存时间(P<0.05表示差异有统计学意义)。
2 结 果
2.1 生活质量评估及体力改善状况
CIK治疗组患者治疗后一般情况有所改善,特别是在食欲、睡眠改善(90%),体质量增加方面(85%),体力改善方面(95%),比较明显。不难得出,CIK治疗组患者在一定程度上可以改善肿瘤进展引起的食欲差和睡眠差等问题,而且可增强患者的食欲,增加体质量。细胞治疗前后Karnofsky评分结果比较有统计学差异(P<0.05),见表1。
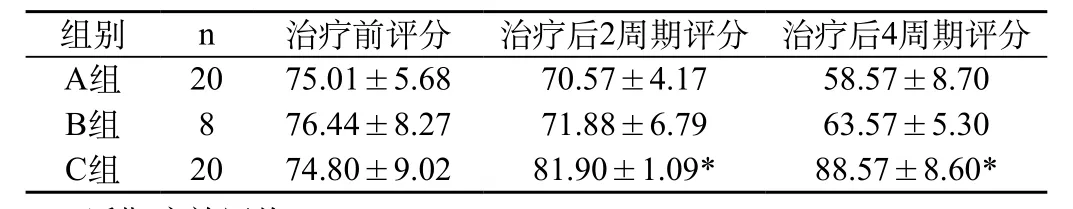
表1 CIK细胞治疗前后Karnofsky评分(n=48,χ—±s)
2.2 近期疗效评价
在2~4周期治疗后三组患者在客观有效率方面,单纯化疗组和CIK细胞联合化疗治疗组,与CIK治疗组有显著性差异。但在疾病控制率方面,CIK细胞联合化疗治疗组,优于单纯化疗组和CIK治疗组;单纯化疗组和CIK治疗组无统计学差异(P<0.05),见表2。
2.3 生存时间分析
三组患者治疗后全部进行随访,至2012年7月随访6~40个月,中位随访27个月。单纯化疗组总生存期为6~40月,中位生存期为18个月;CIK细胞联合化疗治疗组患者总生存期为8~42个月,中位生存期为20个月;CIK治疗组患者总生存期为4~20个月,中位生存期为6个月。三组比较有明显差别,CIK治疗组明显低于单纯化疗组和CIK细胞联合化疗治疗组(P<0.05)。
2.4 安全性评价
仅有2例患者出现发热症状,但体温在37.8~38.5℃,持续1~2 d,经对症处理均好转。未见其他的不良反应。
3 讨 论
细胞因子活化杀伤细胞输注治疗(CIK),又称为细胞因子诱导的杀伤细胞。它是将人的外周血单个核细胞在体外用多种细胞因子(如IL-2,IL-1α,IFN-γ等)共同培养一段时间后获得的一群异质细胞,由于同时表达CD3和CD56两种两膜蛋白分子,兼具有T淋巴细胞的抗肿瘤活性和NK细胞的非MHC限制性杀瘤优点,故具有杀瘤活性高、杀瘤谱广等特点。因此,CIK细胞免疫治疗因其低毒有效的特点,在临床上越来越受到重视[12-15]。本实验以本院治疗的恶性实体瘤的患者(主要为晚期非小细胞肺癌的患者)为研究对象,在整个临床观察期间,除有2例患者出现低热症状外,未出现其他不良反应,表明CIK细胞联合化疗的治疗方案是比较安全的。同时,CIK治疗组患者治疗后一般情况有所改善,特别是在改善食欲和睡眠,增加体质量和体力方面。这可能是CIK细胞治疗的优势所在。但是三组患者在客观有效率方面和疾病控制率方面,单纯化疗组和CIK细胞联合化疗治疗组,与CIK治疗组有显著性差异(P<0.05)。在生存时间方面CIK治疗组患者的生存时间低于单纯化疗组和CIK细胞联合化疗治疗组。这可能与CIK细胞通过调动机体的免疫系统来抵抗肿瘤细胞的增殖和扩散能力及持续的时间有关。本实验结果表明,CIK细胞免疫治疗安全性好、不良反应少,能改善患者的一般状况,是恶性实体瘤的患者在进行化疗治疗之余的有效辅助治疗手段。
[1]Blattman JN,Greenberg PD.Cancer immunotherapy: a treatment for the masses[J].Science,2004,305(5681):200-205.
[2]Hoffman DM,Gitlitz BJ,Belldegrun A,et al.Adoptive cellular therapy[J].Seminars in Oncology,2000,27(2):221- 233.
[3]Kim YJ,Lim J,Kang JS,et al.Adoptive immunotherapy of human gastric cancer with ex vivo expanded T cells[J].Arch Pharm Res, 2010,33(11):1789-1795.
[4]陈广华,吴德沛.自然杀伤细胞过继性免疫治疗研究进展[J].中国实验血液学杂志,2010,18(3):798-802.
[5]Schoenfeld J,Jinushi M,Nakazaki Y,et al.Active immunotherapy induces antibody responses that target tumor angiogenesis[J]. Cancer Res,2010,70(24):10150-10160.
[6]Gomes AQ,Martins DS,Silva-Santos B.Targeting gammadelta T lymphocytes for cancer immunotherapy:from novel mechanistic insight to clinical application[J].Cancer Res,2010,70(24):10024-10027.
[7]Linn YC,Hui KM.Cytokine-induced NK-like T cells:from bench to bedside[J].J Biomed Biotechnol,2010,2010(43):435745-435750.
[8]Shi M,Zhang B,Tang ZR,et al.Autologous cytokine-induced killer cell therapy in clinical trial phase I is safe in patients with primary hepatocellular carcinoma[J].World J Gastroenterol,2004,10(8): 1146-1151.
[9]Sa YL,Hua YK,Yan XM,et al.The preliminary clinical application of adoptive immunotherapy with auto-cytokine induced killer cells in the patients with malignant solid tumor [J].Pract J Cancer, 2006,21(1):11-14.
[10]Zhao M,Wu PH,Zeng YX,et al.Cytokine- induced killer cell fusion to lower recurrence of hepatocellular carcinoma after transcatheter arterial chemoembolization sequentially combined with radiofrequency ablation:a randomized trial [J].Zhonghua Yi Xue Za Zhi, 2006,86(26):1823-1828.
[11]Olioso P,Giancola R,Di Riti M,et al.Immunotherapy with cytokine induced killer cells in solid and hematopoietic tumours:a pilot clinical trial[J].Hematol Oncol,2009,27(3):130-139.
[12]Bonanno G,Iudicone P,Mariotti A,et al.Thymoglobulin,interferonγand interleukin-2 efficiently expand cytokine-induced killer (CIK) cells in clinical-grade cultures[J].J Transl Med,2010,8(1): 129-137.
[13]Helms MW,Prescher JA,Cao YA,et al.IL-12 enhances efficacy and shortens enrichment time in cytokine-induced killer cell immunotherapy[J].Cancer Immunol Immunother,2010,59(9):1325-1334.
[14]Wu C,Jiang J,Shi L,et al.Prospective study of chemotherapy in combination with cytokine-induced killer cells in patients suffering from advanced non-small cell lung cancer [J].Anticancer Res,2008, 28(6B):3997-4002.
[15]Kimura H,Iizasa T,Ishikawa A,et a l.Prospective phaseⅡstudy of post-surgical adjuvant chemo-immunotherapy using nautologous dendritic cells and activated killer cells from tissue culture of tumordraining lymph nodes in primary lung cancer patients[J].Anticancer Res,2008,28 (2B):1229-1238.
Evaluation of the Clinical Efficacy of CIK Cell for Malignant Solid Tumors
LUO Li-qiong, WANG Ji-hong, HUO Dan, ZHANG Xiao-li, ZHANG Gao, HU Lin, MA Yu-fang
(Department of Oncology, the Tianyou Hospital Affiliated to Wuhan University of Science and Technology, Wuhan 430064, China)
ObjectiveTo evaluate the clinical efficacy and secruity of CIK cell for malignant solid tumors.Methods48 patients who suffered from malignant solid tumors, were divide into the chemotherapy alone group, CIK cells combined with chemotherapy treatment group and CIK treatment group. Evaluation of the quality of life and physical strength to improve the situation with karnofsky score; to compare overall response rate and disease control rate among the three groups; death from the start of treatment to patients or follow-up time for the last / time to observe and record the patient's survival time; security evaluation CIK cell therapy.ResultsCIK treatment group particularly improved appetite and sleep, increased body weight and physical aspects. This may be the advantage of the CIK cell therapy. But the three groups of patients in overall response rate and disease control rate, the chemotherapy alone group and CIK cells combined with chemotherapy treatment group, a significant difference (P<0.05) with CIK treatment group. CIK treatment group patients survival time is less than the chemotherapy alone group and CIK cells combined with chemotherapy treatment group (P<0.05). Throughout the clinical observation period, except for two cases of patients with low-grade fever symptoms, not the other adverse reactions.ConclusionCIK cell immunotherapy can improve the patient's general condition, security is an effective means of adjuvant therapy in patients with malignant solid tumors during chemotherapy treatment.
Cytokine-induced killer cells (CIK); Adoptive immunotherapy; Malignant solid tumors
R730.58
:B
:1671-8194(2013)08-0034-03
*通讯作者
