PTEN、p16、突变型 p53在膀胱癌组织中的表达及意义
2013-06-14王新华孟宪杰
王新华,崔 涌,孟宪杰
(石河子人民医院,新疆石河子832000)
膀胱尿路上皮癌的发生发展是一个多因素、多基因作用的复杂过程,与癌基因的激活和抑癌基因的失活密切相关。通常认为,遗传学上的基因突变是肿瘤发病机制中的关键事件,尤其是抑癌基因突变,与肿瘤的发生有密切关系。本研究通过检测膀胱癌组织中抑癌基因PTEN、p16及突变型p53的表达情况,探讨PTEN、p16、突变型p53在膀胱癌组织中的表达及意义。
1 资料与方法
1.1 临床资料 选择2005年1月~2010年10月在石河子人民医院行手术切除的膀胱癌患者45例,男30例、女15例,年龄38~80岁、中位年龄65岁,术前均未经过放化疗。经病理检查证实为膀胱癌,肿瘤分级按WHO的分级标准,低级别尿路上皮癌24例,高级别尿路上皮癌21例。取手术切除的膀胱肿瘤组织标本作为观察组。对照组为12例前列腺增生、膀胱结石、输尿管囊肿患者经膀胱手术所取正常膀胱黏膜组织。
1.2 方法
1.2.1 检测方法 将标本用10%中性甲醛固定,石蜡包理,连续切4μm厚切片。采用免疫组化SP法检测组织中PTEN、p16、突变型p53的表达,操作步骤严格按照说明书进行。PTEN为鼠抗人单克隆抗体,p16为鼠抗人单克隆抗体,突变型p53为鼠抗人单克隆抗体,均购自中杉生物技术公司。PBS代替一抗作阴性对照。切片脱蜡水化后,3%H2O2室温处理10 min,抗原热修复,血清室温孵育10 min,滴加一抗,4℃过夜,滴加生物素标记的二抗,室温孵育10 min,滴加辣根过氧化酶标记的链亲和素,室温10 min显色。苏木精复染,脱水,透明,封片。以细胞质或细胞核呈棕黄色为阳性细胞,每例随机观察10个高倍视野,计算阳性细胞百分率,阳性细胞百分率≥5%为阳性,<5%或缺乏为阴性。
1.2.2 统计学方法 采用 SPSS13.0统计软件,PTEN、p16及突变型p53表达与各病理指标的相互关系比较采用χ2检验和四格表的精确概率法判断。P≤0.05为差异有统计学意义。
2 结果
2.1 PTEN、p16、突变型p53在膀胱癌和正常膀胱组织中的表达比较 PTEN阳性反应大多定位于细胞质(见图1),膀胱癌和正常膀胱组织中的阳性表达率分别为44.4%(20/45)和91.7%(11/12);p16阳性反应定位于细胞质或细胞核(见图2),在膀胱癌和正常膀胱组织中的阳性表达率分别为42.2%(19/45)和100%(12/12);突变型p53阳性反应定位于细胞核(见图3),在膀胱癌和正常膀胱组织中的阳性表达率分别为46.7%(21/45)和16.7%(2/12)。三者在膀胱癌和正常膀胱组织中的表达比较均有统计学差异(P均<0.05)。
2.2 膀胱癌组织中PTEN、p16、突变型p53的表达与临床病理特征的关系 见表1。
2.3 PTEN、p16、突变型 p53的相关性 20例PTEN表达阳性组织中,p16表达阳性12例(60.0%);25例PTEN表达阴性组织中,p16表达阳性7例(28.0%);两者比较有统计学差异(P<0.05)。19例p16表达阳性组织中,突变型p53表达阳性12例(63.2%);26例p16表达阴性组织中,突变型p53阳性表达9例(34.6%);两者比较无统计学差异(P>0.05)。20例PTEN表达阳性组织中,突变型 p53表达阳性 11例(55.0%);25例PTEN表达阴性组织中,突变型p53阳性表达10例(40.0%);两者比较无统计学差异(P >0.05)。
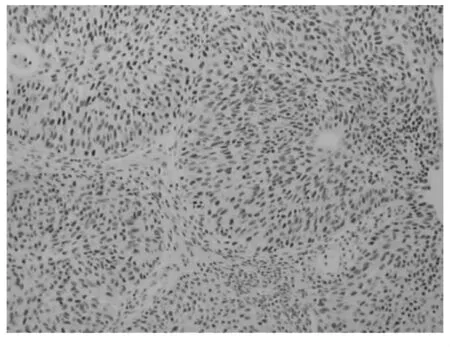
图1 p16在膀胱癌组织中的阳性表达(×200)
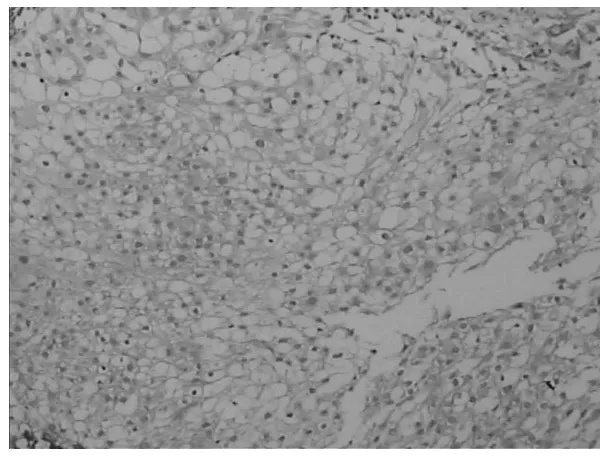
图2 PTEN在膀胱癌组织中的阳性表达(×200)
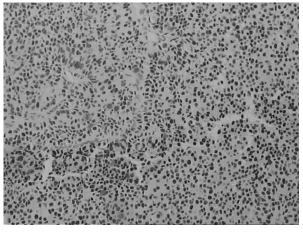
图3 p53在膀胱癌组织中的阳性表达(×200)
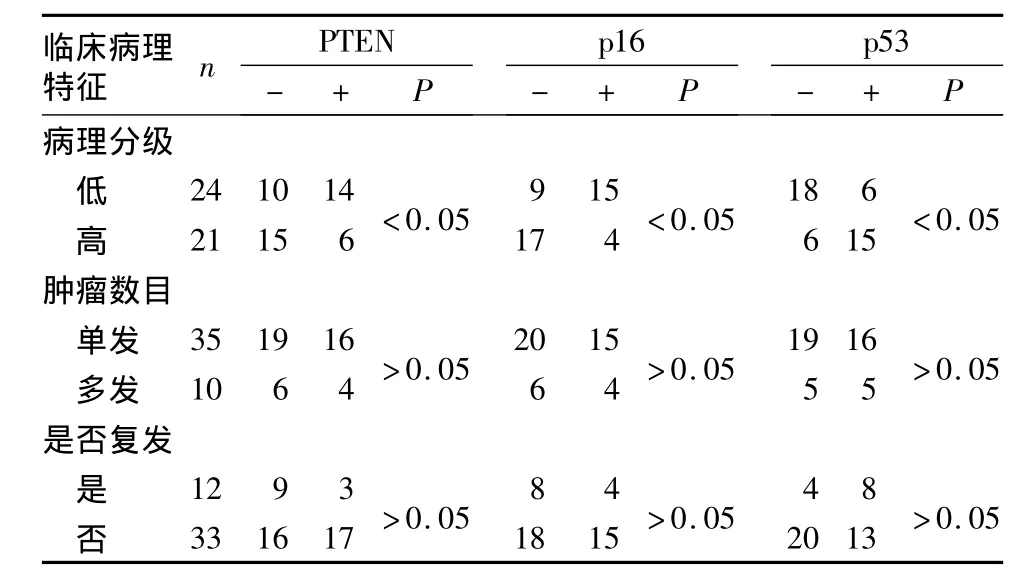
表1 PTEN、p16、突变型p53的表达与膀胱癌的临床病理特征的关系(例)
3 讨论
膀胱癌是泌尿外科最常见的恶性肿瘤,其中90% ~95%是尿路上皮癌[1]。目前,浸润性膀胱癌仍是患者死亡的主要原因,手术切除肿瘤是膀胱癌的常规治疗方法,然而术后复发率高、易进展导致患者病死率升高。为了更好地监测膀胱癌的进展,国内外学者进行了大量研究,但目前尚无理想的评价膀胱癌生物学行为的方法和标记物。
PTEN是第一个被发现具有磷酸酶活性的抑癌基因,其定位于染色体10q23.3,编码PTEN蛋白,参与氨酸磷酸酶和丝氨酸/苏氨酸磷酸酶介导的信号传导过程,使第二信使PIP3去磷酸化,从而抑制细胞生长和凋亡,在多种肿瘤中频发突变和缺失,其异常表达已证实与多种肿瘤的发生发展密切相关[2]。Tsuruta等[3]研究显示,PTFN基因失表达与膀胱癌的分级、分期密切相关,并促进肿瘤细胞的侵袭和转移,在肿瘤演变中起重要作用。本研究显示,膀胱癌组织中的PTFN阳性表达率明显低于正常膀胱组织,且随着肿瘤恶性程度增高和临床进展呈明显降低趋势,提示PTEN基因表达缺失不仅是膀胱癌发生过程中的早期事件,在肿瘤进展过程中也发挥着重要的作用。而PTEN阳性表达对膀胱癌术后复发无明显影响,与Koksal等[4]的报道一致,表明PTEN不适合作为预测膀胱癌复发的独立指标。
p16基因是1993年由Serrano等发现的肿瘤抑制基因,位居染色体9p21,编码一个相对分子量16 000的多肽[5]。p16基因是直接参与细胞周期调控的抑癌基因,p16与细胞周期蛋白D1竞争结合细胞周期素依赖性激酶4(CDK4)和(或)CDK6,特异性抑制细CDK4和CDK6活性,从而抑制增殖,是一种多肿瘤抑制基因[6]。p16是CDK的抑制因子,p16-cyclinD/CDK-PRB通路异常是肿瘤发生的早期事件[7]。本研究显示,膀胱癌组织中的p16阳性表达率明显低于正常膀胱组织。随着肿瘤恶性程度的增高,p16阳性表达率明显下降。
p53是细胞周期中重要的调节因子,通过调节p21的转录活性使细胞周期停留在G1~S期[8],具有调节血管生成、促进凋亡及调节DNA修复的作用,可抑制正常细胞向癌细胞转化[9]。p53基因突变在膀胱癌中很普遍,无论是p53基因突变还是p53蛋白在核内的积聚,都在膀胱癌的进展中起重要作用,且p53蛋白过度表达是膀胱癌高度恶性和预后不良的重要指标之一[10]。本研究显示,随着肿瘤恶性程度的增高,p53阳性表达率明显升高。
本研究进一步对PTEN、p16、突变型p53的相关性进行分析,结果表明,p16基因的表达与PTEN有相关性,随着P16阳性表达率的下降,PTEN阳性表达率也下降,提示二者可能在肿瘤的形成过程中发挥协同作用。
综上所述,p16、PTEN和突变型p53基因表达与膀胱癌的发生发展有密切关系,抑癌基因p16、PTEN失活是膀胱癌发生的早期事件,可作为早期诊断的标记物,随着肿瘤恶性程度的增高,二者表达明显下降,但二者不适合作为预测膀胱癌复发的独立指标;突变型p53蛋白的过度表达是膀胱癌高度恶性的标志之一。
[1]张兆祥,刘宇飞.尿路上皮癌组织学变异的病理特征及诊断[J].临床与实验病理学杂志,2008,24(6):729-34.
[2]Raftopoulou M,Etienne-Manneville S,SeIf A,et al.Regulation of cell migration by the C2 domain Of the tumor suppressor PTEN[J].Science,2004,303(5661):1179-1181.
[3]Tsuruta H,Kishimoto H,Sasaki T,et al.Hyperplasia and carcinomas in Pten-deficient mice and reduced PTEN protein in human bladder cancer patients[J].Cancer Res,2006,66(17):8389-8396.
[4]Koksal T,Yasar D,Dirice E,et al.Differential PTEN protein expression profiles in superficial versus invasme bladder cancers[J].Urol Int,2005,75(2):102-106.
[5]Fischer CA,Kampmann M,Zlobec I.p16 expression in oropharyngeal cancer:its impact on staging and prognosis compared with the conventional clinical staging parameters[J].Ann Oncol,2010,21(10):1961-1966.
[6]Ohtani N,Yamakoshi K,Takahashi A,et al.The p16INK4a-RB pathway:molecular link between cellular senescence and tumor suppression[J].JMed Invest,2004,51(3-4):146-153.
[7]Tsuda H,Yamamoto K,Inoue T,et al.The role of p16-cyclinD/CDK-PRB pathway in the tumorigenesis of endometrioid-type endometrial carcinoma[J].Br JCancer,2000,82(3):675-682.
[8]Mitra AP,Datar RH,Cote RJ.Molecular staging of bladder cancer[J].BJU Int,2005,96(1):7.
[9]Vazquez A,Bond EE,Levine AJ,et al.The genetics of the p53 pathway,apoptosis and cancer therapy[J].Nat Rev Drug Discoc,2008,7(12):979.
[10]Mitra AP,Datar RH,Cote RJ.Molecular pathways in invasive bladder canccr:new insights into mechanisms,progression,and target identification[J].JClin Oncol,2006,24(35):5552.
