sRAGE对缺氧/复氧大鼠心肌细胞线粒体膜电位的影响
2013-06-14宋娟娟郭彩霞曾翔俊王红霞张立克杜凤和
宋娟娟,郭彩霞,曾翔俊,王红霞,张立克,杜凤和
(1首都医科大学附属北京天坛医院,北京100050;2首都医科大学基础医学院)
预防心肌缺血再灌注损伤的方法包括缺血预处置、缺血后处置和内源性保护物质释放等。可溶性糖基化终末产物受体(sRAGE)作为一种内源性物质 ,可减轻心脏[1]、肺[2]、肝脏[3]的缺血再灌注损伤。缺血再灌注损伤的发生机制[4]直接或间接与线粒体结构或功能障碍有关,目前研究较多的是线粒体通透性转换孔(mPTP)和线粒体膜电位。文献报道[5],线粒体可通过调节上述结构诱导细胞凋亡。我们的前期实验[6]已经证实,血浆内源性sRAGE含量在心脏缺血再灌注损伤过程中降低;离体细胞培养[7]显示,外源性sRAGE可直接作用于缺氧/复氧(H/R)心肌细胞,通过抑制氧化应激发挥心脏保护作用。外源性sRAGE是否还通过抑制线粒体凋亡途径来发挥心脏保护作用目前少见报道,2011年1~12月,我们进行了相关研究。现报告如下。
1 材料与方法
1.1 材料 SPF级健康SD大鼠,鼠龄0~48 h,雌雄不分,购于北京维通利华实验动物技术有限公司。DMEM培养基(GIbco公司,美国),20%胎牛血清(杭州四季青生物工程材料公司),JC-1、酯化钙黄绿素、氯化钴(CoCl2,Sigma公司,美国),丝裂霉素 C(Roche公司,美国),Cleaved caspase-3一抗(cell signal techology公司,美国),二抗(Santa Cruz公司,美国);蛋白定量BCA试剂盒(北京普利莱技术公司);倒置荧光显微镜、激光共聚焦显微镜(Leica公司,德国)。
1.2 方法
1.2.1 心肌细胞培养 大鼠开胸,取心脏2/3剪碎,消化酶反复消化,收集上清液,离心,重悬细胞,于5%CO2、37℃条件下差速贴壁30 min,收集细胞悬液加入丝裂霉素C 2 g/mL,根据实验所需将细胞接种到培养瓶或培养板中。24 h后第1次换液,72 h后用于实验。
1.2.2 细胞分组及H/R模型复制 ①对照组:细胞于5%CO2、37℃培养箱中孵育5 h;②对照 +sRAGE组:细胞培养液中加入sRAGE(终浓度900 ng/mL),余处理同对照组;③H/R组:细胞放入低氧培养箱中(2%O2、5%CO2、93%N2)3 h 后,再置于37℃、5%CO2培养箱中继续培养2 h;④H/R+sRAGE组:细胞培养液中加入sRAGE(终浓度900 ng/mL),余处理同H/R组。
1.2.3 JC-1法检测线粒体膜电位 取出各组细胞弃去培养基,加入JC-1溶液(终浓度10μg/mL),于37℃、5%CO2培养箱中避光孵育20 min后,加入1 mL完全培养基,即刻荧光倒置显微镜下观察、照相。图像结果用Image-J软件分析,以绿色荧光强度平均值与红色荧光强度平均值的比值代表心肌细胞线粒体膜电位去极化程度。
1.2.4 Calcein-AM和CoCl2共孵育检测mPTP 取出各组细胞弃去培养基,加入Calcein-AM溶液(终浓度2μmol/L),于37℃、5%CO2培养箱中孵育20 min后加入CoCl2(终浓度4 mmol/L),37℃、5%CO2培养箱中孵育15 min,立即避光激光共聚焦显微镜下观察、照相。镜下随机选择感兴趣图像区域(ROIs),用Photo-Shop软件分析mPTP开放情况。
1.2.5 Western-blot法检测 Cleaved caspase-3 蛋白表达 取出各组细胞弃去培养基,加入1 mL细胞裂解液,收集所有心肌细胞冰上裂解30 min,低温离心,收集上清,BCA法蛋白定量后进行聚丙烯酰胺凝胶电泳,用凝胶成像分析仪测定Cleaved caspase-3蛋白光密度,其与 β-actin的比值作为 Cleaved caspase-3蛋白相对含量来反映细胞凋亡。
1.2.6 统计学方法 采用SPSS16.0统计软件,计量资料以¯x±s表示,组间比较采用单因素方差分析,差异显著时用LSD法进行两两比较。P≤0.05为差异有统计学意义。
2 结果
2.1 线粒体膜电位变化 与对照组比较,H/R组心肌细胞膜电位去极化程度明显增加(P<0.01);而H/R+sRAGE组心肌细胞去极化程度减轻,与H/R组比较有统计学差异(P<0.01)。见图1。
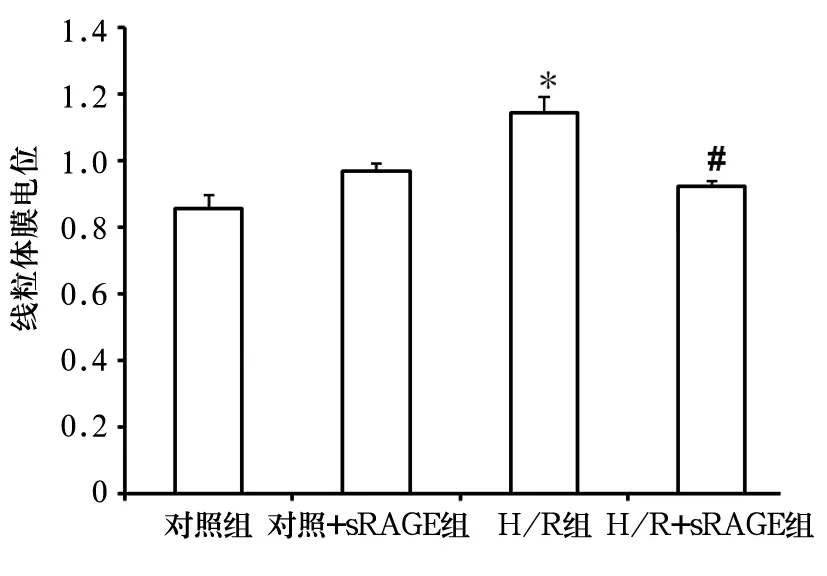
图1 各组线粒体膜电位
2.2 线粒体通透性转换孔开放情况 与对照组比较,H/R组发生明显的mPTP开放,线粒体大量漏出使荧光强度明显减弱(P<0.01),而H/R-sRAGE组线粒体漏出减少,荧光强度较H/R组增强(P<0.01)。见图2。
2.3 Cleaved caspase-3蛋白表达 与对照组比较,Cleaved caspase-3表达量显著增高,心肌细胞凋亡显著增加(P均 <0.01);而 H/R-sRAGE组 Cleaved caspase-3表达量减少,与H/R组比较细胞凋亡减少(P 均 <0.05)。见图3。
3 讨论
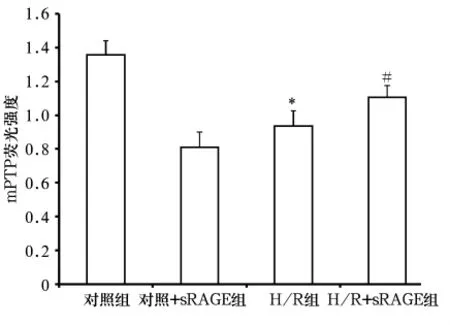
图2 各组mPTP荧光强度
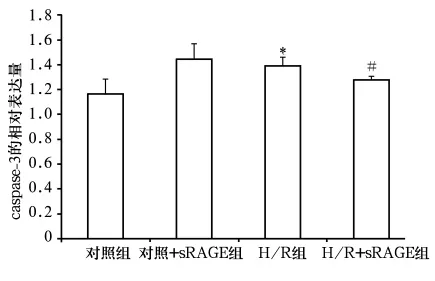
图3 各组Cleaved caspase-3蛋白表达
研究发现,缺血再灌注损伤会调动心脏自身保护机制,内源性保护物质sRAGE的释放成为拮抗心肌缺血再灌注损伤的重要靶点。缺血再灌注损伤的众多机制都与线粒体结构或功能障碍密切相关[4]。缺血再灌注损伤会产生大量自由基,使mPTP开放,进而使线粒体膜电位去极化,由于二者呈正反馈效应,因此膜电位的变化可间接反映mPTP的开放情况。mPTP开放后,位于线粒体膜间隙内的蛋白质及其他重要的凋亡因子被释放出来,引发细胞凋亡[8];同时线粒体内膜使氧化磷酸化解耦联,能量代谢发生障碍。因此mPTP开放是导致缺血再灌注损伤从可逆转变为不可逆的关键因素,是多种缺血再灌注损伤机制的汇合点。研究已证实,缺血预处理和后处理均是通过抑制mPTP开放来实现H/R心肌保护作用[9]。
mPTP是由多种蛋白质组成的复合体,在生理条件下基本处于关闭状态。某些应激条件下(如Ca2+增加、活性氧、线粒体跨膜电位下降、能量衰竭等)可引发其开放。研究发现,mPTP开放发生在再次供氧后,再灌注15 min内进行药物干预有保护作用[10]。Gateau-Roesch 等[11]也证实,在心脏再灌注起始给予药物或基因治疗可以使心肌梗死面积减少30%~50%。我们前期的细胞实验结果显示,sRAGE拮抗心肌细胞H/R损伤的最佳浓度为900 ng/mL。在此基础上,本实验在再灌注起始就给予900 ng/mL sRAGE处理,结果显示,与对照组比较,H/R组心肌细胞mPTP明显开放,线粒体膜电位明显下降;而H/R+sRAGE组较H/R组mPTP开放明显较少,线粒体膜去极化程度明显减轻。提示外源性sRAGE可发挥心脏保护作用,其拮抗H/R损伤的作用是通过抑制mPTP开放来实现的。
研究证实,mPTP开放会启动线粒体凋亡途径,包括依赖caspases活性和非依赖caspases活性两种途径。再灌注后,mPTP开放使线粒体膜内外电势差减少,膜电位下降,进而激活caspases家族引发细胞凋亡的级联反应,启动细胞凋亡程序[5]。caspase-3是细胞凋亡蛋白酶级联反应的必经之路,也是细胞凋亡的主要效应因子和最重要的凋亡执行者,其活化形式为Cleaved caspase-3,故Cleaved caspase-3可作为反映细胞凋亡的指标。本研究结果显示,与H/R组比较,H/R+sRAGE组Cleaved caspase-3表达明显减少,说明 sEAGE可通过抑制 Cleaved caspase-3表达来减少心肌细胞凋亡,同时也间接支持上述sRAGE通过减少mPTP开放拮抗心肌H/R损伤的结论。
综上所述,外源性sRAGE可以通过调节线粒体凋亡途径来发挥心脏保护作用,其拮抗H/R损伤的作用可能通过减少 mPTP开放、抑制 Cleaved caspase-3表达、减少心肌细胞凋亡来实现。但sRAGE发挥心脏保护作用是否还通过线粒体非caspase-3途径,以及与线粒体介导相关信号转导通路有无关联尚不明确,值得进一步探讨。
[1]Aleshin A.RAGE modulates myocardial injury consequent to LAD infarction via impact on JNK and STAT signaling in a murine model[J].Am J Physiol Heart Circ Physiol,2008,294(4):H1823-1832.
[2]Sternberg D.Blockade of receptor for advanced glycation end product attenuates pulmonary reperfusion injury in mice[J].Thorac Cardiovasc Surg,2008,136(6):1576-1585.
[3] Zeng S.Blockade of receptor for advanced glycation end product(RAGE)attenuates ischemia and reperfusion injury to the liver in mice[J].Hepatology,2004,39(2):422-432.
[4]宝鲁尔.心肌缺血再灌注损伤发生机制研究进展[J].内蒙古民族大学学报,2009,15(2):126-127.
[5]Halestrap AP.What is the mitochondrial permeability transition pore[J].Journal of Molecular and Cellular Cardiology,2009,46(6):821-831.
[6]董洪武,郭彩霞,杜凤和,等.缺血再灌注损伤对大鼠心肌内源性可溶性糖基化终末产物受体分泌的影响[J].首都医科大学学报,2011,32(5):640-644.
[7]张敏,郭彩霞,杜凤和,等.sRAGE对缺氧/复氧心肌细胞氧化应激的影响[J].首都医科大学学报,2012,33(4):488-493.
[8]Nishihara M,Miura T,Miki T,et al.Modulation of the mitochondrial permeability transition pore complex inGSK-3β-mediated myocardial protection[J].J Mol Cell Cardiol,2007,43(5):564-570.
[9]Lim SY,Davidson SM,Hausenloy DJ,et al.Preconditioning and postcondflioning:the essential role of the mitochondrial permeability transition pore[J].Cardiovasc Res,2007,75(3):530-535.
[10]Yellon DM,Hausenloy DJ.Myocardial reperfusion injury[J].N Engl JMed,2007,357(11):1121-1135.
[11]Gateau-Roesch O,Argaud L,Ovize M.Mitochondrial permeability transition pore and postconditioning[J].Cardiovasc Res,2006,60(2):264-273.
