间断性缺氧对小鼠海马tau蛋白异常过度磷酸化的影响
2013-06-14徐江涛
刘 静,杨 遥,徐江涛
(1石河子大学医学院,新疆石河子832000;2兰州军区乌鲁木齐总医院)
睡眠呼吸暂停综合征(SAS)患者常伴有认知功能损害,且与痴呆共病率较高[1]。SAS的病理生理改变主要是慢性间断性低氧—复氧过程。研究发现,持续低灌注和缺血再灌注都会使大鼠脑中tau蛋白过度磷酸化[2,3],而间断性缺氧(IH)对 tau 蛋白磷酸化的影响仍不清楚。2011年7月~2012年9月,我们观察了小鼠IH后不同时间点海马磷酸化tau蛋白(P-tau)水平,探讨IH对tau蛋白磷酸化水平的影响。
1 材料与方法
1.1 材料 SPF级健康雄性成年昆明小鼠30只,体质量19~23 g。随机分为6组各5只,分别为IH后1、6、12、24、48 h 组及对照组。多克隆兔抗鼠 P-tau抗体Ser199(1∶200,特异性识别Ser199位点P-tau)、tau蛋白抗体[1∶100,检测总 tau蛋白(T-tau)]购自北京博奥森生物工程有限公司。
1.2 方法
1.2.1 模型制备 IH组按文献[4]方法处理,IH实验箱密闭时,小鼠呼吸箱内有限的氧气造成低氧,然后开启实验箱,空气迅速进入箱内形成复氧,如此关闭120 s、开启 30 s,循环 8 h(10:00 ~18:00)。IH处理期间箱内最高氧浓度20%,最低10%。对照组置于IH实验箱内保持空气自由流动,持续8 h(10:00~18:00),氧浓度保持在20%左右。
1.2.2 标本采集与处理 大鼠断头处死,迅速取出脑组织,0~4℃生理盐水洗净,10%甲醛固定,梯度乙醇脱水,二甲苯透明,制成石蜡切片,行HE和P-tau、T-tau免疫组化染色,按说明书操作,苏木素复染,中性树胶封片。
1.2.3 海马区P-tau、T-tau表达检测 每组取3张切片,400倍显微镜下于海马区随机选取5个视野,以胞质呈棕黄色染色为阳性,采用Image-Pro Plus 6.0图像分析系统对各组阳性细胞进行平均光密度OD值检测。
1.2.4 统计学方法 采用SPSS17.0统计软件,计量资料用¯x±s表示,组间比较采用单因素方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 组织病理学改变 HE染色见对照组海马区细胞形态及分布正常。IH后可见细胞间隙增宽,细胞数目减少,随着时间延长,部分细胞出现形态学改变,胞核固缩、浓染(见图1)。
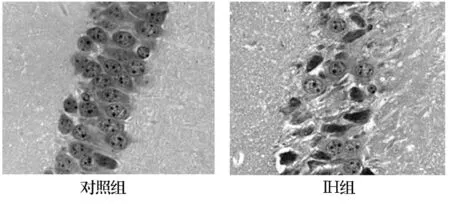
图1 IH组与对照组的神经元形态比较(×400)
2.2 P-tau、T-tau免疫组化染色结果 P-tau阳性神经元呈棕黄色,主要在胞质和轴突处着色,胞核周围也染成棕黄色(见图2)。IH 后6、12、24、48 h组的P-tau表达均高于对照组和IH 1 h组;IH 24 h组表达最明显。IH后P-tau平均OD值在间断性缺氧后6 h开始增加,24 h达高峰,到48 h仍高于对照组水平(见表1)。T-tau阳性神经元的胞质和突起呈棕黄色(见图3)。各组间T-tau的平均OD值差异无统计学意义(见表1)。
3 讨论
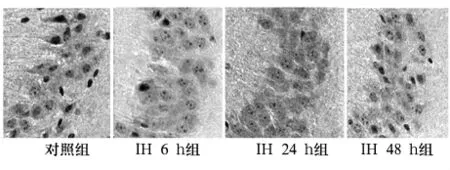
图2 IH 6、24、48 h组与对照组的海马P-tau表达比较(×400)
表1 各组海马区P-tau、T-tau表达的平均OD值±s)

表1 各组海马区P-tau、T-tau表达的平均OD值±s)
注:与对照组比较,*P <0.05,**P <0.01;与 IH 24 h 组比较,△P <0.05,△△P <0.01
组别 n P-tau T-tau对照组 5 0.104 ±0.008△△0.155 ±0.014 0.161 ±0.008 IH 1 h组 5 0.110 ±0.012△△ 0.159 ±0.013 IH 6 h组 5 0.125 ±0.015*△△ 0.153 ±0.016 IH 12 h组 5 0.137 ±0.013**△ 0.158 ±0.015 IH 24 h组 5 0.159 ±0.021** 0.162 ±0.016 IH 48 h 组 5 0.128 ±0.020*△△
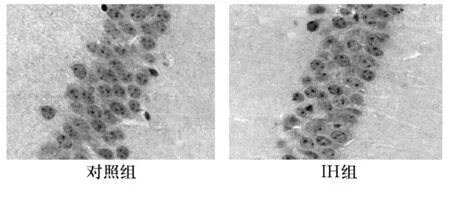
图3 HI组与对照组的海马T-tau表达比较(×400)
SAS患者常伴有认知功能障碍,而一些阿尔茨海默病(AD)患者也合并有SAS,因此推测SAS与AD可能存在某种联系。一项对38例AD患者的临床观察表明,患者SAS的患病率极高,经多导睡眠图监测证实的SAS者达89.5%,其中睡眠呼吸暂停—低通气指数>20的严重病例占50.0%,这些患者的血氧饱和度下降较严重[5]。Cooke等[1]对 66例轻中度AD患者研究发现,AD患者一般合并SAS,通过治疗SAS可以改善其白天执行能力,进而改善认知功能,推断SAS与认知功能有关。Hrubos-Strom等[6]对29 258例成人进行问卷调查,发现平均血氧饱和度可评价SAS的严重程度,且与受访者的认知功能具有很强的相关性,提示SAS的认知功能损害与其反复发作的低氧血症相关。SAS患者夜间睡眠呼吸暂停、低通气期间,血与组织氧饱和度下降,脑血流动力学异常及其生化代谢紊乱,导致脑组织缺氧损伤[7],神经系统特别是海马区域对缺氧敏感,长时间缺氧损害易导致认知障碍。以上均提示SAS患者的认知功能障碍与夜间的IH密切相关。
与tau蛋白自身异常和功能障碍相关的一系列散发性或遗传性的神经退行性疾病称为tau病[8],如AD、Pick病、皮层基底节变性、进行性核上性麻痹等。tau蛋白异常磷酸化修饰在AD及其他tau病的发病机制中起重要作用。P-tau蛋白丧失了催化微管装配和稳定微管结构的正常生物活性,不仅与正常微管相关蛋白互相竞争,影响微管形成,而且促使正常微管相关蛋白与微管分离,使微管崩解,轴突变性,影响神经递质的合成、运输、释放和摄取,造成神经细胞间的物质运输障碍,从而导致神经退行性变[9,10]。持续低灌注和缺血再灌注都会使大鼠脑中tau蛋白过度磷酸化。Du等[2]发现,大鼠持续低灌注引发海马tau蛋白过度磷酸化,并使其在神经元中的聚集逐渐增多,造成认知功能障碍进行性加重。本研究对小鼠进行IH处理,根据小鼠昼伏夜出的习性,实验在日间10:00~18:00进行。结果显示,IH后8 h小鼠海马tau蛋白过度磷酸化。说明缺血缺氧是tau蛋白磷酸化的影响因素之一;而IH各时间组及对照组的T-tau比较无统计学差异,提示IH可能不会影响细胞内的T-tau,IH引起tau蛋白磷酸化水平绝对升高,与T-tau无关。
tau蛋白磷酸化状态取决于其蛋白激酶和蛋白磷酸酶的相对活性。GSK-3β是最强有力的tau蛋白激酶,可以使tau蛋白Ser199在内的多个位点磷酸化,tau蛋白磷酸化水平会随着GSK-3β的过度表达而增加[11]。有学者推测,脑缺血再灌注引起的tau蛋白过度磷酸化可能与GSK-3β有关[3]。至于IH后tau蛋白磷酸化水平增高是否与GSK-3β相关,则需进一步实验证实。
[1]Cooke JR,Liu L,Natarajan L.The effect of sleep-disordered breathing on stages of sleep in patients with Alzheimer's disease[J].Behav Sleep Med,2006,4(4):219-227.
[2]Du AT,Jahng GH,Hayasaka S,et al.Hypoperfusion in frontotemporal dementia and Alzheimer disease by arterial spin labeling MRI[J].Neurology,2006,67(7):1215-1220.
[3]Wang H,Zhao H,Ye Y,et al.Focal cerebral ischemia induces Alzheimer's disease-like pathological change in rats[J].J Huazhong Univ Sci Technolog Med Sci,2010,30(1):29-36.
[4]刘海林,张子彦,郭云云,等.慢性间断性缺氧伴二氧化碳潴留小鼠模型的建立[J].中国比较医学杂志,2012,22(1):65-68.
[5] Gehrman PR,Martin JL,Shochat T,et al.Sleep-disordered breathing and agitation in institutionalized adults with Alzheimer disease[J].Am J Geriatr Psychiatry,2003,11(4):426-433.
[6]Hrubos-Strom H,Nordhus IH,Einvik G,et al.Obstructive sleep apnea,verbal memory,and executive function in a communitybased high-risk population identified by the Berlin Questionnaire Akershus Sleep Apnea Project[J].Sleep Breath,2012,16(1):223-231.
[7]Schulz R,Seeger W,Fegbeutel C,et al.Changes in extracranial arteries in obstructive sleep apnoea[J].Eur Respir J,2005,25(1):69-74.
[8] Wang XF,Dong CF,Zhang J,et al.Human tau protein forms complex with PrP and some GSS-and fCJD-related PrP mutants possess stronger binding activities with tau in vitro[J].Mol Cell Biochem,2008,310(1-2):49-55.
[9]Amniai L,Barbier P,Sillen A,et al.Alzheimer disease specific phosphoepitopes of Tau interfere with assembly of tubulin but not binding to microtubules[J].FASEB J,2009,23(4):1146-1152.
[10] Avila J.Tau kinases and phosphatases[J].J Cell Mol Med,2008,12(1):258-259.
[11]Cuchillo-Ibanez I,Seereeram A,Byers HL,et al.Phosphorylation of tau regulates its axonal transport by controlling its binding to kinesin[J].FASEB J,2008,22(9):3186-3195.
