丹参酮ⅡA对胃癌细胞迁移和侵袭能力的抑制作用及机制
2013-06-09
河北医科大学第四医院普外科,河北 石家庄 050011
丹参酮ⅡA对胃癌细胞迁移和侵袭能力的抑制作用及机制
赵雪峰 贾楠 李勇 范立侨 王冬
河北医科大学第四医院普外科,河北 石家庄 050011
背景与目的:有研究证实,丹参酮ⅡA (tanshinone ⅡA)对肿瘤细胞具有抑制增殖、诱导分化和促凋亡的作用,并可抑制骨肉瘤细胞迁移和侵袭。但丹参酮ⅡA抑制胃癌侵袭和转移的机制尚不明确。本研究主要探讨丹参酮ⅡA对人胃癌SGC7901细胞体外迁移和侵袭的影响。方法:不同浓度(0.5、1、2、4 μg/mL)丹参酮ⅡA分别作用体外培养的胃癌SGC7901细胞24、48、72 h后,MTT比色法检测细胞增殖活力的改变;细胞划痕实验观察细胞的迁移能力的改变;3D侵袭实验观察细胞侵袭能力的改变;Real-time PCR和蛋白质印迹法(Western blot)分别检测细胞间黏附分子1(ICAM-1)、基质金属蛋白酶-2(MMP-2)、基质金属蛋白酶-9(MMP-9)、金属蛋白酶抑制剂-2(TIMP-2)mRNA和蛋白的表达水平改变。结果:1、2、4 μg/mL丹参酮ⅡA对胃癌细胞株SGC7901有明显的抑制作用,且抑制作用存在时间-剂量依赖性(P<0.05);2 μg/mL丹参酮ⅡA呈时间依赖性抑制SGC7901细胞迁移;1、2、4 μg/mL丹参酮ⅡA呈浓度依赖性抑制SGC7901细胞侵袭;丹参酮ⅡA下调SGC7901细胞ICAM-1、MMP-2、MMP-9表达,同时可上调TIMP-2表达(P<0.05)。结论:丹参酮ⅡA可抑制胃癌SGC7901细胞的迁移和侵袭,上调TIMP-2的表达,下调ICAM-1、MMP-2、MMP-9的表达,可能是其作用机制之一。
丹参酮ⅡA;胃癌;迁移;侵袭
[Key words]Tanshinone ⅡA; Gastric cancer; Migration; Invasion
胃癌是全球范围内最常见的恶性肿瘤之一,在中国和亚洲其他国家发病率较高[1-2]。胃癌的治疗仍以手术和化疗为主[3]。术后复发及远处转移是导致患者死亡的主要原因,而复发及转移的主要原因在于胃癌细胞有很强的侵袭迁移能力。因此,抑制胃癌侵袭转移成为胃癌治疗的重要环节。丹参酮是从丹参中提取的化合物,其中丹参酮ⅡA是脂溶性成分的代表。近年丹参酮ⅡA的抗肿瘤活性受到高度重视。研究发现,丹参酮ⅡA抑制胃癌细胞生长,诱导癌细胞分化[4-5]。另有研究显示,丹参酮ⅡA可抑制骨肉瘤细胞迁移和侵袭[6]。本研究旨在体外观察丹参酮ⅡA对人胃癌SGC7901细胞侵袭转移的影响,并对其分子机制进行探讨。
1 材料和方法
1.1 药物及试剂
SGC-7901细胞为人胃癌细胞株,购自中国科学研究院上海细胞研究所。胎牛血清、RPMI 1640细胞培养基、胰蛋白酶,购自美国GIBCO公司;四甲基偶氮唑蓝(MTT)和丹参酮ⅡA(TanⅡA)(纯度>99%)购自Sigma公司;3D侵袭小室购自美国Costar公司;ICAM-1、MMP-2、MMP-9、TIMP-2抗体购自Santa Cruz公司;TRIzol试剂为美国invitrogen公司产品;逆转录试剂盒为Promega公司产品;Real-time PCR试剂盒为Fermentas公司产品;引物由上海生工生物技术公司合成。Real-Time PCR仪为美国ABI公司产品;电泳和转膜系统为Bio-Rad公司产品;PVDF膜为Millipore公司产品。
1.2 细胞培养
SGC-7901细胞在含有10%胎牛血清、100 kU/L青霉素和100 mg/L链霉素的RPMI-1640培养基中培养,在37 ℃、CO2体积分数为5%的条件下恒温温育。每3天用含0.02% EDTA的0.25%胰蛋白酶溶液消化以1∶3的比例传代。
1.3 MTT法检测
SGC7901细胞以5×103个/mL密度接种于96孔板,于37 ℃、CO2体积分数为5%的条件下培养24 h后,用不同浓度的丹参酮ⅡA (0.5、1、2、4 μg/mL)分别处理细胞24、48、72 h,对照组加入0.1% DMSO。每组设置6个复孔。各实验组于实验结束前4 h加入20 μL的MTT(浓度为5 mg/mL),培养4 h后,弃去培养液,加入150 μL DMSO室温振荡15 min溶解结晶,用酶标仪于波长490 nm测吸光度值(A值),以A值表示SGC7901细胞增殖能力。实验重复3次。
1.4 细胞划痕实验
消化后,胃癌SGC7901细胞悬液以4×105个/mL密度接种于6孔板,100%汇合后,吸尽培养液,加入PBS液洗涤1次,沿孔板底部划一直线,用PBS洗去刮下的SGC7901细胞,将含2 μg/mL丹参酮ⅡA的培养基加入6孔板,对照组加入等量0.1% DMSO的培养基,培养24、48、72 h后,显微镜下任意取6个视野,计数越过划痕的细胞数,以细胞数代表肿瘤细胞的迁移能力。实验重复3次。
1.5 3D侵袭实验
用100 μL Matrigel胶覆盖3D侵袭小室上室,在超净台中用紫外线照射2 h,使Matrigel胶充分聚合。用0.25%胰蛋白酶消化,丹参酮ⅡA(1、2、4 μg/mL)作用16 h,对照组加入等量0.1% DMSO的培养基,调整浓度至4×105个/mL,每组分别吸200 μL接种于上室,小室置于24孔板内,下室加含10%小牛血清的RPMI-1640培养24 h。取出小室,棉签擦掉上室的Matrigel胶和细胞,甲醇固定膜10 min,结晶紫染色,高倍镜下随机计数6个视野中的细胞数,以细胞数代表肿瘤细胞的侵袭能力。实验重复3次。
1.6 总RNA提取及Real-time PCR
SGC7901细胞以5×103个/mL密度接种于6孔板,于37 ℃、CO2体积分数为5%的条件下培养24 h,用1、2、4 μg/mL丹参酮ⅡA作用48 h,溶剂对照加入0.1%DMSO。收集各组细胞,用TRIzol试剂提取各组细胞总RNA,用紫外分光光度仪测定RNA浓度及纯度,并经电泳鉴定后进行逆转录,以cDNA为模板进行Real-time PCR 反应。以GAPDH为内参照。ICAM-1上游引物:5’-GGCTGGAGCTGTTTGAGAAC-3’,下游引物:5’-ACTGTGGGG TTCAACCTCTG-3’;MMP-2上游引物:5’-CCGTGGTGAGATCTTCTTCT-3’,下游引物:5’- CCTCGTATACCGCATCAATCT-3’;MMP-9上游引物:5’-CTGGCACCACC ACAACATCAC-3’,下游引物:5’-TACACGCGAGTGAAGGTGAGC-3’;TIMP-2上游引物:5’-TATCTACACG GCCCCCTCCT-3’,下游引物:5’-CCTCGGCCTTTCCTGCAAT-3’;GAPDH上游引物5’-CGGGAAATCGTGCGTGAC-3’,下游引物5’-GAAGGAAGGCTGGAAGAGTG-3’。根据实时荧光定量扩增曲线获取目的基因和内参基因的Ct值,以目的基因ICAM-1、MMP-2、MMP-9、TIMP-2表达的相对定量值(RQ值)进行统计学分析。
1.7 蛋白质印迹法(Western blot)检测
SGC7901细胞以5×103个/mL密度接种于6孔板,于37 ℃、CO2体积分数为5%的条件下培养24 h,1、2、4 μg/mL丹参酮ⅡA作用48 h,溶剂对照加入0.1%DMSO。收集各组细胞,用裂解缓冲液(50 mmol/L Tris pH=7.2,1% Triton X-100,0.5%草酸钠,0.1%十二烷基硫酸钠,500 mmol/L NaCl,10 nmol/L MgCl2,10 mg/mL亮抑肽酶,10 mg/mL抑肽酶和1 mmol/L PMSF)裂解整个细胞,细胞总蛋白经10% SDS-PAGE分离后转到PVDF膜上。PVDF膜在5%脱脂奶粉室温封闭1 h,细胞间黏附分子-1(ICAM-1)、基质金属蛋白酶-2(MMP-2)、MMP-9、组织金属蛋白酶抑制剂-2(TIMP-2)各目标分子特异性一抗4 ℃过夜,接着,用辣根过氧化酶标记的相应的二抗室温温育2 h。ECL法检测结合的目的条带。以GAPDH作为内参照,用目的蛋白ICAM-1、MMP-2、MMP-9、TIMP-2的吸光度(A)值/内参照A值的比值进行统计比较。
1.8 统计学处理
计数数据以x±s 表示,采用SPSS 13.0软件进行ANOVA分析处理和Dunnett检验。P<0.05为差异有统计学意义。
2 结 果
2.1 丹参酮ⅡA抑制SGC7901细胞增殖
MTT结果显示,与对照组相比,1、2、4 μg/mL丹参酮ⅡA对胃癌细胞以浓度和时间依赖的方式抑制细胞生长(P<0.05,表1)。
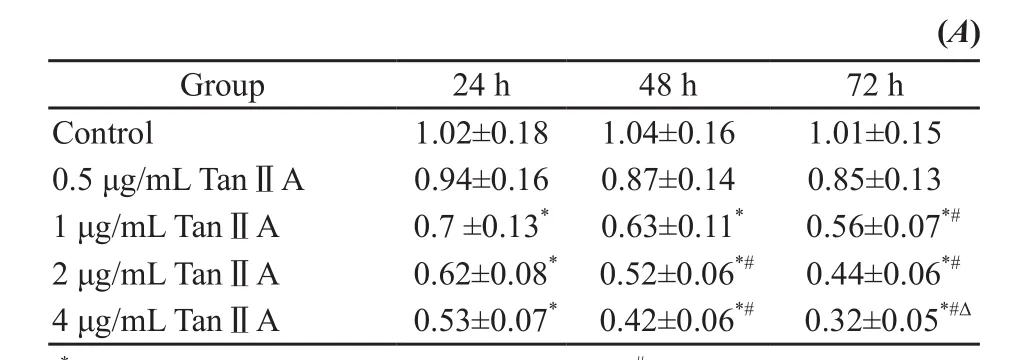
表 1 丹参酮ⅡA对SGC7901细胞增殖的影响(x±s)Tab. 1 Effects of Tan ⅡA on the proliferation of SGC7901 cell lines (x±s)
2.2 丹参酮ⅡA抑制SGC7901细胞迁移
划痕实验结果显示,与对照组相比,2 μg/mL丹参酮ⅡA组随着作用时间的延长,细胞迁移能力逐渐下降,呈明显的效应-时间依赖关系(P<0.05,表2,图1)。

表 2 丹参酮ⅡA对SGC7901细胞迁移的影响(x±s)Tab. 2 Effects of Tan ⅡA on the migration of 7901 cell lines (x±s)
2.3 丹参酮ⅡA抑制SGC7901细胞侵袭
Transwell小室侵袭实验结果显示,与对照组相比,1、2、4 μg/mL丹参酮ⅡA组细胞侵袭能力逐渐下降,呈明显的效应-浓度依赖关系(P<0.05,表3)。

图 1 丹参酮ⅡA对SGC7901细胞迁移的影响Fig. 1 Effects of Tan ⅡA on the migration of SGC7901 cell lines

表 3 丹参酮ⅡA对SGC7901细胞侵袭的影响(x±s)Tab. 3 Effects of Tan ⅡA on the invasion of SGC7901 cell lines (x±s)
2.4 丹参酮ⅡA对SGC7901细胞迁移和侵袭相关分子表达的影响
Real-time PCR和Western blot分析结果显示,与对照组相比,2、4 μg/mL丹参酮ⅡA组细胞内ICAM-1、MMP-2、MMP-9 mRNA和蛋白表达下调(P<0.05),TIMP-2 mRNA和蛋白表达上调(P<0.05);1 μg/mL丹参酮ⅡA组细胞内ICAM-1 mRNA和ICAM-1、MMP-2蛋白表达下调(P<0.05),TIMP-2 mRNA表达上调(P<0.05,表4、5,图2)。

图 2 丹参酮ⅡA对SGC7901细胞ICAM-1、MMP-2、MMP-9、TIMP-2蛋白的影响Fig. 2 Effects of Tan ⅡA on the protein level of SGC7901 cell lines

表 4 丹参酮ⅡA对SGC7901细胞ICAM-1、MMP-2、MMP-9和TIMP-2 mRNA的影响(x±s)Tab. 4 Effects of TanⅡA on the ICAM-1, MMP-2, MMP-9 and TIMP-2 mRNA level of SGC7901 cells(x±s)

表 5 丹参酮ⅡA对SGC7901细胞ICAM-1、MMP-2、MMP-9和TIMP-2蛋白的影响(x±s)Tab. 5 Effects of TanⅡA on the protein levels ICAM-1, MMP-2, MMP-9 and TIMP-2 in SGC7901 cell lines(x±s)
3 讨 论
肿瘤转移是恶性肿瘤恶化的结果,而迁移和侵袭能力的增强则是发生转移的基础。丹参酮ⅡA具有广泛的生理作用,如抗炎和抗氧化作用等[7],其中对心脑血管病的研究取得了显著的成绩,受到国内外学者的高度关注。近年来有研究表明,丹参酮ⅡA可抑制骨肉瘤和肝癌细胞的迁移和侵袭[6,8],而丹参和赤芍则能促进大鼠移植瘤模型肝转移的发生[9]。由于肿瘤细胞的特点各异,药物作用的机制差别很大。因此,本研究观察了丹参酮ⅡA对胃癌侵袭转移的作用和可能的机制,以深化对丹参酮ⅡA抗肿瘤作用的认识。
肿瘤的侵袭转移是一个复杂过程,主要包括细胞黏附、蛋白降解和移动3个步骤,其中,黏附是肿瘤发生转移的始动因素,而ICAM-1具有介导细胞间、细胞与胞外基质间黏附的功能。本研究结果发现,对照组细胞ICAM-1表达水平较高;而丹参酮ⅡA作用后,ICAM-1表达明显下调。肿瘤转移、侵袭与多种转移相关蛋白降解和破坏细胞外基质有关,基质金属蛋白酶(MMPs)家族成员多是降解和破坏细胞外基质的主要蛋白水解酶类,其中以MMP-2和MMP-9与胃癌的生长、浸润及转移关系最密切[10]。本研究发现,以丹参酮ⅡA作用胃癌SGC7901细胞后,细胞内MMP-2和MMP-9 mRNA和蛋白表达逐渐下调。金属蛋白酶抑制剂(TIMPs)是MMPs的抑制剂,可通过与MMPs非共价结合抑制其对基底膜的降解。本研究显示,丹参酮ⅡA作用与SGC7901细胞后,可上调TIMP-2 mRNA和蛋白表达,提示丹参酮ⅡA可通过不同途径抑制胃癌细胞侵袭和转移。
综上所述,丹参酮ⅡA可上调TIMP-2的表达、下调ICAM-1、MMP-2、MMP-9的表达,且具有抑制胃癌SGC7901细胞的侵袭和转移的作用。然而,更深层次分子机制及信号途径等尚未明确,随着研究的不断深入,丹参酮ⅡA作为临床潜在的抗肿瘤药物,其抗肿瘤机制会得到更多的实验依据。
[1] JEMAL A, SIEGEL R, WARD E, et al. Cancer statistics [J]. CA Cancer J Clin, 2009, 59(4): 225-249.
[2] LEUNG W K, WU M S, KAKUGAWA Y, et al. Screening for gastric cancer in Asia: current evidence and practice [J]. Lancet Oncol, 2008, 9 (3): 279-287.
[3] WAGNER A D, GROTHE W, HAERTING J, et al. Chemotherapy in advanced gastric cancer: a systematic review and meta-analysis based on aggregate data [J]. J Clin Oncol, 2006, 24(18): 2903-2909.
[4] CHEN J, SHI D Y, LIU S L, et al. Tanshinone IIA induces growth inhibition and apoptosis in gastric cancer in vitro and in vivo [J]. Oncol Rep, 2012, 27(2): 523-528.
[5] 郭庆寅, 伍学强, 刘玉峰. 丹参酮ⅡA诱导NB4细胞分化与PML-RARα融合蛋白的关系 [J]. 中国癌症杂志, 2012, 22(1): 15-20.
[6] ZHANG Y, WEI R X, ZHU X B, et al. Tanshinone IIA induces apoptosis and inhibits the proliferation, migration, and invasion of the osteosarcoma MG-63 cell line in vitro [J]. Anticancer Drugs, 2012, 23(2): 212-219.
[7] YIN X, YIN Y, CAO F L, et al. Tanshinone IIA attenuates the inflammatory response and apoptosis after traumatic injury of the spinal cord in adult rats [J]. PLoS One, 2012, 7(6): e38381.
[8] YUXIAN X, FENG T, REN L, et al. Tanshinone II-A inhibits invasion and metastasis of human hepatocellular carcinoma cells in vitro and in vivo [J]. Tumori, 2009, 95(6): 789-795.
[9] 丁罡, 宋明志, 于尔辛. 丹参、赤芍对大鼠Walker 256 癌肝转移影响机制的研究[J]. 中国癌症杂志, 2001, 11(4): 364-366.
[10] PATEL S, SUMITRA G, KONER B C, et al. Role of serum matrix metalloproteinase-2 and -9 to predict breast cancer progression [J]. Clin Biochem, 2011, 44 (10-11): 869-872.
Tanshinone ⅡA inhibites migration and invasion of human gastric cancer SGC7901 cells
ZHAO Xue-feng, JIA Nan, LI Yong, FAN Li-qiao, WANG Dong (Department of General Surgery, the Fourth Affiliated Hospital, Hebei Medical University, Shijiazhuang Hebei 050051, China)
LI Yong E-mail: li_yong_hbth@126.com
Background and purpose: Recently, it was reported that tanshinone ⅡA (TanⅡA) could inhibit proliferation, induce differentiation and apoptosis of human cancer cells. Previous studies also indicated that TanⅡA could inhibit the migration and invasion of osteosarcoma. However, the effects of TanⅡA on the migration and invasion of gastric cancer and the mechanism remains unclear. The aim of this study was to investigate the effect of TanⅡA on gastric cancer cell SGC7901 migration and invasion of in vitro. Methods: After different concentrations (0.5, 1, 2, and 4 μg/mL) of TanⅡA treatment for 24, 48, and 72 h respectively, MTT assay were developed to detect the cell proliferation of SGC7901. The wound healing assay and 3D-transwell assay were used to observe the migration and invasion of SGC7901 cells, respectively. Expression of intercellular adhesion molecule 1 (ICAM-1), matrix metalloproteinase-2 (MMP-2), matrix metalloproteinase-9 (MMP-9), and tissue inhibitor of metalloproteinase 2 (TIMP-2) mRNA and protein were measured with real-time PCR and Western blot. Results: 1, 2, and 4 μg/mL Tan ⅡA showed a dose- and time- dependent growth inhibition on SGC7901 cells. 2 μg/mL Tan ⅡA showed a time-dependent migration inhibition of SGC7901 cells. 1, 2, and 4 μg/mL Tan ⅡA could inhibit the invasion of SGC7901 cells. Realtime PCR and Western blot showed a reduction in expression of ICAM-1, MMP-2, and MMP-9, as well as an increase in expression of TIMP-2 (P<0.05).Conclusion: TanⅡA inhibits human gastric cancer SGC7901 cell migration and invasion in vitro. TIMP-2 upregulation and, ICAM-1, MMP-2, MMP-9 downregulation might be one of the mechanisms of anti-tumor of TanⅡA.
10.3969/j.issn.1007-3969.2013.10.003
R735.2
:A
:1007-3639(2013)10-0793-05
2013-03-04
2013-09-16)
河北省卫生厅医学科学研究课题(No:20130238)。
李勇 E-mail:li_yong_hbth@126.com
