Gd-DOTA-hTERT ASON 磁共振肿瘤端粒酶靶向显像实验研究
2013-06-09朱高红任炳秀卫江亮苏玉林何蕊张威蔡静宋彬
朱高红任炳秀卫江亮苏玉林何蕊张威蔡静宋彬
1.昆明医科大学第一附属医院核医学科,云南 昆明,650032;
2.四川大学华西医院放射科,四川 成都,610041;
3.四川省肿瘤医院放射科,四川 成都,610043
Gd-DOTA-hTERT ASON 磁共振肿瘤端粒酶靶向显像实验研究
朱高红1任炳秀1卫江亮1苏玉林1何蕊1张威3蔡静1宋彬2
1.昆明医科大学第一附属医院核医学科,云南 昆明,650032;
2.四川大学华西医院放射科,四川 成都,610041;
3.四川省肿瘤医院放射科,四川 成都,610043
背景与目的:研究表明,约有超过85%的恶性肿瘤高表达端粒酶活性。因此,端粒酶已成为肿瘤诊断和治疗研究领域的热点之一。目前,以放射性核素标记人端粒酶逆转录酶反义寡核苷酸(human telomerase reverse transcriptase antisense oligonucleotide,hTERT ASON)对高表达hTERT的恶性肿瘤进行靶向显像在国内外也有相关报道,但核医学图像在解剖和空间分辨率上存在着不足,难以获得高质量的图像。因此,本研究拟以磁共振成像方法对活体内肿瘤端粒酶的进行检测,并对其进行可行性评价。方法:以DOTA(1,4,7,10-Tetraazacyclododecane-N,N',N'',N'''-tetraacetic acid)为螯合剂对全链硫代修饰的hTERT ASON(3’末端连接一个伯氨)进行Gd3+标记制备反义探针并进行体外实验,以99mTc标记的DOTA-hTERT ASON生物分布实验;建立人黑色素瘤A375裸鼠模型,分别于腹腔注射前及注射后0.5、1、2、4、6、24 h在7.0T Magnetic Resonance Imaging(MRI)下行T1WI显像,以肿瘤及其周围正常组织作为感兴趣区(region of interest,ROI)计算信噪比(signal to noise ratio,SNR)并与Gd-DTPA进行比较;显像后48 h处死小鼠,以免疫组织化学方法检测肿瘤组织端粒酶活性。结果:Gd-DOTA-hTERT ASON的标记率约为65%,在37 ℃新鲜人血清中温育24 h后,探针的降解率低于3%;A375细胞对探针的摄取约为8.5%,Gd-DOTA-hTERT ASON转染的A375细胞信号强度明显高于Gd-DTPA和DOTA-hTERT ASON组;肿瘤在注射反义探针和Gd-DTPA均表现为明显强化,反义探针组SNR最高可达2.37,最大强化时间为注射后2~6 h,且可被DOTA-hTERT ASON所抑制(P<0.05),而Gd-DTPA组强化时间为注射后2 h;Gd-DOTA-hTERT ASON可抑制肿瘤端粒酶活性。结论:Gd-DOTA-hTERT ASON显示了良好的肿瘤靶向性,对端粒酶阳性表达的肿瘤具有潜在的定性诊断价值。
反义探针;端粒酶;磁共振;肿瘤;DOTA
端粒是真核生物染色体末端的核蛋白结构,由非编码的DNA串联线性己核苷酸(TTAGGG)n重复单元所组成[1-2],具有防止染色体降解、重排及融合作用。在DNA合成过程中,传统的DNA聚合酶不能完全复制前述线性DNA末端,因此,随着细胞的分裂,端粒会越来越短,当端粒长度达到Hanflick极限时,会激活p53和RB基因,细胞进入复制衰老期(M1),当机体p53和RB基因功能失调时,M1期细胞将继续分裂进入危机期,此期细胞染色体处于急性不稳定状态,细胞大量凋亡,同时逃过凋亡的细胞将成为永生化细胞(癌细胞)[3-5]。
研究表明,端粒稳定的维持是所有恶性肿瘤细胞最明显的特征,有85%~90%的恶性肿瘤以激活端粒酶的方式来维持端粒的稳定,而在正常体细胞中除活化了的淋巴细胞、生殖细胞外,几乎检测不到其活性,因此,端粒酶已成为肿瘤诊断和治疗研究领域的热点之一。端粒酶是一种核糖核蛋白酶,其核心催化区域或端粒酶元件(TERC)和一个蛋白催化亚单位-端粒酶逆转录酶(TERT)所组成。端粒酶全酶通过TERC与端粒的重复序列相连接,并以TERC为模板合成端粒DNA重复序列[6-7]。
目前,对端粒酶的检测主要有端粒酶扩增(TRAP)法、实时PCR法(RT-PCR)和免疫组织化学染色法[8-10],这些方法虽具有较高的敏感性和特异性,但其具有创伤性和受到取材部位的限制,而传统的影像检查技术如X线计算机体层摄影(CT)、磁共振显像(MRI)、超声(US)等所显示的疾病是基于分子、基因改变所导致的解剖学改变,因此无法对疾病进行准确的诊断。
反义技术是根据碱基互补原理,利用与目标靶DNA或RNA特定互补的短链核苷酸(反义核苷酸)封闭基因表达的方法。而放射性核素反义显像是利用放射性核素标记与肿瘤过度表达的癌基因mRNA互补的人工合成的反义寡核苷酸作为显像剂,通过体内杂交,对特定的肿瘤癌基因进行显像。但核素反义显像存在着解剖和空间分辨率不足,而MRI反义成像是继放射性核素基因成像之后出现的无创性技术,其突出的特点是具有更高的解剖与空间分辨率。目前,以端粒酶逆转录酶为靶点的MRI反义成像目前未见相关报道。本研究以人端粒酶逆转录酶(hTERT)作为感兴趣靶点,以Gd3+标记的人端粒酶逆转录酶反义寡核苷酸(hTERT ASON)对恶性肿瘤端粒酶逆转录酶活性进行活体内MRI显像,以评价Gd-DOTA- hTERT ASON作为恶性肿瘤MRI靶向增强的可行性。
1 材料和方法
1.1 主要材料
全链硫代修饰的hTERT ASON(序列为:5’-TAGAGACGTGGCTCTTGA-3’购自金斯瑞公司(中国南京),其3’端连接一个伯氨结构,连接后结构式为hTERT ASON-(CH2)7-NH2(相对分子质量为5.5×103),纯化方式为聚丙烯凝胶电泳(PAGE)。99mTcO4-淋洗液由北京原子高科股份有限公司提供,N-羟丁基硫代琥珀酰亚胺( N-Hydroxysulfosuccinimide Sodium,Sulfo-NHS )购自日本TCI公司,1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(1,4,7,10-Tetraazacyclododecane-N,N',N'',N'''-tetraacetic acid,DOTA)购自日本TCI公司,1-乙基-(3-二甲基氨基丙基)碳化二亚胺盐酸盐[1-(3-Dimethylaminoptoply)-3-ethylcarbodimide hydrochloride,EDC]由Sigma Aldrich公司提供,6水氯化钆(GdCl3·6H2O)由Aladdin公司提供。
1.2 方法
1.2.1 DOTA-hTERT ASON的制备
分别取DOTA(4.0 mg,9.8 μmol)、 EDC(2 mg,10.4 μmol)、S-NHS(2 mg,9.2 μmol)溶于200 μL pH=5.5的磷酸缓冲液(PBS)中,室温下振荡反应30 min,得到具有氨基反应活性的中间体DOTA-NHS酯[11-12],将活化后的DOTA以分子比DOTA:ASON 75:1,逐滴加入含有ASON (66 μg,22.6 nmol)的1.6 mL pH=8.5的PBS中,室温下振荡反应4 h,将反应液移入透析管(分子截留量:3.5×103)中,以pH=7.0的PBS作为透析液,透析9 h,每3 h换液1次,将纯化后的DOTA-hTERT ASON分装,保存于-20 ℃冰箱中。
1.2.2 DOTA-hTERT ASON的Gd3+标记及质控
将DOTA-hTERT ASON与GdCl3·6H2O按摩尔比1:1加入EP管中,将反应液pH调至7.0,将EP管放入60 ℃恒温水育箱中,振荡反应45 min。将一半的反应液移入24孔细胞培养板中,每孔加入2倍体积的0.5 mmol/L偶氮砷Ⅲ溶液和4倍体积的0.2 mmol/L盐酸,选择波长630 nm,在紫外分光光度仪下测定光密度(A)值,以不加GdCl3作为空白对照,并以预先建立的标准GdCl3浓度曲线为基础计算出游离Gd3+浓度,Gd-DOTA-hTERT ASON的结合率(%)= (反应液Gd3+总浓度-游离Gd3+浓度)/游离Gd3+浓度×100%。
1.2.3 标记探针的体外实验稳定性检测
将标记好的探针加入新鲜人血清并在37 ℃,CO2体积分数为5%的温箱中培养,分别于1、2、4、8、12、24 h检测探针的标记率。
1.2.4 细胞学摄取实验及体外MR显像
人黑色素瘤A375细胞及人脐静脉内皮细胞(HUVEC)分别由四川大学华西医院核医学实验室和再生医学中心惠赠。细胞培养于含L-谷氨酸(2.0 mmol/L)、碳酸氢钠(1.5 ng/L)、非必需氨基酸(0.1 mmol/L)、丙酮酸钠(1.2 mmol/L)、10%小牛血清(体积分数)、青霉素100 U/mL、链霉素100 μg/mL的高糖DMEM培养基中,37 ℃,CO2体积分数为5%的条件下培养。在倒置显微镜下观察细胞的生长状况,台盼蓝染色计数评价细胞活力。99mTc-DOTA-ASON的制备及质控参照朱高红等[13]所报道的方法,本实验所使用的99mTc-DOTA-ASON标记率和放射化学纯度分别为75.56%和94.48%。
取对数生长期细胞,以106/孔种植于24孔细胞培养板中,培养24 h,弃去培养基,每孔加入20 μL99mTc-DOTA-ASON(37 MBq/mL)/ Gd-DOTA-hTERT ASON (10 μg/mL)/Gd-DTPA (10 μmol/mL)和200 μL培养基继续培养。分别于0.5、1、2、4、6 h终止培养,并进行如下处理:将含有分子探针的培养基收集于1支试管中,标记为剩余管,然后以PBS液洗涤3次,并将洗涤液移入剩余管中,在γ放射免疫计数上测定计数(Crest);用0.25%胰蛋白酶消化贴壁细胞,将细胞移入另一试管中,标记为摄取管,用PBS洗涤3次,将洗涤液收集于摄取管中,测定计数(Cuptake);细胞摄取率(%)=Cuptake/(Crest+Cuptake)×100%;将Gd-DOTA-hTERT ASON和Gd-DTPA组细胞收集并悬浮于EP管中,在7.0 T MRI下行常规T1WI扫描,以ROI技术,记录各管的信号强度(signal intensity,SI)。
1.2.5 肿瘤模型的建立
实验动物:BALB/c裸鼠,4~6周龄,18~20 g,雌性。饲养于四川大学实验动物中心无特定病原体(SPF)环境中,所用饲料、饮水与垫料均经高压灭菌处理,实验所有操作均在超净工作台进行。取对数生长期黑色素瘤A375细胞,用0.25%胰蛋白酶消化,离心洗涤2次,用无血清DMEM培养液制成细胞悬液,用1 mL注射器接种于裸鼠右侧臀部皮下,各注射0.2 mL (约含5×106个肿瘤细胞)。待肿瘤直径达8~10 mm时进行实验。
1.2.6 探针的生物分布
取荷黑色素瘤A375裸鼠,并分为7组,每组5只,通过尾静脉分别注射99mTc- DOTA-ASON 7.4 MBq(0.2 mL),分别于注射后0.5、1、2、4、8、12、24 h各处死1组,取血、主要脏器及肿瘤组织,用0.9%NS洗涤2次,用吸水纸吸干后称体质量并测量放射性计数,经物理衰变校正后计算每克组织百分注射剂量率(%ID/g)。
1.2.7 体内MR显像
取15只荷瘤小鼠,分成3组,实验组:通过腹腔分别注射Gd- DOTA-ASON 0.2 mL (10 μg/mL);正义寡核苷酸(sense oligonucleotide,SON)对照组:注射相同剂量Gd-DOTA-SON;Gd-DTPA对照组:注射0.2 mL Gd- DTPA(10 μmol/mL,GE Health Care)。分别于注射后0.5、1、2、4、6、8、12 h行7.0T Micro-MRI(Bruker Biospec,Germany),使用1%~2%异氟烷(isoflurane,
所有计量资料均经SPSS 11.0统计软件处理,结果以x±s表示,均数间的比较用one-way ANOVA和New Student t-test。P<0.05为差异有统计学意义。Hebei,China)吸入麻醉动物,5 cm内径表面线圈,动物取俯卧位,成像参数:多层面多回波T1加权序列(MSME-T1),TR:561 ms,TE:14 ms,层厚1 mm,Matix:256×256。利用感兴趣区(ROI)技术,计算肿瘤与邻近软组织的信噪比(SNR),图像处理用ParaVision 5.0软件。
1.2.8 病理组织学检测
体外实验采用细胞爬片法直接进行端粒酶免疫组织化学染色,体内显像完成后48 h,将动物处死,取肿瘤及邻近组织用4%甲醛溶液固定48 h后用石蜡包埋,制成5 μm厚的切片,进行端粒酶免疫组织化学染色,检测端粒酶活性。
1.3 统计学处理
2 结 果
2.1 反义探针的标记和体外稳定性
Gd-DOTA-ASON的标记率可达65%(63.2±2.4,n=6),在室温下及37 ℃0.9%NaCl溶液中和新鲜人血清中24 h内Gd-DOTA-ASON标记率下降<2%(图1)。

图 1 Gd- DOTA-ASON在不同条件下的稳定性曲线Fig. 1 The stability of Gd- DOTA-ASON under different conditions
2.2 细胞学摄取和体外MRI
A375细胞对反义探针的最高摄取率为(8.9±0.3)%,明显高于HUVEC(5.7±0.4)%(P=0.002,n=6),高峰时间为4 h且可被DOTA-ASON明显抑制(3.6±0.4)%(P<0.05,n=6)。MRI细胞显像结果显示,Gd-DOTA-ASON细胞信号明显高于DOTA-ASON和Gd-DTPA组,表明Gd- DOTAASON反义探针可被细胞摄取(图2)。

图 2 Gd-DOTA-ASON 体外MRI成像Fig. 2 In vitro MR images of Gd-DOTA-ASON (upper line), Gd-DOTA-SON (Middle) and Gd-DTPA (lower line) treated A375 cells
2.3 反义探针的生物分布
99mTc-DOTA-ASON在荷A375肿瘤小鼠体内分布结果(表1)显示,注射后0.5 h肿瘤内反义探针计数相对较高,随即开始下降,于4 h重新达到最高值(2.18±0.29)%ID/g并在12 h内保持在较高水平;反义探针主要通过肾脏排泄,部分经肠道排泄,血液清除较快,骨骼、肺、肌肉、脾等非靶器官摄取较少。
2.4 体内MR显像
在注射Gd- DTPA 和Gd- DOTA-ASON/SON后2 h内,肿瘤均出现明显强化(图3)。Gd-DTPA组肿瘤在注射后6 h其信号强度明显降低与注射前相近,而反义探针组则持续强化;ROI分析结果显示,Gd-DTPA组肿瘤SNR高峰时间出现在注射后0.5 h,随即开始下降,到6 h接近1.0,而反义探针在0.5 h出现峰值后,有所下降,于2 h又重新出现峰值并在6 h内维持在较高水平,正义探针组SNR波动规律与反义探针组相似,但其在2、4、6 h的SNR明显低于反义探针组(P<0.05,n=5);注射后0.5 h 3组肿瘤的SNR差异无统计学意义(P>0.05,n=5),但在2、4、6 h的SNR明显低于反义探针组相应时间点的SNR (P<0.05,n=5,图4)。
2.5 病理学分析
细胞爬片法免疫组织化学染色显示A375细胞端粒酶染色呈阳性,但可被Gd- DOTAASON/99mTc-DOTA-ASON所抑制,此结果提示反义探针可被细胞摄取并与端粒酶RNA模板相结合,抑制端粒酶的表达(图5)。
组织切片法免疫组化结果进一步表明,反义探针在体内也可被A375肿瘤细胞所摄取,并可抑制肿瘤端粒酶的表达,而Gd-DTPA组端粒酶则呈强阳性(图6)。

表 199mTc-DOTA-ASON 在荷A375肿瘤裸鼠体内的生物分布Tab. 1 Biodistribution (%ID/g) of99mTc-DOTA-ASON in mice bearing A375 Xenografts

图 3 腹膜腔注射不同MRI显像剂前后,荷A375肿瘤裸鼠模型多层面多回波T1加权序列MRI成像Fig. 3 MSME-T1weighted MR images of nude mice bearing A375 tumor at pre-injection and 0.5, 2, 6 h after intraperitoneal injection
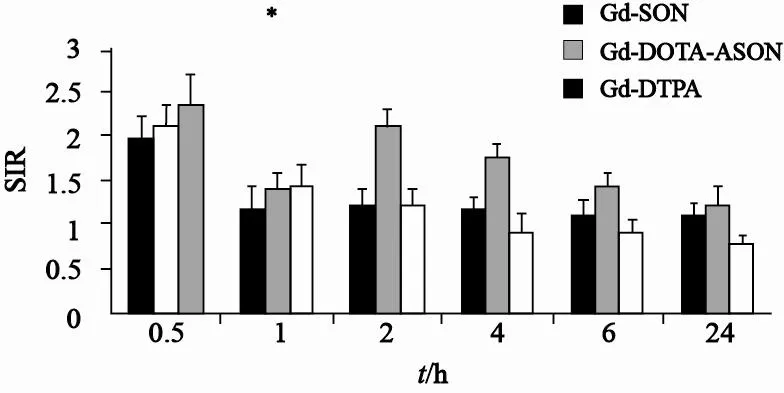
图 4 注射后不同时间点肿瘤与邻近软组织的信噪比Fig. 4 SNR of tumors to muscle after peritoneal injection of Gd-DOTA-ASON/SON and Gd-DTPA at different time point

图 5 不同方法处理后的A375细胞hTERT 免疫组织化学染色Fig. 5 Immunohistostaining of hTERT of A375 cells
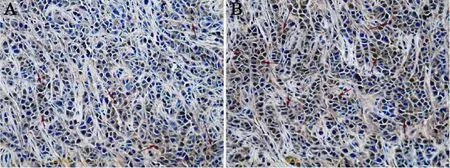
图 6 A375肿瘤组织hTERT 免疫组织化学染色Fig. 6 Immunohistostaining of hTERT of A375 tumor
3 讨 论
端粒酶作为恶性肿瘤重要的标志物之一,在恶性肿瘤的诊断与治疗领域中起着至关重要的作用[14-16],Liu等[17]首次利用99mTc -MAG3-hTERT ASON实现了对人端粒酶活性进行核医学显像,但放射核素反义显像[17-19]虽具有灵敏度高、扫描时间短、探针用量少等优点,但也存在着解剖和空间分辨低等不足,本研究合成的99mTc-DOTA-hTERT ASON反义探针标记率、放射化学纯度及生物分布与Liu等[17]报道的相似;本实验所使Gd-DOTA-hTERT ASON探针对A375肿瘤进行MRI靶向成像,在图像空间、解剖及软组织分辨率方面明显显示了MRI影像的优势。本实验所制备的Gd-DOTA-hTERT ASON在标记率、体内外稳定性方面较Derek等[12]报道稍高,可能是因为SiRNA分子结构不同,且未予以化学修饰有关,但仍需进一步的研究。此外,在生物分布中,骨骼,肌肉、胃肠等器官或组织中对反义探针也有非特异性摄取或分布,其原因可能与细胞对反义探针的非特异性摄取机制有关[20]。细胞爬片及肿瘤组织免疫组织化学染色结果提示,在反义探针处理组中,A375细胞的hTERT活性均比非反义探针处理组低,此结果提示反义探针进入细胞后与细胞的hTERT正义寡核苷酸(SON)发生了杂交反应,并可能在一定程度上抑制了hTERT的表达[17]。
传统的MRI对比剂主要是细胞外对比剂,其所形成的信号差异主要与病变部位的血供相关,因此,对于贫血供的恶性肿瘤或富血供的良性肿瘤的诊断方面胞外对比剂也难免会误诊或漏诊,本实验所制备的反义探针从注射后30 min内生物分布及SNR结果可以与血液灌注有关,此结果与Liu等[17]报道一致。本实验体外及体内MRI显像表明,Gd-DOTA-ASON可作为一种肿瘤特异性对比剂,且在显像时可不受时间和肿瘤血供的限制。此外,病理检测结果提示,本反义探针在体内外均对肿瘤端粒酶有一定的抑制作用,因此将探针标记上治疗性放射性核素(如188Re,89Sr等)后,有望为肿瘤治疗提供一种新方法。
虽然85%以上的肿瘤以表达端粒酶活性的方式来维持端粒的稳定,但仍有10%~15%的恶性肿瘤以变换端粒长度的方式(ALT)保持端粒长度[21],对于此类型的肿瘤诊断和治疗则是本探针目前尚未解决的问题,但可通过恶性肿瘤的其他生物学特征制备相应的分子探针以进行靶向诊断与治疗。此外,以Gd3+为基础的探针另一不足之处是无法通过特异的染色方法来显示其在细胞内的位置[21-22],但以超顺磁性氧化铁(SPIO)为基础的纳米颗粒探针则可解决此问题[23-24]。尽管如此,本研究为MRI肿瘤靶向显像提供了一种新的方法,而进一步研究方向为以反义探针为基础的原位肿瘤模型的靶向显像与治疗。
[1] BODNAR A G, OUELLETTE M, FROLKIS M, et al. Extension of life-span by introduction of telomerase into normal human cells[J]. Science, 1998, 279: 349-352.
[2] GREIDER C W. Telomere length regulation[J]. Ann Rev Biochem, 1996, 65: 337-365.
[3] WEI W, SEDIVY J M. Differentiation between senescence (M1) and crisis (M2) in human fibroblast cultures[J]. Exp Cell Res, 1999, 253: 519-522.
[4] WRIGHT W E, SHAY J W. The two-stage mechanism controlling cellular senescence and immortalization[J].Exp Gerontol, 1992, 27: 383-389.
[5] KIM N W, PIATYSZEK M A, PROWSE K R, et al. Specific association of human telomerase activity with immortal cells and cancer[J]. Science, 1994, 266: 2011-2015.
[6] FENG J L, FUNK W D, WANG S S, et al. The RNA component of human telomerase[J]. Science, 1995, 269: 1236-1241.
[7] SALDANHA S N, ANDREWS L G, TOLLEFSBOL T O. Analysis of telomerase activity and detection of its catalytic subunit, hTERT[J]. Analytical Biochem, 2003, 315: 1-21.
[8] BRUSTMANN H. Immunohistochemical detection of human telomerase reverse transcriptase(hTERT) and c-kit in serous ovarian carcinoma: A clinicopathologic study[J]. Gynecol Oncol, 2005, 98: 396-402.
[9] PONNALA S, CHETTY C, VEERAVALLI K K, et al. MMP-9 silencing regulates hTERT expression via β1 integrinmediated FAK signaling and induces senescence in glioma xenograft cells[J]. Cell Signal, 2011, 23: 2065-2075.
[10] HASHIMOTO Y, MURAKAMI Y, UEMURA K, et al. Detection of human telomerase reverse transcriptase (hTERT) expression in tissue and pancreatic juice from pancreatic cancer[J]. Surgery, 2008, 143: 113-125.
[11] LEE H Y, LI Z B, CHEN K, et al. PET/MRI dual-modality tumor imaging using arginine-glycine-aspartic (RGD)-conjugated radiolabeled iron oxide nanoparticles[J]. J Nucl Med, 2008, 49: 1371-1379.
[12] BARTLETT D W, Helen S U, ISABEL J, et al. Impact of tumor-specific targeting on the biodistribution and efficacy of siRNA nanoparticle s measured by multimodality in vivo imaging[J]. PNAS, 2007, 104(39): 15549-15554.
[13] 朱高红, 任炳秀, 苏玉林, 等. 99mTc二步法标记人端粒酶逆转录酶反义寡核苷酸及体内实验[J]. 中国医学影像技术, 2013, 29(6): 880-886.
[14] PANG L Y, ARGYLE D. Cancer stem cells and telomerase as potential biomarkers in veterinary oncology[J]. Vet J, 2010, 185: 15-22.
[15] CHEN C H, CHEN R J. Prevalence of telomerase activity in human cancer[J]. J Formos Med Assoc, 2011, 110(5):275-289.
[16] LI H Z, Zhou J J, MIKI J, et al. Telomerase-immortalized non-malignant human prostate epithelial cells retain the properties of multipotent stem cells[J]. Exp Cell Res, 2008, 314: 92-102.
[17] LIU M, WANG R F, ZHANG C L, et al. Noninvasive imaging of human telomerase reverse transcriptase (hTERT) messenger RNA with 99mTc-radiolabeled antisense probes in malignant tumors[J]. J Nucl Med, 2007, 48: 2028-2036.
[18] GROOT-WASSINK T, ABOAGYE E O, WANG Y H, et al. Noninvasive Imaging of the Transcriptional Activities of Human Telomerase Promoter Fragments in Mice [J]. Cancer Res, 2004, 64: 4906-4911.
[19] PADMANABHAN P, OTERO J, RAY P, et al. Visualization of telomerase reverse transcriptase (hTERT) promoter activity using a trimodality fusion reporter construct[J]. J Nucl Med, 2006, 47: 270-277.
[20] BRITZ-CUNNINGHAM S H, ADELSTEIN S J. Moleculartargeting with radionuclides: state of the science [J]. J Nucl Med, 2003, 44: 1945-1961.
[21] SONG Y, MEADE T J, ASTASHKIN A V, et al. Pulsed dipolar spectroscopy distance measurements in biomacromolecules labeled with Gd(III) markers[J]. J Magn Reson, 2011, 210: 59-68.
[22] FIGUEIREDO S, MOREIRA J N, CARLOS F, et al. Supramolecular protamine/Gd-loaded liposomes adducts as relaxometric protease responsive probes[J]. Bioorg Med Chem, 2011, 19: 1131-1135.
[23] TYANG F, PRASHANT C, DIPAK M, et al. Multimodal tumor imaging by iron oxides and quantum dots formulated in poly(lactic acid)-D-alpha-tocopheryl polyethylene glycol 1000 succinate nanoparticles[J]. Biomaterials, 2011, 32: 2969-2978.
[24] GBURECK U, JAKOB P M, EULERT J, et al. Iron oxide labelling of human mesenchymal stem cells in collagen hydrogels for articular cartilage repair[J]. Biomaterials, 2008, 29: 1473-1483.
欢迎订阅2013年《循证医学》杂志
《循证医学》是经国家新闻出版署批准,广东省卫生厅主管,由广东省循证医学科研中心、广东省人民医院和中山大学附属第三医院主办的医学学术期刊。现为“中国科技论文统计源期刊(中国科技核心期刊)”,《CNKI中国期刊全文数据库》、“万方数据 — 数字化期刊群”全文收录期刊,“中国学术期刊综合评价数据库”统计源期刊,《中国科学引文数据库》、《中国生物医学文献数据库》、《中国核心期刊(遴选)数据库》、《中文生物医学期刊文献数据库》、《中文科技期刊数据库》来源期刊,荣获首届《CAJ-CD规范》执行优秀期刊奖。
主编吴一龙(广东省人民医院副院长、广东省人民医院肿瘤中心主任、广东省肺癌研究所所长、广东省循证医学科研中心主任,中山大学、南方医科大学、汕头大学、广东省心血管病研究所肿瘤学教授,博士生导师)。本刊以广大医药卫生技术人员和医疗、教学、科研管理工作者为读者对象,立足临床医学,介绍循证医学(evidence-based medicine , EBM)的理念、方法及相关知识,探讨符合中国国情的循证医学实践,促进国内外医学学术交流和医学科学发展。
本刊以临床实践指导性为特色,设置的主要栏目有:先睹为快、述评、特别报告、循证评价、论著(包括诊断性研究、疗效研究、病因学研究、疾病的预后研究等)、证据的寻求与评价、循证医学中的医学统计学问题、循证医学理论与方法研究、综述与讲座、教育与争鸣、循证医学在线、循证病例讨论、临床指引与共识等。诚挚欢迎投稿。
《循证医学》杂志的国际标准刊号:ISSN 1671-5144, 国内统一刊号:CN 44-1548,双月刊、大16开本、64页,国内定价每期10元,全年60元。欲订阅者请从全国各地邮局订购,邮发代号 46-326,也可直接从本刊编辑部邮购。欢迎新老朋友订阅本刊。
地址:广州市中山二路106号广东省人民医院《循证医学》编辑部(510080)。
电话:020-83844620,020-83827812-51482;
传真:020-83844620
网址:www.jebm.cn
E-mail: xzyxzz@163.net
《循证医学编辑部》
An experimental research of magnetic resonance tumor targeting imaging with Gd labeled human telomerase reverse transcriptase antisense oligonucleotide (Gd-DOTA-hTERT ASON)
ZHU Gaohong1, REN Bing-xiu1, WEI Jiang-liang1, SU Yu-lin1, HE Rui1, ZHANG Wei3, CAI Jing1, SONG Bin2(1.Department of Nuclear Medicine, the First Affiliated Hospital of Kunming Medical University, Kunming Yunnan 650032, China; 2.Department of Radiology, West China Hospital of Sichuan University, Chengdu Sichuan 610041, China; 3.Department of Radiology, Tumor Hospital of Sichuan Province, Chengdu Sichuan 610043, China)
REN Bing-xiu E-mail: yn76ren@126.com
Background and purpose: Researches had indicated that about over 85% of malignant tumors highly express telomerase activity. So telomerase has become one of the important methods in the research field of tumor diagnosis and treatment. Nowadays, several reports about malignant tumor which over expresses hTERTtargeting imaging with radionuclide labeled hTERT ASON had been published. In these reports, high quality of pictures can hardly be acquired because of poor anatomical and spacial resolution in nuclear imaging itself. Accordingly, in this study, we developed a method of detecting human telomerase in vivo with magnetic resonance imaging (MRI) and evaluate its feasibility. Methods: Firstly, Uniformly phosphorothioate-modified human telomerase reverse transcriptase antisense oligonucleotide (hTERT ASON) was labeled with Gd3+through the bifunctional chelator 1, 4, 7, 10-tetraazacyclododecane-N, N’, N’’, N’’’-tetraacetic acid (DOTA) and iv vitro experiments were performed to characterize the antisense probes (for biodistribution and cellular uptake,99mTc-DOTA-ASON was used in stead of Gd-DOTA-ASON). Then Gd-DOTA-ASON was injected intraperitoneally in pulmonary adenocarcinoma A375 nude mice tumor-bearing BALB/c for in vivo imaging using 7.0 T Micro MRI periodically, tumors and their surrounding tissues were defined as region of interest (ROI) to calculate the signal to noise ratio (SNR) of tumor to muscle using Gd-DTPA as control. Finally, immunohistochemical analysis of telomerase activity of each xenograft was operated 2 days after imaging. Results: The binding efficiency of Gd-DOTA-ASON reached was as high as 65% (63.2±2.4, n=6). And it can maintain 61% in fresh human serum and normal saline at 37 ℃ over 24 h; A375 cells showed an uptake of 8.5% when incubated with 99mTc -DOTA-ASON; In comparing with DOTA-ASON and Gd-DTPA, cells transected with Gd-DOTA-ASON had higher SI when performed MRI with T1WI. The hTERT-expressing xenografts were obviously enhanced by Gd-DOTA-ASON at 0.5–6 h after injection and the SNR can reach 2.37, whereas obvious enhancement only could be found within 2 h after injection of Gd-DTPA. Both labeled and non-labeled antisense probes can suppress the activity of telomerase of A375 cells either in vitro or in vitro. Conclusion: Our research offers proof that Gd-DOTAASON can be used as tumor specific targeting MR probe for diagnosing malignant tumors with high expression of telomerase.
Antisense probe; Telomerase; MRI; Tumor; DOTA
10.3969/j.issn.1007-3969.2013.10.007
R73-3
:A
:1007-3639(2013)10-0821-08
2012-10-30
2013-09-18)
任炳秀 E-mail:yn76ren@126.com
