PTEN对子宫内膜癌细胞株迁移和侵袭能力的影响
2013-06-09李云云贺文凤黄婷婷申阳刘秀霞曹青
李云云贺文凤黄婷婷申阳刘秀霞曹青
1.南昌大学附属第二医院江西省医学分子重点实验室,江西 南昌,330006;
2.江西省妇幼保健院产前诊断科,江西 南昌,330006
PTEN对子宫内膜癌细胞株迁移和侵袭能力的影响
李云云1贺文凤1黄婷婷2申阳1刘秀霞1曹青1
1.南昌大学附属第二医院江西省医学分子重点实验室,江西 南昌,330006;
2.江西省妇幼保健院产前诊断科,江西 南昌,330006
背景与目的:10号染色体上磷酸酶和张力蛋白同源缺失的基因(phosphatase and tensin homologue deleted on chromosome 10,PTEN)是较为常见的抑癌基因之一。多项研究表明,其在子宫内膜组织中表达量降低,但是对子宫内膜细胞具体的功能及机制却不十分清楚。本研究旨在探讨PTEN对子宫内膜癌HEC-1B细胞迁移及侵袭能力的影响及相关机制,为子宫内膜癌治疗提供新靶点。方法:运用基因重组技术构建pIRES2-ZsGreen1-PTEN重组质粒;将重组质粒转染至子宫内膜癌HEC-1B细胞中,以转染pIRES2-ZsGreen1空载质粒为对照;运用体外划痕、Transwell迁移及侵袭实验分别检测过表达PTEN后细胞迁移和侵袭能力的变化;运用Western blot法检测过表达PTEN后细胞中PTEN、AKT、p-AKT及MMP-2蛋白表达量的变化。结果:PCR产物凝胶电泳显示一条1.2 kb大小的条带,与PTEN cDNA大小符合;基因测序结果与Genbank中PTEN cDNA的序列一致,表明质粒构建成功;转染后48 h荧光显微镜下见荧光且Western blot显示PTEN蛋白表达量增加,表明重组质粒在HEC-1B细胞中表达成功;体外划痕及transwell迁移实验表明,过表达PTEN后HEC-1B细胞的迁移能力减弱;体外侵袭实验显示,过表达PTEN后HEC-1B细胞的侵袭能力明显低于对照组及未处理组;Western blot结果表明,过表达PTEN会降低HEC-1B细胞中p-AKT蛋白表达下降,但是AKT蛋白量却不受影响,同时p-AKT下游的MMP-2蛋白表达量下降。结论:PTEN能明显抑制子宫内膜癌HEC-1B细胞的迁移和侵袭,这一作用可能是通过抑制AKT磷酸化,从而降低MMP-2蛋白的表达而实现的。
子宫内膜癌;肿瘤浸润;10号染色体上磷酸酶和张力蛋白同源缺失的基因;AKT;MMP-2
子宫内膜癌(endometrial carcinoma)是最常见的女性生殖道恶性肿瘤之一,占妇女肿瘤疾病发病的6%[1]。随着科学普查的推广,越来越多的疾病能够得到早期的诊断和治疗,但是对于一些诊断较晚、伴发远处转移以及分化类型较差的患者而言,生存率和复发率还是不容乐观。Ⅰa、Ⅰb期子宫内膜癌的复发率分别为8%和13%,而Ⅰc期则上升至46%,同时Ⅰa期患者5年生存率可达82%,而Ⅰc期约为67%[2]。所以寻找到新的诊治方法对具有高侵袭和迁移能力的子宫内膜癌是十分必要的。
10号染色体上磷酸酶和张力蛋白同源缺失的基因(phosphatase and tensin homologue deleted on chromosome 10,PTEN)是子宫内膜癌中最常见的突变基因之一。37%~61%的内膜样腺癌患者存在PTEN基因突变,40%的内膜癌患者存在PTEN基因杂合性缺失[3],并且PTEN的表达缺失程度与肿瘤的分化类型及预后密切相关[4]。虽然PTEN在子宫内膜癌的发生中发挥重要作用,但对子宫内膜癌细胞具体的功能及机制却不十分清楚。
本研究构建pIRES2-ZsGreen1-PTEN重组质粒,将重组质粒转染至HEC-1B细胞中,观察PTEN对子宫内膜癌细胞株HEC-1B迁移及侵袭能力的影响,以探讨其可能产生作用的机制。
1 材料和方法
1.1 材料
选用PTEN表达阳性的人子宫内膜癌HEC-1B细胞株进行实验,HEC-1B细胞较其同亚型HEC-1A细胞而言,细胞生长稳定并且其细胞形态平整规律更加适用于体外划痕实验[5],细胞株购于中国医学科学院细胞中心;PCR引物由上海生工生物工程技术服务有限公司合成;新生牛血清为PAA公司产品;MEM培养基、0.25%胰酶、LipofectamineTM2000购自Invitrogen公司;pIRES2-ZsGreen1购自长沙赢润生物技术有限公司;限制性内切酶BamHI、EcoRⅠ、TRIzol、PrimeScript®One Step RT-PCR Kit Ver.2试剂盒、凝胶回收试剂盒、质粒中量及大量提取试剂盒购自大连宝生物公司(Takara);T4DNA连接酶购于NEB公司;Transwell小室(8.0 μm孔径)以及Matrigel胶均购买于美国BD公司;PTEN、AKT、p-AKT及MMP-2的一抗购于Cell Signaling公司;辣根过氧化物酶标记的山羊抗鼠、山羊抗兔的二抗购于北京中杉金桥生物技术有限公司;X线片购于柯达公司;测序由本实验室完成。
1.2 方法
1.2.1 重组真核表达质粒pIRES2-ZsGreen1-PTEN的构建
1.2.1.1 引物设计及PTEN cDNA片段扩增
从GenBank中下载PTENmRNA(NM-000314.4)序列,采用Oligo 6.71软件设计其上下游引物,在引物的两端分别加入了EcoRⅠ和BamHⅠ的酶切位点。引物设计分别为:PTEN-F:5’-GGAATTCGCCACCA TGACAGCC ATCATCAAAGAG-3’;PTEN-R:5’-CGGGATCCTCAGACTTTTGTAATTTGTGTATGC-3’。运用TRIzol提取试剂盒提取人293T细胞中的总RNA,逆转录成cDNA后-20 ℃保存备用。根据PrimeScript® One Step RT-PCR Kit Ver.2试剂盒使用说明运用PCR法从人总cDNA片段中扩增出PTEN片段,所得到的PTEN cDNA片段经凝胶电泳验证,与目的片段相吻合后进行测序检验;测序结果正确后将片段纯化、回收、-20 ℃保存备用。
1.2.1.2 将PCR产物连接至pIRES2-ZsGreen1载体
将所得PTEN cDNA片段及pIRES2-ZsGreen1空载质粒分别用EcoRⅠ和BamHⅠ进行酶切处理,酶切后的片段纯化、回收,运用T4 DNA连接酶将两者进行连接,所得到的产物经凝胶电泳验证,将我们所需目的片段根据胶回收试剂盒进行回收,回收产物转化大肠杆菌DH5α感受态细胞,涂板,挑取阳性克隆进行扩增。将所得到的质粒酶切后凝胶电泳验证、测序分析,检测正确后将质粒大量提取,-20 ℃保存备用。
1.2.2 细胞培养及质粒转染
人子宫内膜癌细胞株HEC-1B细胞用含有10%胎牛血清的MEM完全培养基,培养条件为CO2体积分数为5%、37℃、相对湿度90%,细胞呈贴壁生长。取对数生长期的HEC-1B细胞接种于相应培养板,待细胞生长到80%~90%融合时,按照脂质体(LipofectamineTM2000)说明书进行转染,根据转染质粒的不同分为3组:PTEN组(转染pIRES2-ZsGreen1-PTEN质粒)、control组(转染pIRES2-ZsGreen1质粒)和untreated组(未转染组),转染后48 h,荧光显微镜下观察绿色荧光在细胞内的表达情况。
1.2.3 体外细胞划痕实验
转染后将各组细胞接种于12孔板中,待细胞达到80%~90%融合时,用200 μL移液器滴头沿培养板底部划“一”字型横线伤口,更换为无血清培养基,分别在0、12、24、36 h于倒置显微镜下观察细胞运用情况,记录从迁移起点到迁移最远端细胞核之间的距离,以反映迁移速度。实验均重复3次,取平均值。
1.2.4 Transwell肿瘤迁移及侵袭实验
细胞转染24 h后,将培养小室插入到24孔板中,取2×106个转染后细胞重悬于200 μL无血清的MEM培养基中,将细胞混合液缓慢加入到小室的上层;小室的下层中加入含20% FBS的MEM培养基作为趋化因子,CO2体积分数为5%、37 ℃条件下培养24 h后,取出小室,吸出小室中MEM培养基,小心擦去上层细胞,PBS洗3次,倒置晾干,甲醇室温固定10 min,倒置晾干,0.1% 结晶紫染色5 min,清水轻轻浸洗数次,倒置晾干,刀片揭膜,中性树胶封片。镜下观察,随机计数6个视野,计算结晶紫染色细胞数,即为穿膜细胞。细胞侵袭实验:将冻存于-20 ℃的Matrigel胶4 ℃过夜融化,用4 ℃预冷的无血清MEM培养基稀释Matrigel至1 mg/mL,冰上操作。将稀释后的Matrigel胶40 μL包被小室多聚碳酸酯膜的上室面,37 ℃温育4~5 h,胶凝固后备用;取2×105个转染后24 h细胞重悬于200 μL无血清的MEM培养基中,将细胞混合液加入到Matrigel胶的上层;其余步骤与迁移实验相同,以上实验均重复3次。
1.2.5 Western blot检测PTEN及相关蛋白的表达
提取各组细胞中的总蛋白并用BCA法测蛋白浓度,取30 μg蛋白行聚丙烯酰胺凝胶电泳(SDS-PAGE),湿转聚偏二氟乙烯膜(PVDF膜)后5%脱脂牛奶封闭2 h,TBST缓冲液漂洗3次,每次10 min;分别与PTEN、AKT、p-AKT、MMP-2、GAPDH蛋白特异性一抗稀释液4℃温育过夜,TBST缓冲液漂洗3次,每次10 min,加入相应的辣根过氧化物酶标记的二抗稀释液,室温1 h,用ECL化学发光剂显色,暗室下显影。
1.2.6 统计学处理
应用SPSS 15.0统计软件进行分析,实验数据以x±s 表示,两组间数据比较采用t检验,两组以上数据比较采用方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 重组真核表达质粒pIRES2-ZsGreen1-PTEN构建成功
运用设计好的引物对人PTEN片段进行PCR扩增反应,其测序结果与GenBank(NM-000314.4)中PTEN cDNA序列CDS区吻合(图1A);凝胶电泳结果显示1条大小为1.2 kb条带,与PTEN cDNA片段大小符合(图1B),表明目的基因PTEN扩增成功;重组后的pIRES2-ZsGreen1-PTEN质粒经EcoRⅠ和BamHⅠ双酶切反应后,凝胶电泳下成像显示2条大小分别约为1.2和5.2 kb 的条带,而BamHⅠ单酶切后显示为1条6.4 kb大小的条带(图1C),表明PTEN cDNA与pIRES2-ZsGreen1载体连接成功。
2.2 细胞内重组pIRES2-ZsGreen1-PTEN质粒在HEC-1B细胞中表达
将上述的质粒转染子宫内膜癌HEC-1B细胞,由于pIRES2-ZsGreen1载体中携带绿色荧光蛋白基因ZsGreen,故可以通过观察荧光强度检测其在HEC-1B细胞中的转染效率,倒置荧光显微镜下可见转染后80%细胞带有绿色的荧光标记(图2),表明重组pIRES2-ZsGreen1-PTEN质粒在HEC-1B细胞中成功表达。

图 1 重组真核表达质粒pIRES2-ZsGreen1-PTEN的鉴定Fig. 1 Identification of the recombinant plasmid

图 2 重组质粒的转染Fig. 2 Transfection of the recombinant plasmid

图 3 过表达PTEN对HEC-1B细胞迁移速度影响(×100)Fig. 3 The effects of PTEN on the migration capacity of HEC-1B cells (×100)
2.3 过表达PTEN后细胞迁移速度减慢
细胞划痕实验结果显示,划痕后12 h,各组细胞均向划痕区回缩,而PTEN组细胞的回缩速度明显慢于control组(P<0.05)和untreated组(P<0.05),而control组和untreated组间差异无统计学意义(P>0.05,图3)。表明HEC-1B细胞过表达PTEN后,导致其迁移能力明显下降。
2.4 过表达PTEN后细胞迁移能力下降
外迁移实验结果表明,过表达PTEN后细胞迁移能力下降,PTEN组穿膜细胞数为(67.0±10.5) 个,较untreated组(180.0±7.2)个和control组(174.0±10.1)个明显减少,差异有统计学意义(P<0.01,图4)。表明在体外实验中,PTEN能够抑制HEC-1B的迁移。
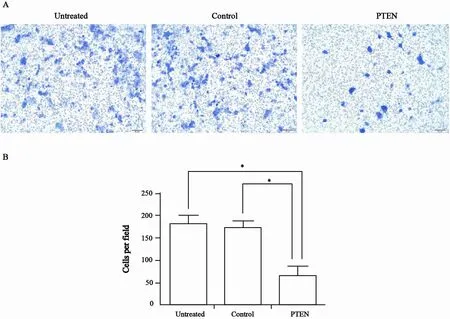
图 4 过表达PTEN对HEC-1B细胞迁移能力影响(×100结晶紫染色)Fig. 4 The effects of PTEN on the migration ability of HEC-1B cells (×100 stained with crystal violet)
2.5 过表达PTEN后细胞侵袭能力下降
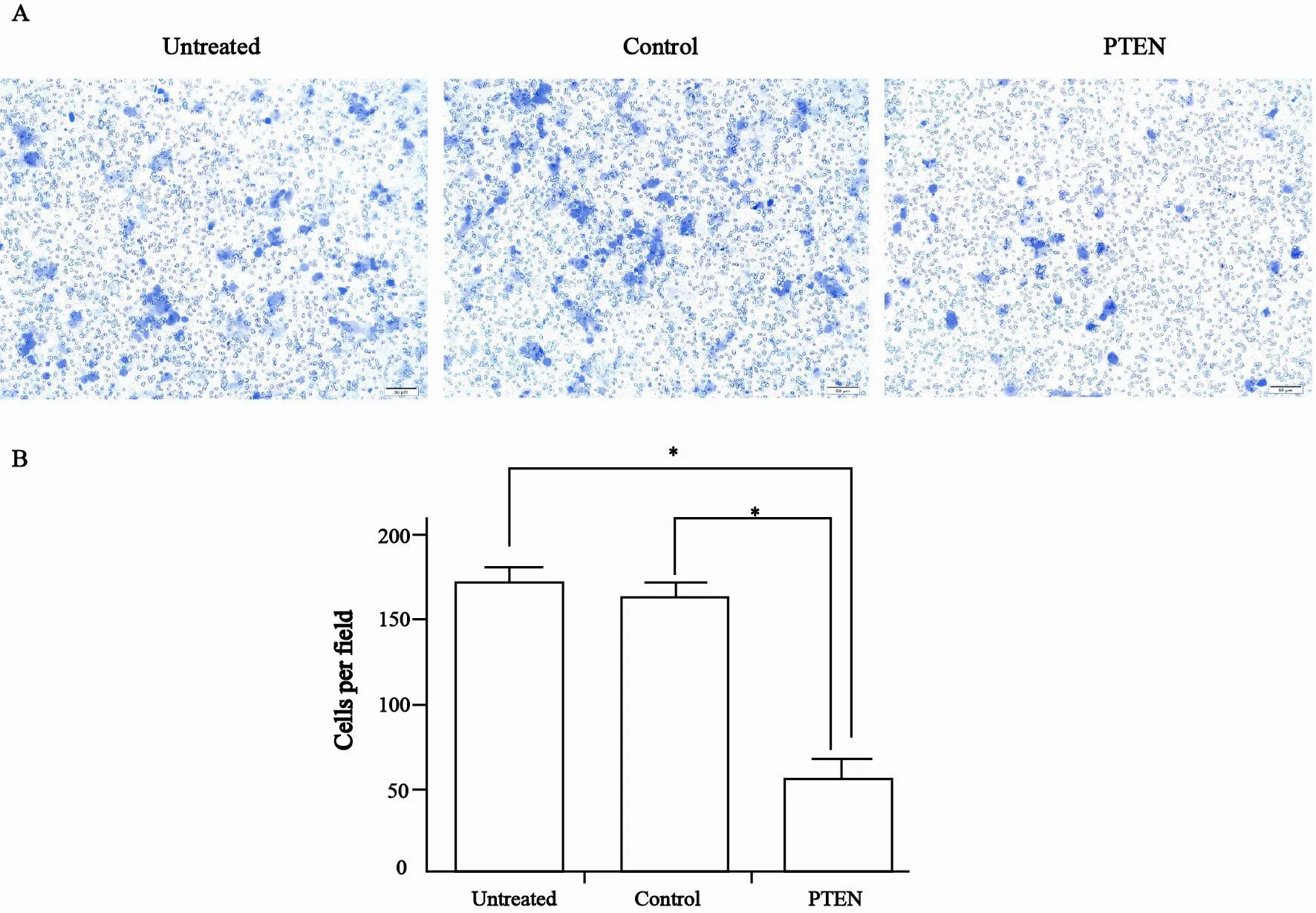
图 5 过表达PTEN对HEC-1B细胞侵袭能力影响(×100结晶紫染色)Fig. 5 The effects of PTEN on the invasion ability of HEC-1B cells (×100 stained with crystal violet)
在小室中添加的Matrigel胶是模拟细胞在人体的中细胞外基质(extracellular matrixc,ECM)的环境,ECM的降解是细胞发生侵袭的重要环节,通过检测细胞穿过基质胶的数量检测细胞侵袭能力的改变。侵袭实验结果显示,PTEN组细胞穿过Matrigel胶的细胞数量为(67.3±11.7)个,较untreated组(171.7±10.4)个和control组(164.3±9.0)个明显减少,差异有统计学意义(P<0.01,图5)。表明PTEN能够明显抑制HEC-1B细胞的侵袭。
2.6 转染后PTEN及相关蛋白表达量的变化
Western blot结果显示,PTEN组p-AKT的蛋白表达量较control组和untreated组降低,为了检测p-AKT蛋白表达量的变化是否来自AKT蛋白本身,我们同时检测了AKT蛋白的变化,发现AKT蛋白却无明显变化;另外,PTEN组p-AKT下游的MMP-2蛋白表达量也明显较control组和untreated组表达降低(图6)。

图 6 Western blot检测过表达PTEN后AKT、p-AKT、MMP-2蛋白表达量的变化Fig. 6 The expression of AKT, p-AKT and MMP-2 proteins was detected by Western blotting
3 讨 论
pIRES2-ZsGreen1载体是携带有内部核糖体进入位点序列(internal ribozyme entry site,IRES)的新型表达载体。较传统的翻译步骤而言,IRES序列可以不依赖于5’端帽状结构而直接将真核生物核糖体募集到mRNA分子5’UTR上进行翻译[6]。由于具有独立的起始翻译功能,IRES序列目前被广泛应用于双元素表达载体的构建。传统的质粒构建过程中由于只有一个翻译起始位点,所以构建目的基因的尾端多携带有绿色荧光蛋白或者其他标签蛋白,对于分子量较大或者空间折叠结构较复杂的蛋白,重组后分子可能会影响蛋白翻译后的空间位置的折叠,甚至形成不可溶的蛋白体,从而影响到蛋白的功能[7]。本研究运用具有独立启动子功能的pIRES2-ZsGreen1载体,构建了PTEN的重组质粒,为检测PTEN对子宫内膜癌细胞功能的研究提供基础。荧光显微成像及Western blot结果显示转染后细胞中PTEN蛋白表达量增加,表明重组后的pIRES2-ZsGreen1-hPTEN在HEC-1B细胞中表达成功。
PTEN是一种编码双重特异磷酸酶的抑癌基因,在多种肿瘤组织中表达缺失或突变,如肝癌[8]、胶质瘤[9]及子宫内膜癌[10]。大量的实验数据表明,PTEN在多种肿瘤相关的生物学进程中,包括肿瘤的生长、凋亡以及侵袭发挥重要作用[11]。而这一重要的生物学功能主要是通过其脂质磷酸酶的活性产生的。通过特异性的去除磷脂酰肌醇-3,4,5-三磷脂(phosphat -idylinositol-3,4,5-trisphosphate,PIP3)上的磷酸集团,抑制了蛋白激酶B(ATP-dependent tyrosine kinase,AKT)激活,导致其下游的相关信号分子如NF-κB、caspase-9、mTOR、MMP-2和GSK-2等表达减少,而这些信号分子在维持细胞的增殖、分化、凋亡以及侵袭等过程中发挥着重要作用[12]。实验证实,37%~61%的内膜样腺癌患者存在PTEN基因突变,40%的内膜癌患者存在PTEN基因杂合性缺失[3],并且PTEN表达缺失程度与肿瘤的分化类型及预后密切相关[4]。除此之外,80%的子宫内膜癌患者还存在这条信号通路中其他下游因子表达异常[13]。因此,了解其在子宫内膜癌中发挥的生物学功能及机制,将为子宫内膜癌的生物治疗提供新的思路。本研究结果显示,过表达PTEN能够明显抑制HEC-1B细胞的侵袭和迁移。
MMP-2是基质金属蛋白酶中的重要亚型,与MMP-9一同通过作用于基质中的Ⅳ型胶原,降解细胞外基质(extracellular matrix,ECM)。ECM是肿瘤侵袭和转移的天然屏障,所以MMP-2在肿瘤的侵袭与转移过程中发挥重要作用[14]。在卵巢癌组织中,伴随恶性程度的增加MMP-2的表达量增加。健康人或是良性肿瘤的患者中,无MMP-2表达量上升,无远处转移的癌症患者中63%表达量上升,而在伴有转移的患者中93%表达量上升[15]。同时在子宫内膜癌的病理组织中发现,浆液组织中若存在MMP-2表达阳性,对患者术后复发有诊断意义[16]。多项报道显示,AKT是MMP-2的上游,在肝癌细胞中运用药物抑制PI3K/AKT信号通路后,肝癌细胞的MMP-2的降低伴随侵袭能力减弱[8]。而在非小细胞肺癌中,ICAM-3亦通过AKT提高细胞中MMP-2表达,增强了细胞的迁移和侵袭能力[17]。本研究中,过表达PTEN后,p-AKT表达量降低,伴随MMP-2的表达降低,而细胞中总的AKT蛋白表达量没有明显变化。表明PTEN抑制子宫内膜癌的侵袭和迁移的功能部分是依赖PTEN介导的AKT/MMP-2这条通路完成的。
综上所述,本研究成功构建了含有PTEN基因的重组质粒,运用脂质体转染法将重组后的PTEN成功转染至HEC-1B细胞后,发现细胞的侵袭和迁移能力明显受到抑制,同时发现细胞中MMP-2表达量降低,表明PTEN抑制子宫内膜癌的侵袭和迁移的功能部分是依赖PTEN介导的AKT/MMP-2这条通路完成的,为今后进一步了解PTEN在子宫内膜癌中的生物学功能及机制提供了重要途径,并为肿瘤的生物治疗提供了新思路。
[1] JEMAL A, SIEGEL R, WARD E, et al. Cancer statistics, 2009[J]. CA Cancer J Clin, 2009, 59(4): 225-249.
[2] 郎景和. 子宫内膜癌诊治的几个问题 [J]. 中华妇产科杂志, 2000, 35(5): 261.
[3] MATIAS-GUIU X, PRAT J. Molecular pathology of endometrial carcinoma [J]. Histopathology, 2013, 62(1): 111-123.
[4] CULLY M, YOU H, LEVINE A J, et al. Beyond PTEN mutations: the PI3K pathway as an integrator of multiple inputs during tumorigenesis [J]. Nat Rev Cancer, 2006, 6(3): 184-192.
[5] KURAMOTO H. Studies of the growth and cytogenetic properties of human endometrial adenocarcinoma in culture and its development into an estabished line [J]. Acta Obstet Gynaecol Jph, 1972, 19(1): 47-58.
[6] BOCHKOV Y, PALMENBERG A. Translational efficiency of EMCV IRES in bicistronic vectors is dependent upon IRES sequence and gene location [J]. Biotechniques, 2006, 41(3): 283-292.
[7] HEDDLE C, MAZALEYRAT S L. Development of a screening platform for directed evolution using the reef coral fluorescent protein ZsGreen as a solubility reporter [J]. Protein Eng Des Sel, 2007, 20(7): 327-337.
[8] TIAN T, NAN K J, GUO H, et al. PTEN inhibits the migration and invasion of HepG2 cells by coordinately decreasing MMP expression via the PI3K/Akt pathway [J]. Oncol Rep, 2010, 23(6): 1593-1600.
[9] KOUL D, PARTHASARATHY R, SHEN R, et al. Suppression of matrix metalloproteinase-2 gene expression and invasion in human glioma cells by MMAC/PTEN [J]. Oncogene, 2001, 20(46): 6669-6678.
[10] GARCIA-DIOS D A, LAMBRECHTS D, COENEGRACHTS L, et al. High-throughput interrogation of PIK3CA, PTEN, KRAS, FBXW7 and TP53 mutations in primary endometrial carcinoma [J]. Gynecol Oncol, 2013, 128(2): 327-334.
[11] LI L, ROSS A H. Why is PTEN an important tumor suppressor? [J]. J Cell Biochem, 2007, 102(6): 1368-1374.
[12] SLOMOVITZ B M, COLEMAN R L. The PI3K/AKT/mTOR pathway as a therapeutic target in endometrial cancer [J]. Clin Cancer Res, 2012, 18(21): 5856-5864.
[13] O’HARA A J, BELL D W. The genomics and genetics of endometrial cancer [J]. Adv Genomics Genet, 2012, 2012(2): 33-47.
[14] BAUVOIS B. New facets of matrix metalloproteinases MMP-2 and MMP-9 as cell surface transducers: outside-in signaling and relationship to tumor progression [J]. Biochim Biophys Acta, 2012, 1825(1): 29-36.
[15] SCHMALFELDT B, PRECHTEL D, HARTING K, et al. Increased expression of matrix metalloproteinases (MMP)-2, MMP-9, and the urokinase-type plasminogen activator is associated with progression from benign to advanced ovarian cancer [J]. Clin Cancer Res, 2001, 7(8): 2396-2404.
[16] PULJIZ M, PULJIZ Z, VUCEMILO T, et al. Prognostic significance of matrix metalloproteinases 2 and 9 in endometrial cancer [J]. Coll Antropol, 2012, 36(4): 1367-1372.
[17] PARK J K, PARK S H, SO K, et al. ICAM-3 enhances the migratory and invasive potential of human non-small cell lung cancer cells by inducing MMP-2 and MMP-9 via Akt and CREB [J]. Int J Oncol, 2009, 36(1): 181-192.
Effects of PTEN on the migration and invasion of endometrial carcinoma cells
LI Yun-yun1, HE Wen-feng1, HUANG Ting-ting2, SHEN Yang1, LIU Xiu-xia1, CAO Qing1(1.The Key Laboratory of Molecular Medicine of Jiangxi Province, the Second Affiliated Hospital of Nanchang University, Nanchang Jiangxi 330006, China; 2.Department of Prenatal Diagnosis, Jiangxi Maternal and Child Health Hospital, Nanchang Jiangxi 330006, China)
CAO Qing E-mail: cao_qing29@163.com
Background and purpose: Phosphatase and tensin homologue deleted on chromosome 10 (PTEN) gene is a kind of tumor suppressors, which has been reported to be underexpressed in endometrial carcinoma (EC) tissues by several reports. However, the biological effects and possible mechanisms of PTEN on EC have been known less. In this study, we tried to investigate the effects and possible mechanisms of PTEN on the invasion and migration of endometrial carcinoma cells and to provide a potential target for endometrial carcinoma therapy. Methods: The recombinant plasmid pIRES2-ZsGreen1-PTEN was rebuilt by gene recombination technology; The plasmid was transferred into HEC-1B cells and the cells transfected with pIRES2-ZsGreen1 plasmid were used as control; The expression of PTEN was observed by fluorescence microscope and Western blot assay; Cell migration and invasion was determined by the wound healing assay, transwell migration and invasion assays respectively; The Western blot analysis was performed to detect the expression of ATP-dependent tyrosine kinase (AKT), phosphorylated-AKT (p-AKT) and matrix metalloproteinase-2 (MMP-2). Results: The agarose gel electrophoresis showed a stripe of 1.2kb which was same to PTEN cDNA; The sequence analysis showed the PCR products owned the same sequence with the coding region of PTEN cDNA in GenBank, suggesting the recombinant plasmid was constructed successfully; The green light of cells observed by fluorescence microscope and the Western blot analysis showed the expression of PTEN was upregulated in the cells transfected with the recombinant plasmid, suggesting the plasmid expressed successfully in HEC-1B cells; The wound healing assay as well as transwell migration assay showed ectopic expression of PTEN suppressed cell migration; The invasive capacity of HEC-1B cells was significantly decreased upon transfection with PTEN plasmid compared to control and untreated groups; Moreover, compared with the control groups, the expression of p-AKT and MMP-2 was downregulated, while there was no significant alteration of the expression of AKT. Conclusion: PTEN could suppress cell migratory and invasive ability of endometrial carcinoma cells by suppressing the phosphorylation of AKT followed by the decrease of MMP-2.
Endometrial carcinoma; Tumor invasion; Phosphatase and tensin homologue deleted on chromosome 10; AKT; MMP-2
10.3969/j.issn.1007-3969.2013.10.006
R737.33
:A
:1007-3639(2013)10-0813-08
2013-07-02
2013-09-30)
曹青 E-mail:cao_qing29@163.com
