多柔比星诱导乳腺癌细胞PARP-1活性上调依赖于Kif4A蛋白低表达
2013-06-09
苏州大学附属第三医院病理科,江苏 常州,213003
多柔比星诱导乳腺癌细胞PARP-1活性上调依赖于Kif4A蛋白低表达
王辉 鲁常青 田波 李青 陈铜兵
苏州大学附属第三医院病理科,江苏 常州,213003
背景与目的:化疗作为乳腺癌术后治疗的重要手段,由其引发的耐药现象备受关注,而耐药的出现与DNA损伤修复异常增强密切相关。驱动蛋白家族成员4A(kinesin family member 4A,Kif4A)和聚腺苷酸二磷酸核糖聚合酶-1[poly(ADP-ribose)polymerase,PARP-1]是重要的DNA损伤修复分子。本研究探讨Kif4A在多柔比星诱导乳腺癌细胞PARP-1活性上调中的作用及意义。方法:蛋白质印迹法检测多柔比星处理后乳腺癌MDA-MB-231和MCF-7细胞Kif4A蛋白表达及PARP-1活性的变化;并检测高表达Kif4A蛋白后,乳腺癌细胞PARP-1蛋白表达及其活性变化;流式细胞技术检测多柔比星联合PARP-1抑制剂3-氨基苯酰胺(3-Aminobenzamide,3-ABA)干预后乳腺癌细胞的凋亡情况。结果:多柔比星能上调PARP-1活性并诱导乳腺癌细胞Kif4A蛋白低表达,两者都呈浓度和时间依赖性;高表达Kif4A后,PARP-1活性被明显抑制,细胞凋亡数增加,而多柔比星能部分逆转由Kif4A高表达而引起的PARP-1活性抑制。多柔比星和3-ABA都诱导乳腺癌细胞凋亡,联合使用能增加细胞凋亡,与单独使用比较,差异有统计学意义(P<0.05)。结果还显示,多柔比星、PARP-1抑制剂3-ABA及高表达的Kif4A诱导的MDA-MB-231细胞凋亡数高于MCF-7细胞,差异有统计学意义(P<0.05)。结论:多柔比星诱导乳腺癌细胞PARP-1活性上调依赖于细胞Kif4A蛋白低表达,Kif4A有望成为逆转多柔比星耐药的新靶点。
驱动蛋白家族成员4A;聚腺苷酸二磷酸核糖聚合酶-1;多柔比星;MCF-7细胞;MDA-MB-231细胞
多柔比星是临床上常用的化疗药物,能与DNA发生交联,抑制DNA复制,阻断细胞分裂,达到杀伤肿瘤细胞的目的。然而最近临床用药显示,多柔比星的化疗特别是对乳腺癌的化疗耐药现象常见,而化疗耐药原因可能与肿瘤细胞DNA损伤修复能力异常增强有关。聚腺苷酸二磷酸核糖聚合酶-1[poly(ADP-ribose) polymerase,PARP-1]在DNA损伤修复中起着重要作用。研究发现多柔比星能上调多种乳腺癌细胞PARP-1的活性[1-2]。本研究通过实验证明驱动蛋白家族成员4A(kinesin family member 4A,Kif4A)在多柔比星诱导乳腺癌细胞PARP-1活性上调中起着重要作用,为乳腺癌耐药研究提供线索。
1 材料和方法
1.1 细胞及试剂
1.1.1 细胞株
乳腺癌细胞MCF-7购于中国科学院典型培养物保藏委员会细胞库,乳腺癌细胞MDAMB-231购于南京凯基生物技术有限公司。
1.1.2 试剂
DMEM细胞培养液购于Invitrogen公司;胎牛血清购于美国Hyclone公司;一抗Kif4A多克隆抗体和PAR多克隆抗体购于SAB公司,PARP多克隆抗体和α-tubulin多克隆抗体购于Cell Signaling公司;二抗HRP标记的羊抗鼠二抗及羊抗兔二抗购于Amersham公司;多柔比星购于美国Sigma公司;PARP-1抑制剂3-氨基苯酰胺(3-Aminobenzamide,3-ABA)购于Amresco公司;AnnexinⅤ-FITC细胞凋亡检测试剂盒购于南京凯基生物有限公司。
1.2 细胞培养
MCF-7细胞和MDA-MB-231细胞均用含10%灭活胎牛血清、100 U/mL青霉素、100 U/mL链霉素和2 mmol/L谷氨酰胺的高糖DMEM完全培养液,于37 ℃、CO2体积分数为5%培养箱中培养,每2~3天用0.25%胰蛋白酶和0.5% EDTA混合液传代。
1.3 实验分组及细胞处理
接种MCF-7和MDA-MB-231细胞(MCF-7细胞接种密度为3×105个细胞/孔,MDA-MB-231细胞接种密度为5×105个细胞/孔,下面实验细胞接种密度与此相同)于6孔板中,次日换新鲜的含10%胎牛血清的DMEM培养液2 mL,分别用0.05、0.1、0.5、1、2 μmol/L的多柔比星处理MCF-7细胞24 h,恢复12 h,裂解细胞,收集蛋白,备用与蛋白印迹法检测。以不加多柔比星细胞为对照组(0 μmol/L)。每组设3个重复孔。
1 μmol/L浓度多柔比星处理MCF-7/MDAMB-231细胞24 h,分别在恢复6、12、24和48 h后,用PBS洗细胞2次,裂解细胞,收集蛋白,并进行蛋白定量,备用与蛋白印迹法检测。以不给予恢复时间细胞组为对照组。每组设3个重复孔。
构建并转染HA-Kif4A质粒至MCF-7和MDA-MB-231细胞中,1 μmol/L浓度的多柔比星处理24 h,恢复12 h,裂解细胞,收集蛋白,并进行蛋白定量,备用与蛋白印迹法检测。以转染空载质粒和未加多柔比星细胞组为对照组。每组设3个重复孔。
接种MCF-7/MDA-MB-231细胞,用1 μmol/L浓度的多柔比星联合5 μmol/L浓度的3-ABA分别处理MCF-7和MDA-MB-231细胞24 h,恢复12 h,收取上清液及培养皿底部贴壁细胞,用PBS洗涤2次,用FCM法检测细胞凋亡。以不加多柔比星和3-ABA的MCF-7细胞组为对照组。每组设3个重复孔。
1.4 蛋白质印迹法(Western blot)
Western blot检测Kif4A、PARP-1的表达及PARP-1的活性,用细胞裂解液提取各组总蛋白;考马斯亮蓝比色法测定蛋白含量,取等量蛋白进行8%的SDS-PAGE凝胶电泳,PVDF转膜,非特异性封闭;加入抗Kif4A多克隆抗体、抗PARP-1多克隆抗体、抗PAR多克隆抗体及抗α微管蛋白多克隆抗体,4 ℃过夜;加入辣根过氧化物酶标记的相应的二抗进行杂交2 h。ECL发光剂温浴5 min,曝光、显影、定影。用α微管蛋白作为内参。数码成像分析系统软件对结果进行分析,用Image-Pro Plus 6.0软件对蛋白条带进行光密度分析,目的蛋白的相对表达量=(待检测蛋白光密度/α微管蛋白光密度。实验重复3次。
1.4 RT-PCR检测
提取HEK293(购于中国科学院典型培养物保藏委员会细胞库)细胞总RNA,并以其为模板,扩增Kif4A;Kif4A引物序列:上游5’-TGAAGC TTACATGAAGGAAGAGGTGAAG-3’;下游5’-AGATGTCGACTCCAACTTCAGTGGG-3’,反应条件94 ℃ 2 min;98 ℃ 10 s,55 ℃ 10 s,72 ℃4.5 min,30个循环;72 ℃ 5 min 。
1.5 FCM法检测细胞凋亡
按实验要求处理MCF-7和MDA-MB-231细胞,用不含EDTA胰酶消化收集细胞,合并上清液和细胞,用PBS再洗涤2次,然后用500 mL结合缓冲液悬浮细胞,加入5 mL的AnnevinⅤ-FITC混匀,加入5 mL的PI混匀,室温避光反应5~15min,流式细胞仪检测(1 h内完成细胞检测)。计算细胞凋亡率。实验重复3次。
1.6 统计学处理
应用SPSS 17.0统计分析软件进行实验结果数据处理,计量资料以x±s 表示,两组间均数的比较采用t检验,多组均数间的比较采用单因素方差分析,再用Tukey post hoc进行两两比较。P<0.05为差异有统计学意义。
2 结 果
2.1 多柔比星对乳腺癌细胞MCF-7和MDAMB-231表达Kif4A和PARP-1的影响
分别用0.05、0.1、0.5、1和2 μmol/L浓度多柔比星干预MCF-7和MDA-MB-231细胞24 h,恢复12 h,以不加多柔比星细胞为对照组(0 μmol/L),蛋白质印迹法检测结果显示,随着多柔比星浓度的升高,MCF-7和MDA-MB-231细胞PARP-1活性即多聚核糖基化修饰[poly(ADP-ribose),PAR]在整个过程中逐渐增强,在1 μmol/L时,其活性是对照组(0 μmol/L)的2倍以上,差异有统计学意义(P<0.05);相反Kif4A蛋白却呈现出逐渐低表达,在多柔比星浓度为1 μmol/L时,Kif4A蛋白基本不表达,差异有统计学意义(P<0.05);而全长PARP-1(113×103)蛋白表达在整个过程中变化不大,其断裂(89×103)略有减少(图1)。
1 μmol/L浓度多柔比星处理MCF-7细胞24 h,分别恢复6、12、24、48 h,以未处理组和不予恢复时间作为对照组,蛋白质印迹法检测结果显示,多柔比星处理后随着恢复时间的延长,两种细胞的PARP-1活性PAR都呈现出逐渐增加的趋势,在多柔比星处理后不予恢复时间组中PAR被抑制,与对照组相比,差异有统计学意义(P<0.05);相反Kif4A蛋白却呈现出逐渐低表达,差异有统计学意义(P<0.05);而全长PARP-1蛋白表达在整个过程中变化不大,随着恢复时间的延长,断裂PARP-1略有减少,与加入多柔比星但不予恢复时间组相比较,给予恢复时间组PARP-1断裂减少,差异有统计学意义(P<0.05,图2)。
2.2 Kif4A高表达对MCF-7和MDA-MB-231细胞表达PARP-1及其活性的影响
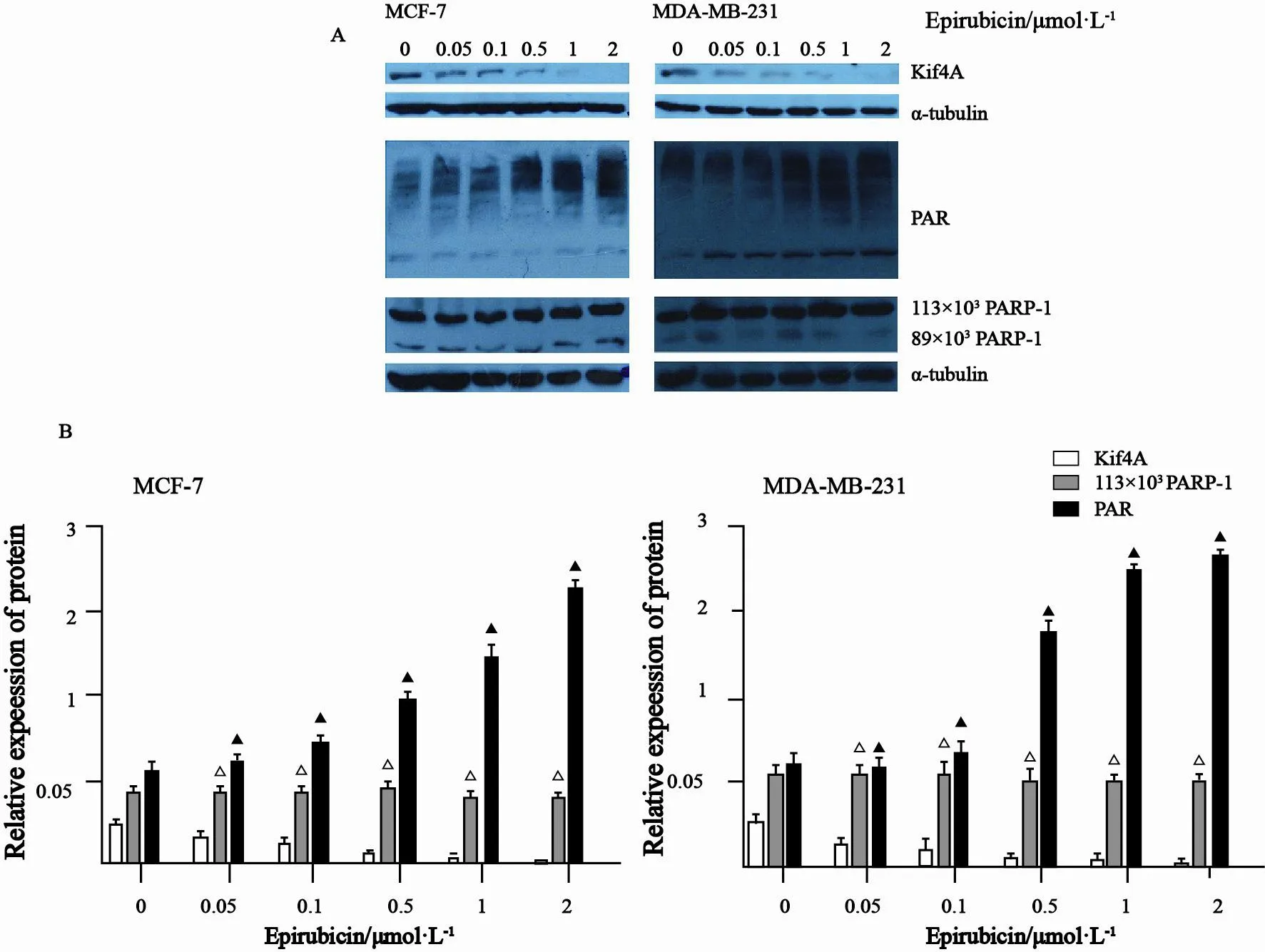
图 1 蛋白质印迹法检测不同浓度多柔比星处理MCF-7和MDA-MB-231细胞24 h且恢复12 h后Kif4A及PARP-1的表达情况Fig. 1 The expressions of Kif4A and PARP-1 after treatment with epirubicin for 24 h, and recovery for 12 h were detected by Western blot in MCF-7 and MDA-MB-231 cells.
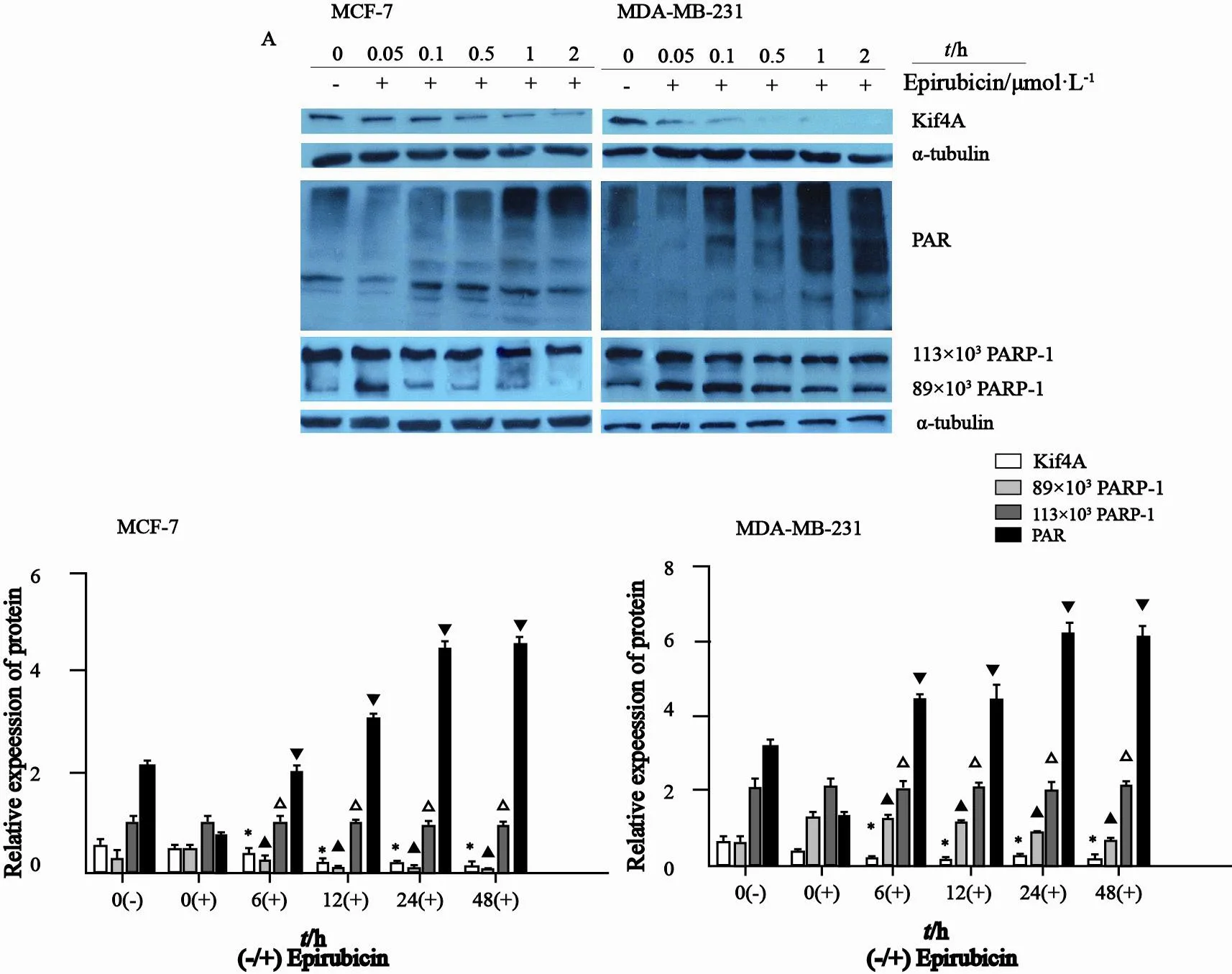
图 2 蛋白质印迹法检测1 μmol/L浓度多柔比星处理MCF-7细胞24 h,恢复不同时间后Kif4A及PARP-1的表达情况Fig. 2 The expression of Kif4A and PARP-1 after treatment with 1 μmol/L epirubicin for 24 h and recovery for different time were detected by Western blotting in MCF-7 and MDA-MB-231 cells
构建HA-Kif4A(结果未显示),转染HAKif4A至MCF-7和MDA-MB-231细胞内,1 mmol/L浓度多柔比星处理24 h,恢复12 h,裂解细胞,蛋白质印迹法检测结果显示:Kif4A的高表达能明显抑制MCF-7和MDA-MB-231细胞的PARP-1活性,与未转染组和转染空载体组相比,差异有统计学意义(P<0.05),而多柔比星能部分逆转由外源性Kif4A高表达引起的PARP-1活性抑制;多柔比星处理组PARP-1活性明显增强,与不加多柔比星相比,差异有统计学意义(P<0.05,图3)。
2.3 多柔比星联合3-ABA作用对MCF-7和MDA-MB-231细胞凋亡的影响
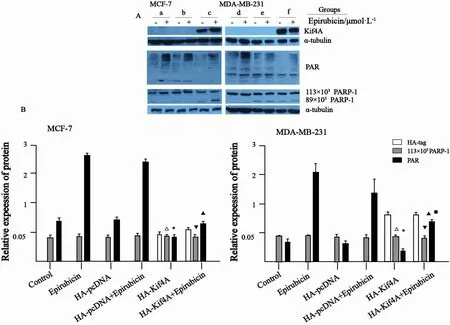
图 3 蛋白质印迹法检测Kif4A高表达后1 μmol/L浓度多柔比星处理MCF-7和MDA-MB-231细胞24 h、恢复12 h后PARP-1蛋白表达或活性的情况Fig. 3 The expression of PARP-1 after transfected HA-Kif4A plasmid and treated with 1 μmol/L epirubicin for 24 h and recovery for 12 h by Western blot in MCF-7 and MDA-MB-231 cells
用1 mmol/L浓度多柔比星联合5 mmol/L浓度3-ABA处理MCF-7和MDA-MB-231细胞24 h,恢复12 h,收取上清液及培养皿底部贴壁细胞,用PBS洗涤2次,以不加多柔比星和3-ABA为对照组,FCM法检测细胞凋亡,结果显示,在MCF-7细胞,多柔比星及3-ABA都能诱导MCF-7细胞发生凋亡,细胞凋亡率分别为(5.94±0.27)%和(6.90±0.17)%,与对照组 [(3.85±0.26)%]相比,差异有统计学意义(P<0.05);两者联合使用能进一步诱导细胞凋亡,凋亡率为(10.24±0.81)%,与多柔比星及3-ABA单独使用相比,差异有统计学意义(P<0.05,图4)。
多柔比星及3-ABA都能诱导MDA-MB-231细胞发生凋亡,细胞凋亡率分别为(6.30±0.48)%和(7.83±0.58)%,与对照组[(3.14±0.67)%)相比,差异有统计学意义(P<0.05);两者联合使用则进一步诱导细胞凋亡,凋亡率为(11.53±0.45)%,与多柔比星和3-ABA单独使用相比,差异有统计学意义(P<0.05,图4)。
本研究同时还比较了多柔比星及3-ABA处理后,MCF-7与MDA-MB-231细胞的凋亡差异,结果显示:多柔比星、3-ABA、多柔比星+3-ABA处理后,MDA-MB-231细胞凋亡率分别为(6.30±0.48)%、(7.83±0.58)%和 (11.53±0.45)%,显著高于MCF-7细胞相对应处理组,差异有统计学意义(P<0.05,图4)。
2.4 Kif4A高表达对多柔比星诱导MCF-7和MDA-MB-231细胞凋亡的影响
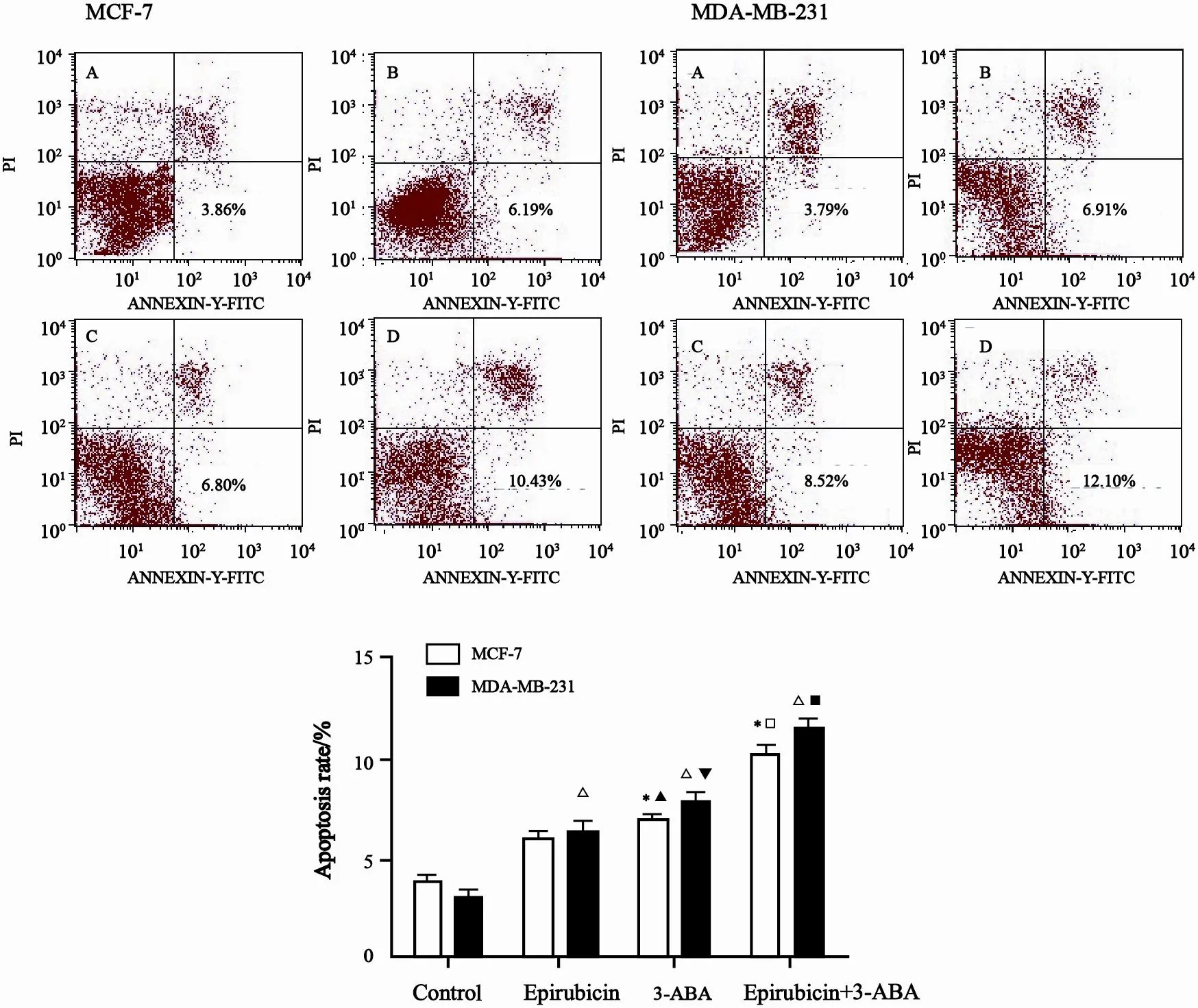
图 4 FCM法检测多柔比星联合3-ABA对MCF-7和MDA-MB-231细胞凋亡影响Fig. 4 The apoptosis of MCF-7 and MDA-MB-231 cells after treated with PARP-1 inhibitor 3-ABA and epirubicin were detected by FCM
转染HA-Kif4A至MCF-7和MDA-MB-231细胞内,1 mmol/L浓度多柔比星处理24 h,恢复12 h,收集细胞,FCM法检测细胞凋亡,结果显示,Kif4A高表达后,多柔比星能上调MCF-7细胞凋亡,凋亡率为(9.23±0.70)%,与HA-pcDNA+多柔比星组[(7.19±0.75)%)和HAKif4A组[(6.80±0.23)%]相比,差异有统计学意义(P<0.05);HA-Kif4A高表达也能诱导MCF-7细胞凋亡,凋亡率为(6.80±0.23)%,与HA-pcDNA组[(4.48±0.42)%]和对照组MCF-7组[(4.10±0.58)%]相比,差异有统计学意义(P<0.05)。
Kif4A高表达后,多柔比星能上调MDAMB-231细胞凋亡,凋亡率为(11.40±0.63)%,与HA-pcDNA+多柔比星组[(7.10±0.61)%]和HA-Kif4A组[(8.36±0.79)%]相比,差异有统计学意义(P<0.05);HA-Kif4A高表达也能诱导MDA-MB-231细胞凋亡,凋亡率为(8.36±0.79)%,与HA-pcDNA组[(4.44±0.36)%]和对照的MDA-MB-231组[(3.85±0.66)%]相比,差异有统计学意义(P<0.05)。
本研究同时还比较在Kif4A高表达后MCF-7与MDA-MB-231细胞的凋亡差异,结果显示,HA-Kif4A、HA-Kif4A+3-ABA处理后,MDA-MB-231细胞凋亡率分别为(8.36±0.79)%和(11.40±0.63)%,与相对照的MCF-7细胞组相比,差异有统计学意义(P<0.05,图5)。
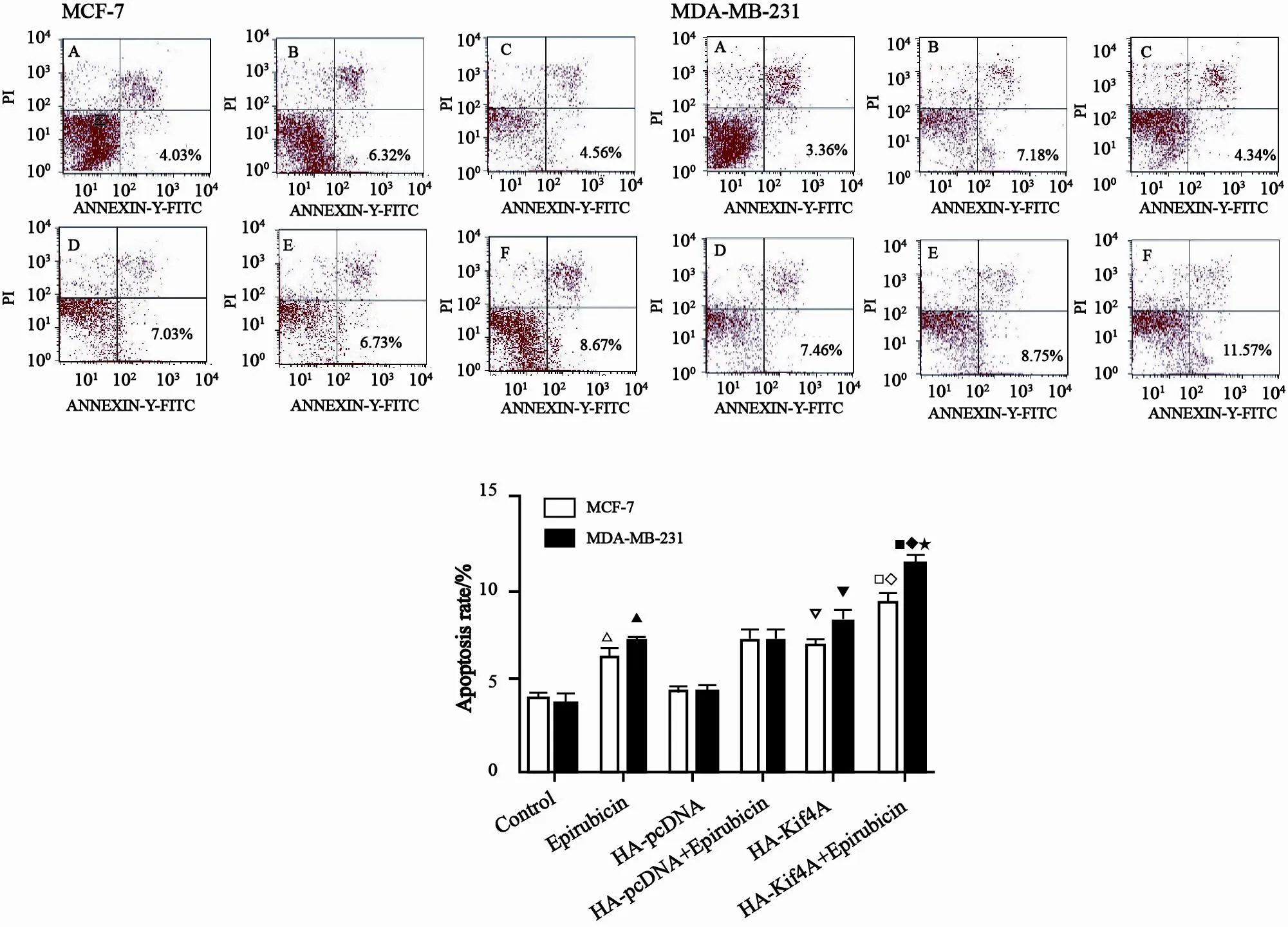
图 5 FCM法检测Kif4A高表达对多柔比星诱导MCF-7和MDA-MB-231细胞凋亡的影响Fig.5 The apoptosis of MCF-7 and MDA-MB-231 cells after transfected with HA-Kif4A plasmid and treated with 1 μmol/L epirubicin were detected by FCM
3 讨 论
多柔比星作为一种常用的乳腺癌化疗药物,在乳腺癌的治疗中起着重要作用,然而由其引起的化疗耐药也越来越多[3]。研究表明P-糖蛋白(permeability glycoprotein,P-gp)[4]、乳腺癌耐药蛋白(breast cancerresistance protein,BCRP)、耐药相关蛋白(multidrug resistance-associated proteins,MRPs)[5]、乳腺癌易感基因BRCA1(breast cancer associated 1,BRCA1)[6]、PARP-1[7]在癌症化疗耐药中都起重要作用。Nelson等[8]研究前列腺癌、乳腺癌和卵巢癌患者化疗干预后发现,在肿瘤附近的正常细胞(成纤维细胞)的DNA被化疗破坏时,也会向肿瘤微环境中释放一种称为WNT16B的蛋白,这种蛋白的高表达导致癌细胞生长、侵入附近组织并减弱了化疗药物在机体内的细胞毒性,促进肿瘤细胞存活、加速癌症病理过程。Daemen等[9]和Hiller等[10]研究结果显示,BRCA1突变的乳腺癌和(或)三阴性乳腺癌对PARP-1抑制剂治疗较多柔比星敏感,提示多柔比星处理后可能上调了PARP-1活性,增强了其损伤修复功能。Munoz-gamez等[2]在研究乳腺癌MDA-MB-231细胞时也发现,多柔比星处理后PARP-1活性能迅速上调,增强细胞损伤修复功能抑制MDA-MB-231细胞的凋亡。Midorikawa等[11]在研究大脑神经元发育中发现Kif4A可通过其羧基末端直接与PARP-1相结合,抑制PAPR-1的活性,介导神经元细胞的凋亡,提示Kif4A在调节PARP-1活性中起着重要作用。
Kif4A属于驱动蛋白(kinesin)超级家族,是以微管为轨道的分子马达(molecular motor)[12]。Kif4A蛋白含有N端保守的马达区(motor domain)、中间的卷曲螺旋颈区(neck region)和C端的尾区(tail domain)[13]。其马达区具有ATP酶活性,能通过水解ATP获得能量,改变构型,使Kif4A在以微管构成的轨道上进行滑行;而在Kif4A颈区,存在核定位信号(nuclear localization signal,NLS),使Kif4A能分布在细胞内和具有结合DNA的能力,这为Kif4A参与调节DNA损伤修复途径提供了可能;而Kif4A的尾区有一些分布规律的半胱氨酸,既可结合货物(cargo),进行细胞内物资运输,又可结合相关蛋白,调节DNA损伤修复途径,参与细胞有丝分裂过程中染色体的固缩、仿垂体的形成及分离等[14-15]。
PARP-1是存在于真核细胞中催化聚ADP核糖化的细胞核酶,其参与的聚ADP核糖化是真核细胞中蛋白质翻译后的重要修饰方式之一[16]。PARP-1的相对分子质量为113×103,其蛋白由6个结构域组成:其中Zn1、Zn2结构域中存在核定位信号(nuclear localization signal,NLS)和KRK-X(11)-KKKSKK序列,使其具有DNA结合能力,故Zn1、Zn2结构域也称为DNA结合结构域(DNA-binding domain,DBD);而BRCT结构域与WGR结构域之间有一个富含赖氨酸和谷氨酸的高度保守的聚ADP核糖基化[poly(ADP-ribose),PAR]结合位点,这为PARP-1催化结构域CAT介导PAR修饰提供了可能;Zn3是PARP-1中相对比较保守的结构域,其主要功能是与WGR结构域一同参与调节PAR修饰[17]。PARP-1可作为NF-kB和低氧诱导因子(hypoxia inducible factor,HIF1)的协同刺激因子调节基因转录,并且能与碱基切除修复因子(base excision repair,BER) 和X线修复交叉互补基因(X-ray repair cross-complementing,XRCC)结合,单链DNA损伤能诱导PARP-1、XRCC及固缩蛋白Ⅰ表达增加,上调PAR修饰,促进损伤DNA的修复[18-19]。
实验结果显示多柔比星作用后,乳腺癌MCF-7和MDA-MB-231细胞的Kif4A蛋白低表达,PARP-1活性上调。高表达Kif4A后,MCF-7和MDA-MB-231细胞PARP-1活性明显被抑制,而多柔比星能部分逆转由外源性Kif4A高表达引起的PARP-1活性抑制。
多柔比星是通过何种机制诱导Kif4A低表达目前还不清楚,根据实验结果推测至少有两种可能情况:①多柔比星抑制乳腺癌细胞Kif4A蛋白表达;②多柔比星杀死乳腺癌细胞中Kif4A高表达的细胞,使Kif4A呈现出低的检测水平。此外多柔比星并不影响外源性Kif4A蛋白的表达,提示多柔比星对Kif4A的影响可能是在翻译水平(可能是对启动子的影响)。
多柔比星能诱导乳腺癌细胞后凋亡,PARP-1抑制剂抑制其活性后,细胞凋亡进一步增加。此外,MDA-MB-231细胞对PARP-1抑制剂3-ABA作用较MCF-7敏感,原因可能与MDA-MB-231细胞存在BRCA1突变(MCF-7细胞BRCA1野生型)有关。BRCA1作为乳腺癌中重要的一个损失修复蛋白,在同源重组修复发挥重要作用。已有报道证实Kif4A可通过BRCA1-BRCA2途径参与DNA损伤修复[15],BRCA1的突变使该途径缺失,DNA损伤得不到有效修复,细胞凋亡增加。Kif4A的高表达抑制PARP-1的活性后,乳腺癌细胞凋亡,与MCF-7细胞相比,MDA-MB-231细胞凋亡明显;高表达Kif4A后,再用多柔比星处理细胞,细胞凋亡也进一步增加;原因也可能是Kif4A高表达后,PARP-1活性明显被抑制,由其介导的损伤修复途径失活,细胞凋亡增加,而多柔比星处理后,内源性Kif4A蛋白低表达,由其介导的另一条损伤修复途径Kif4A-BRCA1-BRCA1失活,使细胞进一步凋亡。然而PARP-1介导的损伤修复途径和BRCA1介导的损伤修复途径何者起主要作用有待进一步研究。
[1] GANGADHARAN C, THOH M, MANNA S K. Inhibition of constitutive activity of nuclear transcription factor kappaB sensitizes doxorubicin-resistant cells to apoptosis[J]. J Cell Biochem, 2009, 107(2): 203-213.
[2] MUNOZ-GAMEZ J A, MARTIN-OLIVA D, AGUILARQUESADA R, et al. PARP inhibition sensitizes p53-deficient breast cancer cells to doxorubicin-induced apoptosis[J]. Biochem J, 2005, 386(Pt 1): 119-125.
[3] 王世清, 刘武红. 中、晚期乳腺癌术前表阿霉素介入治疗的临床观察[J]. 中国癌症杂志, 2000, 10(6): 574-574.
[4] TSUJI K, WANG Y H, TAKANASHI M, et al. Overexpression of lung resistance-related protein and P-glycoprotein and response to induction chemotherapy in acute myelogenous leukemia[J]. Hematol Rep, 2012, 4(3): e18.
[5] LAINEY E, SEBERT M, THEPOT S, et al. Erlotinib antagonizes ABC transporters in acute myeloid leukemia. Cell Cycle, 2012, 11(21): 4079-4092.
[6] LE CALVEZ-KELM F, OLIVER J, DAMIOLA F, et al. RAD51 and breast cancer susceptibility: no evidence for rare variant association in the Breast Cancer Family Registry study[J]. PloS One, 2012, 7(12): e52374.
[7] LEE KRAUS W, HOTTIGER M O. PARP-1 and gene regulation: Progress and puzzles[J]. Mol Aspects Med, 2013, 34(6): 1109-1123.
[8] SUN Y, CAMPISI J, HIGANO C, et al. Treatment-induced damage to the tumor microenvironment promotes prostate cancer therapy resistance through WNT16B[J]. Nat Med, 2012, 18(9): 1359-1368.
[9] DAEMEN A, WOLF D M, KORKOLA J E, et al. Crossplatform pathway-based analysis identifies markers of response to the PARP inhibitor olaparib[J]. Breast Cancer Res Treat, 2012, 135(2): 505-517.
[10] HILLER D J, CHU Q D. Current Status of Poly(ADP-ribose) Polymerase Inhibitors as Novel Therapeutic Agents for Triple-Negative Breast Cancer[J]. Int J Breast Cancer, 2012, 2012: 829315.
[11] MIDORIKAWA R, TAKEI Y, HIROKAWA N. KIF4 motor regulates activity-dependent neuronal survival by suppressing PARP-1 enzymatic activity[J]. Cell, 2006, 125(2): 371-383.
[12] SAMEJIMA K, SAMEJIMA I, VAGNARELLI P, et al. Mitotic chromosomes are compacted laterally by KIF4 and condensin and axially by topoisomerase IIα[J]. J Cell Biol, 2012, 199(5): 755-770.
[13] WU G, CHEN P L. Structural requirements of chromokinesin Kif4A for its proper function in mitosis[J]. Biochem Biophys Res Commun, 2008, 372(3): 454-458.
[14] HU C K, COUGHLIN M, FIELD C M, et al. KIF4 regulates midzone length during cytokinesis[J]. Curr Biol: CB, 2011, 21(10): 815-824.
[15] WU G, ZHOU L, KHIDR L, et al. A novel role of the chromokinesin Kif4A in DNA damage response[J]. Cell Cycle, 2008, 7(13): 2013-2020.
[16] HUAMBACHANO O, HERRERA F, RANCOURT A, et al. Double-stranded DNA binding domain of poly(ADP-ribose) polymerase-1 and molecular insight into the regulation of its activity[J]. J Biol Chem, 2011, 286(9): 7149-7160.
[17] LANGELIER M F, PLANCK J L, ROY S, et al. Crystal structures of poly(ADP-ribose) polymerase-1 (PARP-1) zinc fingers bound to DNA: structural and functional insights into DNA-dependent PARP-1 activity[J]. J Biol Chem, 2011, 286(12): 10690-10701.
[18] ELSER M, BORSIG L, HASSA P O, et al. Poly(ADP-ribose) polymerase 1 promotes tumor cell survival by coactivating hypoxia-inducible factor-1-dependent gene expression[J]. Mol Cancer Res, 2008, 6(2): 282-290.
[19] KONG X, STEPHENS J, BALL A R Jr, et al. Condensin I recruitment to base damage-enriched DNA lesions is modulated by PARP1[J]. PloS One, 2011, 6(8): e23548.
Epirubicin up-regulates PARP-1 activity dependent on Kif4A low expression in breast cancer cells
WANG Hui, LU Chang-qing, TIAN Bo, LI Qing, CHEN Tong-bing (Department of Pathology, the Third Affiliated Hospital of Suzhou University, Changzhou Jiangsu 213003, China)
LU Chang-qing E-mail: 344575914@qq.com
Background and purpose: Chemotherapy is the important way of breast cancer treatment, but the drug-resistance has attracted special attention. The emergence of drug resistance is closely related to the abnormal enhancement of DNA-damage repair. Both Kif4A and PARP-1 are important molecules of DNA repair. The research investigated the function of Kif4A in epirubicin up-regulating the activity of PARP-1 in breast cancer cells and possible significance. Methods: Western blot was used to detect the expression of Kif4A and PARP-1 after treatment with epirubicin in MDA-MB-231 and MCF-7 cells; the expression of PARP-1 and its activity were detected after high expression of Kif4A and treatment with epirubicin; FCM was used to detect cell apoptosis after treatment with epirubicin combined with PARP-1 inhibitor 3-ABA. Results: Epirubicin up-regulated PARP-1 activity and induced low expression of Kif4A in breast cancer cells, both of them showed dose-dependent and time-dependent. After high expression of Kif4A, the activity of PARP-1 was inhibited and the apoptosis of cells increased, epirubicin partially reversed the activity of PARP-1 inhibited by high Kif4A expression. Both of epirubicin and 3-ABA induced cell apoptosis, combination of them further increased cell apoptosis compared with alone used (P<0.05). The results also showed the apoptosis rate of MDA-MB-231 cells induced by epirubicin, PARP-1 inhibitor 3-ABA and high expressionKif4A was higher than that of MCF-7 cells (P<0.05). Conclusion: Epirubicin increases the activity of PARP-1 dependent on the low expression of Kif4A in breast cancer cells. Kif4A might become a novel target for overcoming resistance of epirubicin.
Kif4A; PARP-1; Epirubicin; MCF-7 cell; MDA-MB-231 cell
10.3969/j.issn.1007-3969.2013.10.005
R737.9
:A
:1007-3639(2013)10-0804-09
2013-08-05
2013-09-30)
鲁常青 E-mail:344575914@qq.com
