宫颈癌细胞系RASSFIA基因启动子及第1外显子区甲基化状态的研究
2013-06-09汪姗姗王宁于啸2杨晨曦闫丽萍王言奎
汪姗姗王宁于啸,2杨晨曦闫丽萍王言奎
1.青岛大学医学院附属医院妇产科,山东 青岛266003;
2.青岛市妇女儿童医疗保健中心妇产科,山东 青岛266011
宫颈癌细胞系RASSFIA基因启动子及第1外显子区甲基化状态的研究
汪姗姗1王宁1于啸1,2杨晨曦1闫丽萍1王言奎1
1.青岛大学医学院附属医院妇产科,山东 青岛266003;
2.青岛市妇女儿童医疗保健中心妇产科,山东 青岛266011
背景与目的:抑癌基因Ras相关区域家族1A (Ras association domain family 1A,RASSF1A)启动子及第1外显子区CG位点高甲基化导致该基因沉默与多种恶性肿瘤的发生发展相关。本研究旨在探讨宫颈癌细胞系RASSFIA基因启动子及第1外显子区甲基化状态以及甲基化转移酶抑制剂5-氮杂-2’-脱氧胞苷(5-Aza-2’deoxycytidine,5-Aza-dc)作用对RASSFIA基因表达的影响。方法:采用5 µmol/L(低浓度)和10 µmol/L(高浓度)的5-Aza-dc作用于HeLa、Caski、HT-3以及C-33A等4种宫颈癌细胞系,分别采用甲基化特异PCR (methylation-specific PCR,MSP)和亚硫酸盐基因组测序法(bisulfite genome sequencing,BGS)检测5-Aza-dc处理前后RASSF1A基因启动子及第1外显子区甲基化状态,RT-PCR检测干预前后RASSF1A基因mRNA的转录表达。结果:HeLa和Caski两种HPV阳性细胞系RASSF1A基因启动子及第1外显子区均呈低甲基化状态,mRNA表达阳性。低浓度和高浓度5-Aza-dc作用后,mRNA表达未见明显改变(FHeLa=3.003,P=0.125;FCaski=0.045,P=0.956)。HT-3和C-33A两种HPV阴性宫颈癌细胞系RASSF1A基因启动子及第1外显子区则表现为高度甲基化状态,mRNA表达受到抑制。低浓度和高浓度5-Aza-dc作用后,HT-3和C-33A细胞系RASSF1A基因启动子及第1外显子区CG位点甲基化程度降低,检测到其mRNA表达,高浓度5-Aza-dc作用组表达水平明显高于低浓度组和细胞对照组(FHT-3=18.002,P=0.03;FC-33A=17.179,P=0.03),LSD-t检验显示差异有统计学意义(P<0.05)。结论:HPV阳性和HPV阴性宫颈癌细胞系中RASSFIA基因启动子及第1外显子区甲基化状态不同;RASSF1A基因启动子及第1外显子区的高甲基化可抑制该基因表达;5-Aza-dc处理可使RASSF1A基因启动子及第1外显子区去甲基化,重新激活基因的表达,这种作用在一定范围内有剂量依赖性。
Ras相关区域家族1A基因;人宫颈癌细胞系;5-氮杂-2’-脱氧胞苷;DNA甲基化;TA克隆
研究证实,人类肿瘤组织中存在着多种肿瘤抑制基因的高甲基化[1]。某些肿瘤抑制基因启动子区的高甲基化可沉默该基因的表达,导致该基因失活,进而参与肿瘤的发生。Ras相关区域家族1A (Ras association domain family 1A,RASSF1A)是2000年由Dammann等[2]利用酵母双杂交筛选从3号染色体短臂(3p21.3)克隆获取的新型肿瘤抑制基因(tumor suppressor gene,TSG),其表达产物具有调节细胞凋亡和细胞周期检查点的功能。有研究表明,RASSF1A表达缺失是人类肿瘤发生中的一个早期普遍事件[3]。胰腺癌、胃癌等多种人类肿瘤组织中可检测到RASSF1A启动子的异常高甲基化[4-5]。Kuzmin等[6]在10%的宫颈鳞状细胞癌、21%的宫颈腺鳞癌以及24%的宫颈腺癌组织中也发现RASSFIA基因启动子的高甲基化。
本研究选择4种宫颈癌细胞系作为研究对象,检测其RASSFIA基因启动子及第1外显子区CpG位点的甲基化状态,探讨HPV感染与RASSFIA基因启动子及第1外显子区甲基化状态的关系。分析甲基化转移酶抑制剂5-氮杂-2’-脱氧胞苷(5-Aza-2’deoxycytidine,5-Aza-dc)对RASSFIA基因启动子区甲基化逆转以及诱导RASSFIA基因重新表达的作用,明确高甲基化是否影响该基因的表达,为进一步筛选HPV相关宫颈癌表观遗传学分子标志提供实验依据。
1 材料和方法
1.1 细胞系
HPV18阳性宫颈癌细胞系HeLa及HPV阴性宫颈癌细胞系HT-3为青岛大学医学院微生物实验室保存,HPV16阳性宫颈癌细胞系Caski购自中国医学科学院肿瘤研究所,HPV阴性宫颈癌细胞系C-33A购自中国科学院上海生命科学研究院细胞资源中心。均用含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的高糖DMEM培养基(购自美国GIBCO公司),37 ℃、饱和湿度、CO2体积分数为5%的培养箱中传代培养。
1.2 5-Aza-dc处理
取3×105个/mL指数生长期上述4种宫颈癌细胞,于25 cm2细胞培养瓶过夜培养后,加5-Azadc(购自Sigma公司)处理,实验包括5 µmol/L(低浓度)和10 µmol/L(高浓度)。每24 h更换培养基,维持5-Aza-dc浓度;以不加5-Aza-dc处理组作为对照,培养5 d后收集各组细胞。
1.3 细胞DNA的亚硫酸盐修饰
胰蛋白酶消化收集上述各组细胞,PBS轻洗细胞3次后,离心收集细胞沉淀,酚-氯仿-异戊醇法常规提取细胞DNA,分别取各组细胞DNA 5 µg,参照文献[7]进行焦亚硫酸盐修饰。采用DNA 纯化试剂盒(Qiagen,Hilden,Germany)对修饰后的DNA进行脱盐纯化处理,用50 µL TE缓冲液洗脱经过脱盐纯化的DNA,室温下静置5 min,加3 mol/L的NaOH 5.56 µL,37 ℃水浴15 min,再加新鲜配制的9 mol/L NH4OAc (pH=7.0),3 mol/L NaOAc (pH=5.2) 使其脱磺化基团。50 µL TE洗脱最终纯化的DNA,置于-20 ℃冰箱保存备用。
1.4 甲基化特异PCR (methylation-specific PCR, MSP)
参照文献[8]设计合成检测RASSF1A基因启动子及第1外显子区甲基化状态的特异性引物(表1)。取亚硫酸盐修饰处理后的各组细胞DNA为模板,阴性对照为无菌纯水。取5 µL扩增产物于2%琼脂糖凝胶中电泳,凝胶成像系统观察并记录结果,每次实验进行3次重复验证。
1.5 亚硫酸盐基因组测序法(bisulfite genome sequencing, BGS)
引物采用Methy primer express v1.0软件设计,序列及反应条件见表1。反应体系包括:TaqHS (5 U/µL) 0.25 µL、10×PCR Buffer (含Mg2+) 5 µL、dNTPs (各2.5 mmol) 4 µL、上游及下游引物各(10 µmol) 1 µL、0.05 µg修饰后细胞DNA作为模板、去离子水加至50 µL。PCR产物于2%琼脂糖凝胶电泳,鉴定扩增结果。
1.6 TA克隆测序
凝胶成像系统长波紫外灯下自琼脂糖凝胶切取目的PCR产物,采用德国QIAGEN公司DNA纯化试剂盒回收纯化。将纯化产物进行TA克隆连接,PMD18-T载体试剂盒购自TakaRa公司,操作按试剂盒说明进行。连接产物转化感受态大肠杆菌后氨苄LB平板培养,至长出蓝白单克隆菌落。取微量白色菌落作为模板进行菌落PCR验证, 将阳性单克隆菌落接种至含有氨苄抗性LB 液体培养基培养,取5 mL菌液送北京华大基因测序。应用MegAlign (DNASTAR, Inc, Madison, WI)和ChromasLite软件(Technelysium Pty Ltd, Eden Prairie, MN)与基因组序列(NM号:170714)进行比对分析。
1.7 RT-PCR检测RASSFIA基因mRNA表达
TRIzol一步法提取各组细胞总RNA,采用Thermo公司的逆转录试剂盒合成cDNA,RTPCR检测5-Aza-dc作用组及对照组RASSFIA基因mRNA转录表达的差异。同时以管家基因葡萄糖磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参照。扩增用引物参照文献[8]合成(表2)。

表 1 MSP和BGS所用引物序列及反应条件Tab. 1 The primer sequences and reaction conditions of MSP and BGS

表2 RT-PCR引物序列及反应条件Tab. 2 The primer sequences and reaction conditions of RT-PCR
1.8 统计学处理
采用SPSS 18.0统计软件包对实验数据进行统计学分析,比较5-Aza-dc作用前后4种宫颈癌
细胞系中RASSFIA基因mRNA表达差异采用单因素方差分析,方差齐者组内比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 RASSFIA基因启动子及第1外显子区甲基化检测结果
MSP结果显示,2种HPV阳性宫颈癌细胞系HeLa和Caski中,细胞对照组、低浓度及高浓度5-Aza-dc处理组只出现U条带;而在2种HPV阴性宫颈癌细胞系HT-3和C-33A,细胞对照组只出现M条带,低浓度和高浓度5-Aza-dc作用后,2种细胞系均为M+U条带(图1A)。BGS扩增产物经2%琼脂糖凝胶电泳后可观察到704 bp的特异性目的片段(图1B)。

图 1 MSP和BGS检测4种宫颈癌细胞系5-Aza-dc作用前后RASSFIA基因甲基化电泳结果Fig. 1 The results of RASSFIA gene promoter and exon 1 methylation detected by MSP and BGS in cervical cancer cell lines
2.2 RASSFIA基因启动子及第1外显子CpG位点测序结果
将BGS产物进行TA克隆后,分别选取HeLa、Caski、HT-3及C-33A等4种宫颈癌细胞系各10个阳性克隆进行测序,检测RASSFIA基因启动子及第1外显子区64个CpG位点的甲基化状态。结果显示2种HPV阳性细胞系HeLa及Caski中,除个别位点发生甲基化外,其余位点均未发生甲基化;而2种HPV阴性宫颈癌细胞系HT-3及C-33A则表现为几乎所有位点的甲基化(图2A)。两种不同浓度5-Aza-dc作用于HT-3和C-33A细胞系后,甲基化程度降低(图2B)。截取HPV阴性HT-3细胞系5-Aza-dc作用前后部分序列测序信号结果,未见套峰及杂峰现象(图3),测序结果准确可靠。
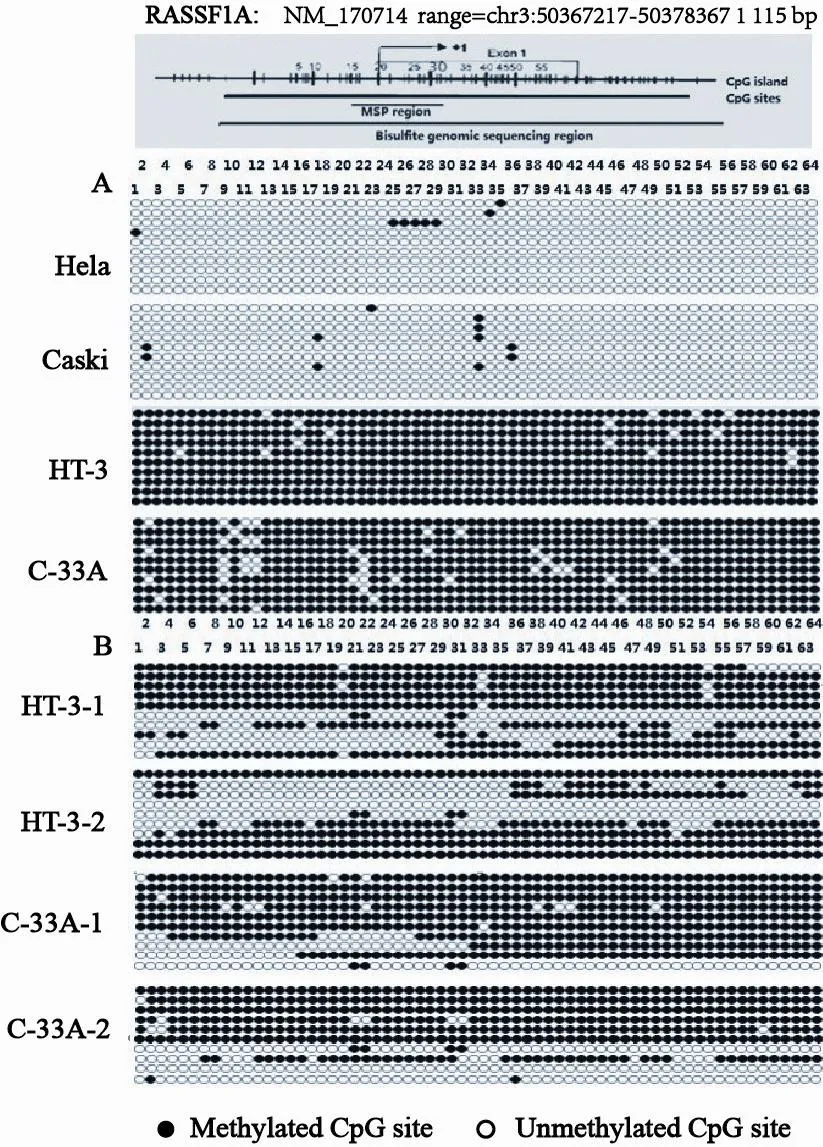
图 2 4种宫颈癌细胞系RASSFIA基因启动子及第1外显子区TA克隆测序结果Fig. 2 CpG methylation status of RASSFIA gene promoter and exon 1 detected by TA clone and BGS
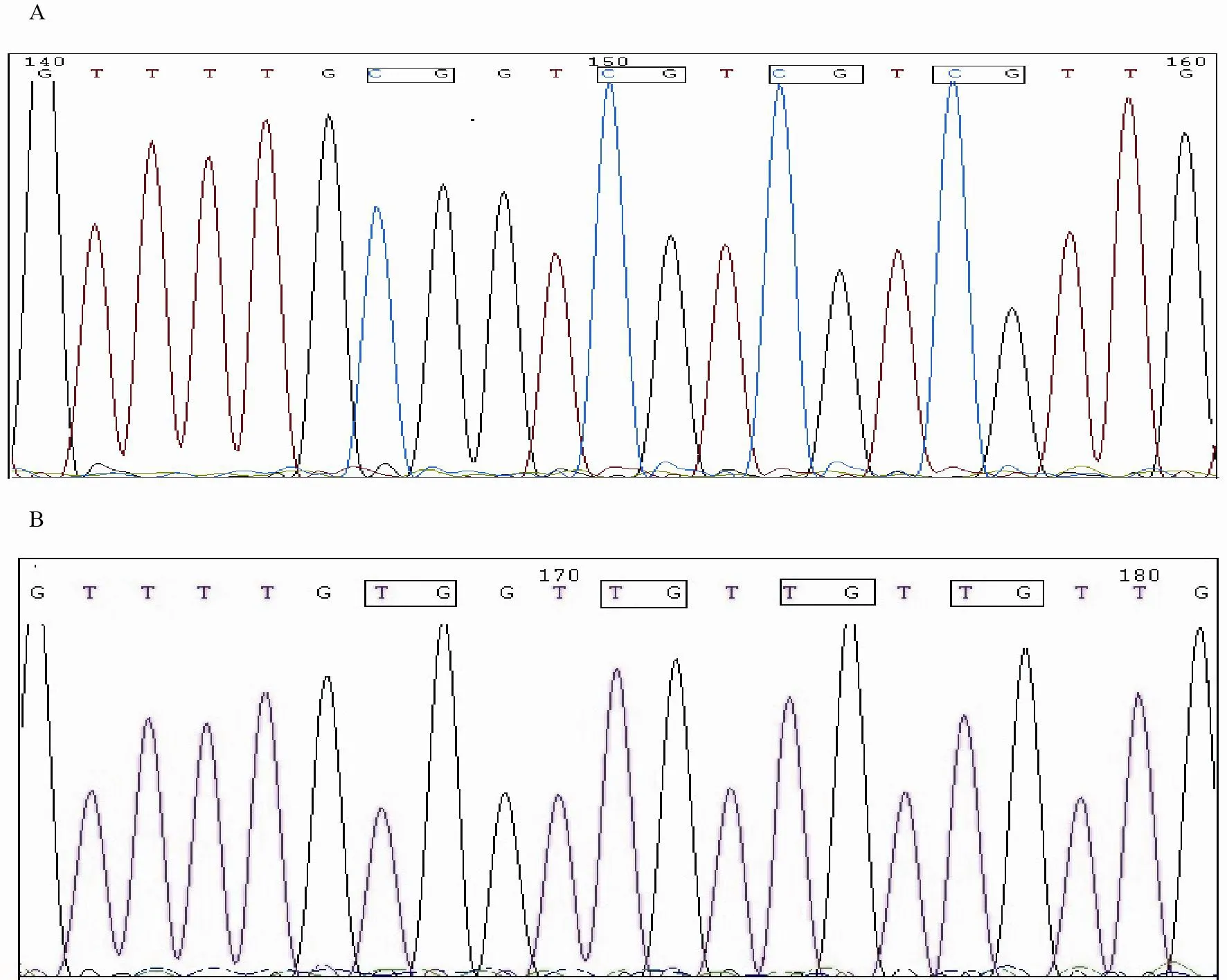
图 3 HPV阴性细胞系HT-3 RASSFIA基因启动子部分位点甲基化状态测序结果Fig. 3 Sequencing results of RASSFIA gene promoter and exon 1 in HT-3 cell line.
2.3 5-Aza-dc作用对RASSFIA基因mRNA转录表达的影响
RT-PCR检测结果显示,2种HPV阳性宫颈癌细胞5-Aza-dc处理前后均可检测到RASSFIA基因的表达(图4),经单因素方差分析,差异无统计学意义(FHeLa=3.003,P=0.125;FCaski=0.045,P=0.956)。而2种HPV阴性宫颈癌细胞系HT-3和C-33A在5-Aza-dc处理前RASSFIA基因表达缺失,2种不同浓度的5-Aza-dc处理后可以检测到RASSFIA基因重新表达,RASSFIA基因的转录表达随5-Aza-dc浓度升高而增强(FHT-3=18.002,P=0.03;FC-33A=17.179,P=0.03),经LSD-t检验呈剂量依赖性,差异有统计学意义(P<0.05,表3)。
3 讨 论
近年来研究发现异常表观遗传调控现象在恶性肿瘤的发生发展中更为重要,也更为普遍,其中DNA高甲基化的抑癌基因是人类癌症中最稳定的标志[9]。抑癌基因的高甲基化可导致其表达缺失,进而失去对肿瘤细胞生长的负性调控作用。DNA甲基化转移酶抑制剂5-Azadc是一种嘧啶核苷类似物,可与DNA甲基转移酶形成共价复合物而阻止DNA的甲基化,进而逆转某些基因启动子区域甲基化CpG位点,重新激活由于高甲基化而沉默的肿瘤抑制基因,恢复表达发挥其抗肿瘤作用[10-11]。
RASSFIA基因是Ras相关区域家族中最重要的成员,其启动子区域包含20个CpG位点,第1外显子区域含有44个CpG位点,编码产物由340个氨基酸组成,有与RAS蛋白结构相关的区域,可通过三磷酸鸟苷酸依赖的形式与RAS蛋白相互作用,诱导细胞衰老和凋亡。另外,RASSFIA 可在翻译水平上抑制细胞周期蛋白Cyclin D1的集聚,阻止细胞从G1期到S的转变,诱导细胞周期停滞,具有维持基因稳定、调节细胞周期、诱导细胞凋亡的作用[12]。
本研究结果显示2种HPV阴性细胞系中RASSFIA基因启动子及第1外显子区域CpG位点表现为高甲基化状态,RASSFIA基因不表达;5-Aza-dc作用后可以降低RASSFIA基因的甲基化水平,诱导该基因恢复表达,且高浓度作用组表达水平高于低浓度作用组。表明适当浓度的5-Aza-dc可通过干预抑癌基因RASSFIA高甲基化的调控序列,恢复其表达,进而导致细胞周期的阻滞,诱导细胞凋亡,RASSFIA基因表达沉默可能是由异常的表观遗传机制调控。在某些情况下DNA 甲基化是肿瘤抑制基因失活唯一机制,Paulsen等[13]研究发现,在肝细胞癌、卵巢癌、小细胞性肺癌等肿瘤细胞中,RASSF1A 基因启动子区CpG位点呈高甲基化,导致基因失活,表达沉默,提示RASSFIA基因启动子区高甲基化是频发事件。
本研究结果显示,2种HPV阳性细胞系RASSFIA基因启动子及第1外显子区未发生甲基化,可检测到RASSFIA基因的转录表达。Kuzmin等[6]采用亚硫酸氢钠结合限制性内切酶分析法(COBRA)分析了6种HPV阳性细胞系和2种HPV阴性细胞系,结果发现6种HPV阳性细胞系中RASSFIA基因启动子区均呈低甲基化状态;而2种HPV阴性细胞系则呈完全高甲基化状态,与本研究结果相符合。尽管6种HPV阳性细胞系RASSFIA基因启动子区均呈低甲基化状态,但不同细胞系RASSFIA基因表达水平有所不同,HPV16阳性(SiHa,CaSki)和HPV18阳性(HeLa,C-4I)细胞系其表达水平高于HPV39阳性(ME180)和HPV45阳性(MS751)细胞系。Dong等[14]对来源于头颈部鳞状细胞癌的7种细胞系和46例原发性癌组织中RASSFIA基因启动子区甲基化状态与高危型HPV感染之间的关系进行了研究,发现两者之间存在显著负相关(P=0.038)。而Yu等[15]和Cohen等[16]对宫颈癌组织中的相关研究却没有发现两者之间上述关系。因此,在RASSFIA基因灭活与HPV感染之间是否真正存在互斥的关系,仍需要大样本、多地区及多种族人群的深入研究。
Pronina等[17]采用半定量RT-PCR系统研究了肾脏、肺脏、卵巢、乳腺、直肠5个部位130例原发性上皮肿瘤及相应正常对照组织RASSFIA mRNA的表达,发现与正常上皮组织比较,肾细胞癌、乳腺癌、直肠癌、卵巢癌组织中RASSFIA mRNA的表达水平增高2~7倍,其中以肾细胞癌和卵巢癌组织更为明显;在鳞状细胞肺癌的早期临床阶段RASSFIA mRNA表达量增加,而在晚期临床阶段其表达量降低。表明RASSFIA基因表达具有肿瘤特异性,RASSFIA基因在肿瘤中可能具有双重功能,不仅是肿瘤抑制基因,在某些特定的条件下可能同时是致瘤基因。结论基于RASSFIA基因5个外显子在肺癌、宫颈癌、乳腺癌等癌组织中存在高频率的单碱基突变[18]。如经典的抑癌基因p53因为某些突变也会获得致瘤的特性[19]。肿瘤抑制基因RBSP3/CTDSPL在体外能够抑制肿瘤细胞生长和裸鼠体内肿瘤生长,但是由于某些突变,在原发性恶性肿瘤中也会检测到基因的mRNA表达水平较正常组织升高[18,20]。
本研究表明HPV阴性细胞系中RASSFIA基因的高甲基化可导致其表达沉默或表达下调,5-Aza-dc可逆转RASSFIA基因的高甲基化,使沉默的RASSFIA基因重新表达。在HPV阳性细胞系RASSFIA基因呈低甲基化,可检测到其mRNA的转录表达。高危型HPV感染与RASSFIA基因沉默的互斥关系目前仍无法解释,Kuzmin等[6]研究提示E6和E7蛋白可能不仅仅干扰Rb和p53相关的肿瘤抑制机制,也可能涉及Ras信号通路等其它基本的通路,进而影响RASSFIA蛋白的功能,使其丧失抑癌基因功能。而Kashuba等[18]研究提示HPV感染也可引起RASSFIA基因某些特定的碱基突变,导致其编码产物结构或功能改变而获得致瘤的功能。因此在不同类型宫颈癌肿瘤细胞中,RASSFIA基因可能存在不同的灭活途径,通过不同方式影响其编码产物的抑癌功能,HPV感染与RASSFIA基因表达在宫颈癌发生发展中的意义尚有待进一步研究。
[1] GUERROR-PRESTON R E, SIDRANSKY D, BREBIMIEVILLE P. Hypermethylation Biomarkers for Detection of Cervical Cancer. U.S. Patent 20,130,109,584 [P] . 2013-5-2.
[2] DAMMANN R, TAKAHASHI T, PFEIFER G P. The CpG island of the novel tumor suppressor gene RASSF1A is intensely methylated in primary small cell lung carcinomas[J]. Oncogene 2001, 20(27): 3563-3567.
[3] DAMMANN R, SCHAGDARSURENGIN U, SEIDEL C, et al. The tumor suppressor RASSF1A in human carcinogenesis: an update [J]. Histol Histopathol, 2005, 20(2): 645-663.
[4] KSIAA F, ZIADI S, AMARA K, KORBI S, et al. Biological significance of promoter hypermethylation of tumor-related genes in patients with gastric carcinoma [J] . Clin Chim Acta, 2009, 404(2): 128-133.
[5] MALPELI G, AMATO E, DANDREA M, et al. Methylationassociated down-regulation of RASSF1A and up-regulation of RASSF1C in pancreatic endocrine tumors [J] . BMC Cancer, 2011, 11(1): 351.
[6] KUZMIN I, LIU L, DAMMANN R, et al. Inactivation of RAS association domain family 1A gene in cervical carcinomas and the role of human papillomavirus infection [J] . Cancer Res, 2003, 63(8): 1888-1893.
[7] LIU X, TANG X, ZHANG S, et al. Methylation and expression of retinoblastoma and transforming growth factor-β1 genes in epstein-barr virus-associated and-negative gastric carcinoma[J]. Gastroenterol Res Pract, 2012, 2012: 906017.
[8] MUNOZ J, INDA MDEL M, LAZCOZ P, et al. Promoter methylation of RASSF1A associates to adult secondary glioblastomas and pediatric glioblastomas [J]. ISRN Neurol, 2012, 2012: 576-578.
[9] ESTELLER M. Relevance of DNA methylation in the management of cancer [J]. Lancet Oncol, 2003, 4(6): 351-358.
[10] HASSLER M R, KLISAROSKA A, KOLLMANN K, et al. Antineoplastic activity of the DNA methyltransferase inhibitor 5-aza-2’-deoxycytidine in anaplastic large cell lymphoma[J]. Biochimie, 2012, 94(11): 2297-2307.
[11] CHU S H, MA Y B, FENG D F, et al. Effect of 5-Aza-2’-deoxycytidine on SLC22A18 in glioma U251 cells [J]. Mol Med Rep, 2012, 5(1): 138-141.
[12] DONNINGER H, VOS M D, CLARK G J. The RASSF1A tumor suppressor [J] . J Cell Sci, 2007, 120(Pt 18): 3163-3172.
[13] PAULSEN M, FERGUSON-SMITH A C. DNA methylation in genomic imprinting, development, and disease [J]. J Pathol, 2001, 195(1): 97-110.
[14] DONG S M, SUN D I, BENOIT N E, et al. Epigenetic inactivation of RASSF1A in head and neck cancer [J]. Clin Cancer Res, 2003, 9(10): 3635-3640.
[15] YU M Y, TONG J H, CHAN P K, et al. Hypermethylation of the tumor suppressor gene RASSFIA and frequent concomitant loss of heterozygosity at 3p21 in cervical cancers [J]. Int J Cancer, 2003, 105(2): 204-209.
[16] COHEN Y, SINGER G, LAVIE O, et al. The RASSF1A tumor suppressor gene is commonly inactivated in adenocarcinoma of the uterine cervix [J]. Clin Cancer Res, 2003, 9(8): 2981-2984.
[17] PRONINA I V, LOGINOV V I, KHODYREV D S, et al. RASSF1A expression level in primary epithelial tumors of various locations [J]. Mol Biol, 2012, 46(2): 236-243.
[18] KASHUBA V I, PAVLOVA T V, GRIGORIEVA E V, et al. High mutability of the tumor suppressor genes RASSF1 and RBSP3 (CTDSPL) in cancer [J] . PLoS One, 2009, 4(5): e5231.
[19] JENKINS J R, RUDGE K, CHUMAKOV P, et al.The cellular oncogene p53 can be activated by mutagenesis [J]. Nature, 1985, 317(6040): 816–818.
[20] KASHUBA V I, Li J, WANG F, et al. RBSP3 (HYA22) is a tumor suppressor gene implicated in major epithelial malignancies [J]. Proc Natl Acad Sci U S A, 2004, 101(14): 4906-4911.
Study on methylation status of RASSFIA gene promoter and exon 1 in cervical cancer cell lines
WANG Shan-shan1, WANG Ning1, YU Xiao1,2, YANG Chen-xi1, YAN Li-ping1, WANG Yan-kui1(1. Department of Obstetrics and Gynecology, Affiliate Hospital of Qingdao University Medical College, Qingdao Shandong 266003, China; 2. Department of Obstetrics and Gynecology, Qingdao Women and Children Medical Healthcare Center, Qingdao Shandong 266011, China)
WANG Yan-kui E-mail: qdwangyk@hotmail.com
Background and purpose: Loss or altered expression of Ras association domain family 1A gene (RASSF1A) through DNA methylation has been associated with the pathogenesis of a variety of cancers, which suggests the tumor suppressor function of this gene. This study aimed to explore the effect of DNA methyltransferase inhibitor 5-Aza-2’deoxycytidine (5-Aza-dc) on demethylation and expression of RASSF1A in cervical cancer cell lines. Methods: HPV positive cervical cancer cell lines HeLa and Caski, HPV negative cell lines HT-3 and C-33A were treated with two different concentration of 5-Aza-dc (5 µmol/L, 10 µmol/L). MSP (methylation-specific PCR) and Bisulfite genomic sequencing PCR (BGS) combined with TA clone were used to investigate methylation status of RASSF1A gene promoter and exon 1 before and after treatment of 5-Aza-dc. RASSF1A gene mRNA expressionwas detected by RT-PCR. Results: Two HPV positive cell lines showed hypomethylated RASSF1A promoters and expressed RASSF1A mRNA, and after treatment with 5-Aza-dc, the mRNA expression of RASSF1A did not change significantly (FHeLa=3.003, P=0.125; FCaski=0.045, P=0.956). Two HPV negative cervical cancer cell lines showed hypermethylation status of RASSF1A promoter and silenced RASSF1A. After treatment with 5-Aza-dc, demethylation occurred in the promoter region of RASSF1A gene, which subsequently induced re-expression of this gene in HT-3 and C-33A. The F test (FHT-3=18.002, P=0.03; FC-33A=17.179, P=0.03) and LSD-t test (P<0.05) demonstrated that significant difference in the expression of RASSF1A was found upon two different concentrations drug treatment.Conclusion: The methylation status of promoter and exon 1 of RASSFIA gene in HPV positive and HPV negative cervical cancer cell lines are different. The promoter hypermethylation is correlated with RASSF1A gene expression in HPV negative cervical cancer cell line HT-3 and C-33A, and plays a key role in RASSF1A silencing. 5-Aza-dc may effectively reverse the methylation status of RASSFIA gene promoter in cervical cancer HT-3 and C-33A cells and reactivate gene expression silenced by aberrant hypermethylation in a dose-dependent manner within certain extent.
Ras association domain family 1A (RASSF1A); Human cervical cancer cell line; 5-Aza-2-deoxycytidine; DNA methylation; TA clone
10.3969/j.issn.1007-3969.2013.10.001
R737.33
:A
:1007-3639(2013)10-0777-07
2013-07-22
2013-10-08)
国家自然科学基金(No:81172480)。
王言奎 E-mail:qdwangyk@hotmail. com
