早期宫颈癌组织中VEGF-C与COX-2的表达及相关性!
2013-05-16石小燕张亚东赵良平毛晓露张庆华
石小燕, 张亚东, 赵良平, 毛晓露, 张庆华△
华中科技大学同济医学院附属武汉中心医院 1中心实验室,2妇产科,3检验科,武汉 430014
宫颈癌是女性最常见的癌症之一,淋巴系统是宫颈癌细胞发生浸润和转移的一个主要途径。临床研究揭示肿瘤细胞的淋巴管浸润和继而形成的淋巴结转移直接影响着癌症患者的预后。最近,血管内皮生长因子-C(vascular endothelial growth factor-C,VEGF-C),作为血管内皮生长因子家族的一个新成员已被证实在调节肿瘤生长和转移中扮演重要角色。VEGF-C已在多种成人组织包括大多数重要的人类肿瘤中被检测到,原发肿瘤过表达VEGF-C与肿瘤细胞播散到区域淋巴结增加有关,其中包括食管癌、鼻咽癌、乳腺癌和宫颈癌等[1-4]。
另一 方 面,环 氧 合 酶-2(cyclooxygenase-2,COX-2),一种介导细胞多种生理功能的多效酶,可能通过介导与影响细胞有丝分裂、细胞粘附和免疫监视等有关的病理过程而促进癌发生、肿瘤增殖及癌细胞播散[5]。因此,COX-2过表达可用于预测包括宫颈癌在内的多种肿瘤细胞的侵袭力和转移潜能[6-7]。业已观察到在许多人类肿瘤中 COX-2和VEGF-C表达呈正相关[8-9]。新近研究表明 COX-2特异性抑制剂NS398能够降低VEGF-C表达,且荷SAS-LM3细胞种植瘤的裸鼠喂服NS398后,该裸鼠体内肿瘤淋巴管生成和淋巴结转移均受到抑制[10]。
本研究的目的是检测VEGF-C和COX-2在宫颈癌组织中的表达情况,探讨二者表达之间的关系及在宫颈癌发生发展、淋巴结转移中的作用。
1 材料与方法
1.1 临床资料
收集我院2005~2009年手术切除的宫颈癌组织标本57例。患者年龄27~69岁,平均42.4岁。其中宫颈原位癌12例,宫颈早期浸润癌45例。伴淋巴结转移26例,无淋巴结转移31例。45例早期浸润癌中,Ⅰa期5例,Ⅰb期20例,Ⅱa期10例,Ⅱb期10例;鳞癌40例,腺鳞癌3例,腺癌2例。
1.2 主要试剂
兔抗人 VEGF-C(H-190)多克隆抗体购于Santa Cruz公司。兔抗人COX-2多克隆抗体及其特异性抑制剂NS398(70590)购于Cayman Chemical公司。
1.3 免疫组化染色及判定标准
将经甲醛固定、石蜡包埋的宫颈组织标本制成4μm厚切片,采用SP免疫组化染色,具体实验步骤按照试剂盒说明书进行(武汉博士德生物工程有限公司)。以已知阳性乳腺癌组织作为阳性对照,以PBS缓冲液代替一抗作阴性对照。
VEGF-C和COX-2阳性细胞为胞质棕褐色颗粒沉着细胞。每张切片随机计数5个视野,共计1 000~1 500个肿瘤细胞中的阳性细胞。计算阳性细胞百分比=阳性细胞数/计数肿瘤细胞总数×100%。如果切片中VEGF-C和COX-2阳性反应分布≥10%,则该标本归为阳性染色;无染色或阳性细胞百分比<10%为阴性(-)。依据阳性细胞百分比,VEGF-C阳性染色细胞占细胞总数的10%~30%为弱阳性(+)、31%~50%为中等阳性(■)、50%以上为强阳性(■)。
1.4 细胞培养与处理
宫颈癌 HeLa细胞(ATCC,Manassas,VA)加入含10%小牛血清,50U/mL青霉素和50U/mL链霉素的RPMI1640培养液中,置于含95%空气、5%CO2及饱和湿度的37℃培养箱中孵育。细胞生长接近90%融合时,实验组将培养液更换为不含血清的RPMI1640新鲜培养液并加入COX-2特异性抑制剂NS398处理细胞,培养液中NS398的作用浓度分别为30、60、90μg/mL。对照组仅将培养液更换为不含血清的RPMI1640培养液。继续培养24h后,收获细胞,提取细胞总蛋白。
1.5 Western blot检测处理后细胞内VEGF-C蛋白表达变化
取50μg蛋白质样品进行SDS-PAGE电泳,转至硝酸纤维素膜上;室温封闭2h后,用含0.05%Tween 20的TBS缓冲液(TBST)漂洗3次,每次10min;加入 VEGF-C抗体(1∶500),4℃孵育过夜,TBST漂洗3次后加入相应的辣根过氧化物酶标记的二抗(1∶5 000),37℃摇床温育2h,最后经ECL系统曝光显影,凝胶分析系统分析蛋白表达。以β-actin水平作为等量蛋白质上样对照。
1.6 统计学分析
两组间数据的比较采用配对t检验,多组间数据的比较采用单因素方差分析,VEGF-C和COX-2表达的相关性分析应用Pearson相关分析。统计学分析应用SPSS 13.0统计软件进行处理,以P<0.05为差异有统计学意义。
2 结果
2.1 免疫组织化学检测
57例宫颈癌标本中,VEGF-C表达阴性(-)7例(12.28%),弱阳性(+)14例(24.56%),中等阳性 (■)20 例 (35.09%),强 阳 性 (■)16 例(28.07%)。COX-2表达阴性(-)38例(66.67%),阳性(+)19例(33.33%)。VEGF-C 和 COX-2阳性染色均位于肿瘤细胞的胞质,二者在癌巢中强表达。VEGF-C和COX-2免疫组织化学反应数据见表1,其对应的免疫组织化学反应图片见图1。统计分析表明VEGF-C与COX-2表达之间存在明显的相关性(P<0.01),见表2。VEGF-C表达与淋巴结转移密切相关,相关系数为r=0.376,P=0.011,然而,未发现COX-2表达与淋巴结转移之间有明显的相关性(P>0.05),见表3。
2.2 Western blot检测VEGF-C蛋白表达变化
当用不同浓度的COX-2特异性抑制剂NS398(0~90μg/mL)处理HeLa细胞24h后,细胞中VEGFC蛋白表达明显降低,且呈剂量依赖性(图2)。

表1 早期宫颈癌组织中VEGF-C及COX-2的表达Table 1 The expression of VEGF-C and COX-2in early-stage cervical cancer
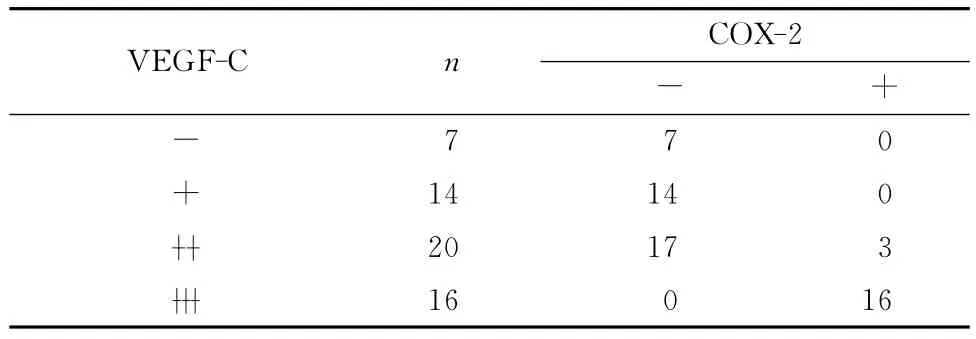
表2 早期宫颈癌组织中VEGF-C与COX-2表达的关系Table 2 The relationship between VEGF-C and COX-2 expression in early-stage cervical cancer
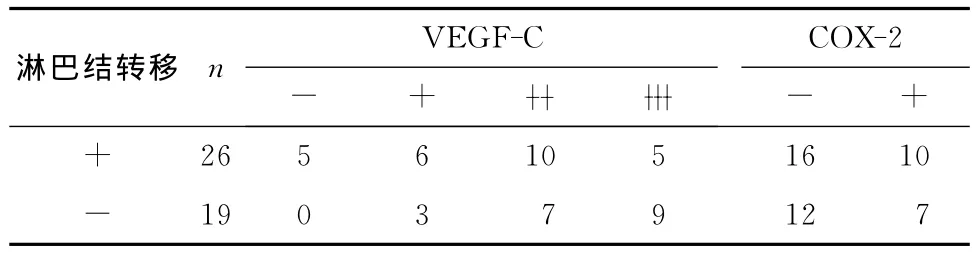
表3 VEGF-C、COX-2表达与宫颈早期浸润癌淋巴结转移的关系Table 3 The relationship between lymph node metastasis and VEGF-C and COX-2expression in early invasive cervical carcinoma
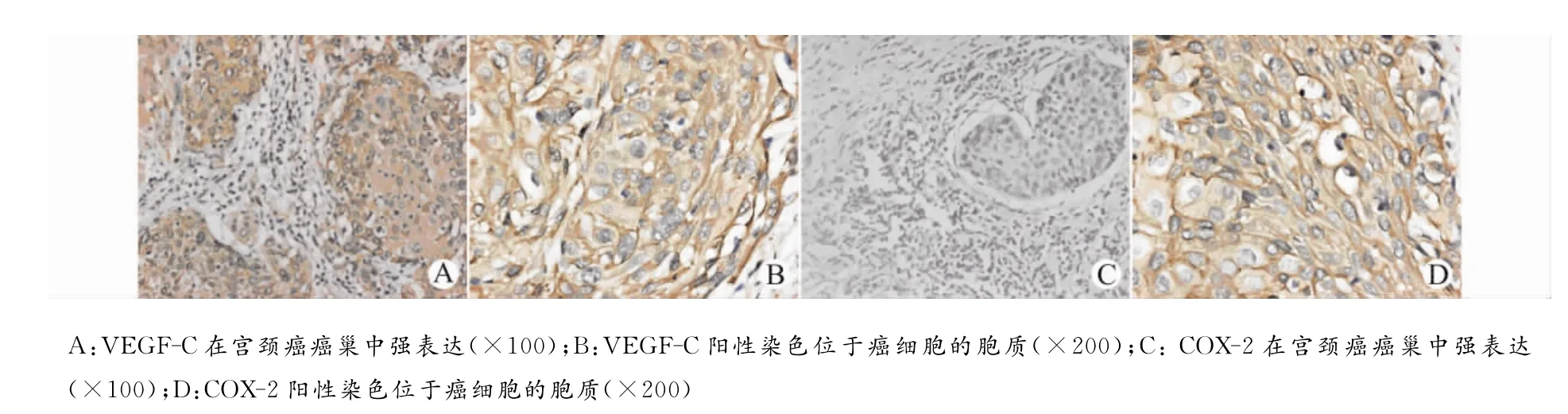
图1 VEGF-C和COX-2在早期宫颈癌组织中的表达Fig.1 The expression of VEGF-C and COX-2in early-stage cervical cancer
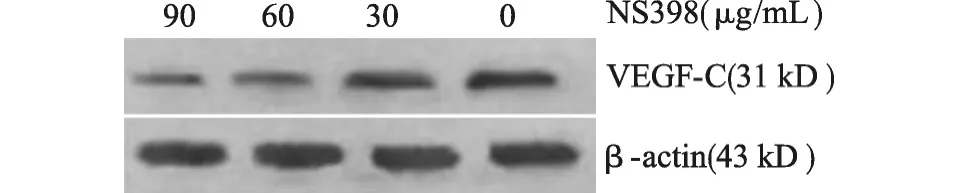
图2 Western blot检测COX-2特异性抑制剂NS398处理24h后HeLa细胞中VEGF-C蛋白的表达Fig.2 Western blot analysis of the expression of VEGF-C protein in HeLa cells treated with COX-2-specific inhibitor NS398 for 24h
3 讨论
多个研究发现,VEGF-C与恶性肿瘤的淋巴管生成密切相关,导致原发肿瘤进展、淋巴结转移、远处转移并最终影响患者的预后[1-4]。本研究发现VEGF-C主要表达于宫颈癌细胞的胞质,并在癌巢中强表达。且随着病变由原位癌到早期浸润癌的进展,VEGF-C表达明显增强,差异具有统计学意义,这与我们前期的研究结果一致[4],提示VEGF-C可能在宫颈癌癌变过程中起一定的促进作用。Hashimoto等[11]发现在盆腔淋巴结转移患者中VEGF-C表达显著增高,有盆腔淋巴结转移者的VEGF-C mRNA水平也显著增高,且VEGF-C mRNA表达者的预后较不表达者差,经多变量分析显示VEGFC表达促进宫颈癌淋巴结转移,VEGF-C mRNA是影响盆腔淋巴结转移的独立因素。本研究显示,26例淋巴结转移患者中21例VEGF-C表达阳性,且VEGF-C表达与淋巴结转移之间具有相关性(P<0.05)。因此,我们推测检测活检标本中VEGF-C表达情况可能有助于预测盆腔淋巴结转移。
临床研究表明COX-2是宫颈癌患者的一个预后因素。据报道,COX-2在宫颈鳞癌中表达阳性率是24%~28%,且它在宫颈腺癌中表达明显高于宫颈鳞癌(57%vs.24%)[12]。我们的结果显示 COX-2在宫颈癌中表达阳性率是33.33%,与文献报道的基本一致。近年,有报道在多种人类肿瘤中COX-2和VEGF-C表达呈正相关,二者与肿瘤的发生发展密切相关,且共同过表达VEGF-C和COX-2是评估癌症患者预后的一个独立因素[8-9]。本研究发现VEGF-C和 COX-2均在癌巢中强表达,且 COX-2在宫颈癌组织中的表达强弱与VEGF-C的表达是一致的,统计分析表明二者表达之间密切相关。有研究表明COX-2通过上调VEGF-C表达而促进肿瘤的淋巴管生成[9-10]。Su等[13]用cDNA 微阵列技术发现VEGF-C是COX-2下游的一个主要基因,而且他们在人肺腺癌细胞中进一步论证了COX-2可 通 过 EP1/Src/HER-2/Neu 信 号 旁 路 上 调VEGF-C表达。而用 COX-2的特异性抑制剂NS398处理肿瘤细胞可导致内源性VEGF-C表达水平明显下降[10,14]。这提示 COX-2可能是恶性肿瘤中VEGF-C表达的一个调节因子。本研究中,我们用COX-2的特异性抑制剂NS398处理宫颈癌细胞后,发现其VEGF-C表达明显降低,且呈剂量依赖性。说明宫颈癌细胞中VEGF-C表达可能受COX-2基因的调控,同时也提示VEGF-C介导的肿瘤转移有可能通过靶向作用于COX-2得以抑制。
综上所述,我们的结果显示VEGF-C可能在宫颈癌癌变过程中起一定的促进作用,VEGF-C表达与宫颈癌细胞的淋巴结转移密切相关,检测活检标本VEGF-C表达情况可能有助于预测盆腔淋巴结转移。在宫颈癌组织中,VEGF-C和COX-2表达之间具有明显的相关性,COX-2可能是宫颈癌细胞中VEGF-C表达的一个调节者。本研究可能为寻找新的抑制VEGF-C介导的肿瘤生长和转移方法奠定了基础,并为预测宫颈癌患者预后提供了新依据。
[1] Duan L,Ye L,Zhao G,et al.Serum spleen tyrosine kinase and vascular endothelial growth factor-C levels predict lymph node metastasis of oesophageal squamous cell carcinoma[J].Eur J Cardiothorac Surg,2013,43(3):58-63..
[2] Wakisaka N,Hirota K,Kondo S,et al.Induction of lymphangiogenesis through vascular endothelial growth factor-C/vascular endothelial growth factor receptor 3axis and its correlation with lymph node metastasis in nasopharyngeal carcinoma[J].Oral Oncol,2012,48(8):703-708.
[3] Acs G Paragh G,Rakosy Z,et al.The extent of retraction clefts correlates with lymphatic vessel density and VEGF-C expression and predicts nodal metastasis and poor prognosis in early-stage breast carcinoma[J].Mod Pathol,2012,25(2):163-177.
[4] Shi X Y,Xi L,Weng D H,et al.Clinicopathological significance of VEGF-C,VEGFR-3and cyclooxygenase-2in earlystage cervical cancer[J].IJBS,2008,4(1):58-63.
[5] Smith W L,DeWitt D L,Garavito R M.Cyclooxygenases:structural,cellular,and molecular biology[J].Annu Rev Biochem,2000,69(1):145-182 .
[6] Xin X,Majumder M,Girish G V,et al.Targeting COX-2and EP4to control tumor growth,angiogenesis,lymphangiogenesis and metastasis to the lungs and lymph nodes in a breast cancer model[J].Lab Invest,2012,92(8):1115-1128.
[7] Iwata C,Kano M R,Komuro A,et al.Inhibition of cyclooxygenase-2suppresses lymph node metastasis via reduction of lymphangiogenesis[J].Cancer Res,2007,67(21):10181-10189.
[8] Gou H F,Chen X C,Zhu J,et al.Expressions of COX-2and VEGF-C in gastric cancer:correlations with lymphangiogenesis and prognostic implications[J].J Exp Clin Cancer Res,2011,30:14-21.
[9] Rabindra N B,Alexander V T,Jing C,et al.Relationship between cyclooxygenase-2and human epidermal growth factor receptor 2in vascular endothelial growth factor C up-regulation and lymphangiogenesis in human breast cancer[J].Cancer Sci,2010,101(9):2026-2032.
[10] Morita Y,Hata K,Nakanishi M,et al.Cyclooxygenase-2promotes tumor lymphangiogenesis and lymph node metastasis in oral squamous cell carcinoma[J].Int J Oncol,2012,41(3):885-892.
[11] Hashimoto I,Kodama J,Seki N,et al.Vascular endothelial growth factor-C expression and its relationship to pelvic lymph node status in invasive cervical cancer[J].Br J Cancer,2001,85(1):93-97.
[12] Kim Y B,Kim G E,Pyo H R,et al.Differential cyclooxygenase-2expression in squamous cell carcinoma and adenocarcinoma of the uterine cervix[J].Int J Radiat Oncol Biol Phys,2004,60(3):822-829.
[13] Su J L,Shih J Y,Yen M L,et al.Cyclooxygenase-2induces EP1and HER-2/Neu-dependent vascular endothelial growth factor-C up-regulation:A novel Mechanism of lymphangiogenesis in lung adenocarcinoma[J].Cancer Res,2004,64(2):554-564.
[14] Shi X,Chen G,Xing H,et al.VEGF-C,VEGFR-3and COX-2 enhances growth and metastasis of human cervical carcinoma cell linesinvitro[J].Oncol Rep,2007,18(1):241-247.
