病毒巨噬细胞炎性蛋白Ⅱ-N端肽联合三氧化二砷对乳腺癌生长和转移的抑制作用*!
2013-05-16陈素莲郭玉红李自岩杨清玲陈昌杰
陈素莲, 郭玉红, 童 芳, 李自岩, 张 枫, 杨清玲△, 陈昌杰
蚌埠医学院1生化与分子生物学教研室,2生物科学系,3临床检验诊断学实验中心,蚌埠 233000
2008年GLOBOCAN对约1 270万癌症病例和760万癌症死亡者进行了评估,乳腺癌在女性中发病率高,为女性癌症死亡的主要因素,占所有女性癌症病例的23%和癌症死亡病例的14%。乳腺癌患者的死亡绝大多数是由远处转移引起,SDF-1α/CXCR4轴与肿瘤的转移存在着密切的关系,因而通过阻断SDF-1α/CXCR4相互作用来治疗转移性乳腺癌已成为新的治疗理念[1]。病毒巨噬细胞炎性蛋白-Ⅱ(viral macrophage inflammatory protein-Ⅱ,vMIP-Ⅱ)是由人疱疹病毒8型 K4基因编码,vMIP-Ⅱ与趋化因子受体CXCR4受体结合的活性位点主要位于vMIP-ⅡN末端的非结构域[2]。我们前期通过固相合成技术合成了vMIP-ⅡN末端21个氨基酸残基的小分子肽,命名为NT21MP。研究证实NT21MP可抑制肿瘤生长及肺转移[3]。三氧化二砷(As2O3)是传统中药成分之一,已经成功应用于急性早幼粒细胞白血病(APL)的治疗[4],目前发现As2O3对其他恶性肿瘤和一些实体瘤,包括乳腺癌有潜在的治疗价值[5]。As2O3可能通过诱导细胞周期阻滞和促进凋亡而抑制肿瘤细胞增殖[6]。本研究旨在观察联合应用NT21MP和As2O3对乳腺癌生长和转移的抑制效应。
1 材料与方法
1.1 材料
6~8周龄BALB/c雌性健康小鼠24只,体重15~20g,购自上海斯莱克实验动物责任有限公司(SPF级);小鼠乳腺癌细胞株4T-1为本实验室保存;CXCR4抑制性多肽(NT21MP)由上海吉尔生化有限公司合成;As2O3购自Sigma公司;TUNEL凋亡试剂盒购自武汉博士德公司;增殖细胞核抗原(PCNA)免疫组化试剂盒 (SP法)及DAB显色剂购自北京中山生物有限公司。
1.2 方法
1.2.1 构建乳腺癌小鼠模型 胰酶消化乳腺癌细胞株4T-1,调整密度为1×107个/mL,沿小鼠右侧第2乳垫下注射0.1mL[3]。
1.2.2 实验动物分组及用药 实验动物分为4组:生理盐水对照组(阴性对照),NT21MP(50μg/kg)组,As2O3(6mg/kg)组,联合用药组(NT21MP 50 μg/kg+ As2O36mg/kg),每组6只小鼠。用药方法:种瘤24h后,NT21MP尾静脉注射,每天1次,每5d停药2d;As2O3腹腔注射,每天1次,连续给药10d后改为隔天1次,均连续给药4周。其中每组3只小鼠肿瘤组织用于肿瘤大小的检测,3只小鼠肿瘤组织用于PCNA和凋亡检测;每组3只小鼠肺组织用于肺结节计数,3只小鼠肺组织用于苏木精-伊红(HE)染色。
1.2.3 瘤重测定及抑瘤率计算 给药4周后处死小鼠,从胸部皮下完整剥取肿瘤组织,除纤维包膜,在电子天平上称取瘤重(T),按公式计算肿瘤生长抑制率。抑瘤率(%)= (对照组瘤重-实验组瘤重)/对照组瘤重×100%。
1.2.4 肺结节计数 分离小鼠肺脏,将肺脏置于Bouin液(饱和苦味酸75mL+4%多聚甲醛25mL+冰醋酸5mL)中固定24~48h,取出肉眼观察,肺组织呈黄色,肿瘤转移灶呈白色。
1.2.5 苏木精-伊红染色观察小鼠肺转移情况 石蜡包埋标本,4μm连续切片,常规脱蜡至水后苏木精染色5min,1%盐酸乙醇分化数秒,温水蓝化1 min,伊红复染2min,脱水、透明、封片,镜下观察。
1.2.6 免疫组化检测小鼠肿瘤原发灶PCNA的表达 采用免疫组织化学SP染色法检测,操作按试剂盒说明书进行。PCNA阳性细胞胞核呈棕黄色,在癌组织中随机选5个高倍视野(×400),由2名有经验的病理医师双盲法进行PCNA阳性细胞计数,1 000个细胞中阳性细胞所占的百分比为PCNA标记指数(the PCNA labeling index,PCNA LI)。
1.2.7 TUNEL法检测小鼠肿瘤原发灶的细胞凋亡 取小鼠乳腺癌原发灶组织的病理切片,按末端转移酶介导的缺口标记法(TUNEL法)检测。所有石蜡包埋标本常规脱蜡,用新配制的4%多聚甲醛室温固定30min,0.01mol/L PBS洗片后与0.3%H2O2甲醇溶液室温孵育 30min,0.01mol/L PBS洗片,0.1%Triton-X 100冰上孵育 2min。0.01 mmol/L PBS洗片2次,滴加50μL的TUNEL反应混合液,湿盒中37℃孵育60min,苏木精复染,镜下检测结果。以胞核染紫蓝色为阳性反应细胞。每例标本随机取5个高倍视野(×400),计数凋亡细胞数,并计算凋亡指数(AI),AI=(凋亡细胞数/总细胞数)×100%。
1.3 统计学方法
数据以±s表示,采用SPSS 10.1软件对数据进行方差分析和q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 As2O3和NT21MP对荷乳腺癌小鼠原发瘤生长的抑制作用
与生理盐水处理的荷瘤小鼠比较,As2O3和NT21MP均可抑制原发肿瘤的生长,联合用药较单独用药作用明显(P<0.05)。As2O3、NT21MP和As2O3+ NT21MP组抑瘤率分别为40.0%、30.4%和54.4%(表1),荷乳腺癌小鼠原发肿瘤大小见图1。
2.2 As2O3和NT21MP对荷乳腺癌小鼠肺转移的抑制作用
将分离的肺脏在Bouin液中固定24h后观察肺表面转移结节,生理盐水对照组肺脏表面可以见到多个散在的,并且体积较大的白色肿瘤转移结节;As2O3组小鼠肺表面可见散在的、小的单个肿瘤转移结节;NT21MP组仅见个别小结节;NT21MP+As2O3组小鼠肺表面肉眼没有看到明显的转移结节形成。肺组织苏木精-伊红染色光镜下可见,各组的小鼠肺内形成不同程度的肿瘤转移病灶。生理盐水对照组各动物肺内均见转移性Lewis肺癌瘤灶,瘤灶范围广、数量多,有围绕血管生长现象,偶见血管壁破坏;NT21MP组和As2O3组见转移性Lewis肺癌瘤灶,但范围小、数量少,未见围绕血管生长现象;NT21MP+As2O3组未见明显的转移灶形成(图2)。
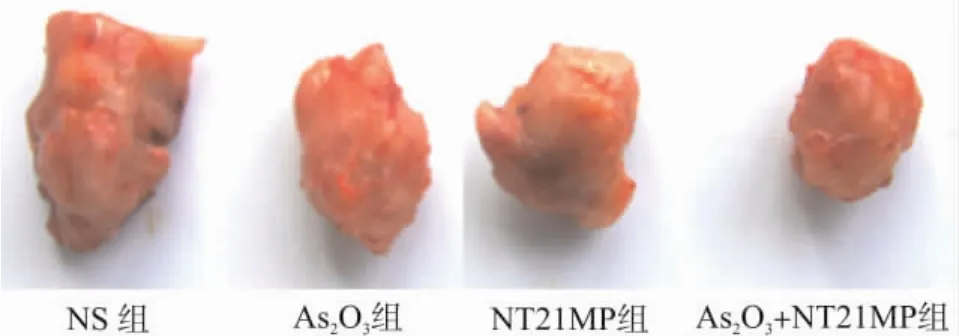
图1 NT21MP和As2O3对原发瘤的抑制作用Fig.1 Inhibitory effect of NT21MP and As2O3treatment on the size of primary tumors in animals
表1 各组药物作用后的瘤重和抑瘤率比较(n=3,±s)Table 1 Comparison of tumor weight and inhibitory rate among groups after treatment(n=3,±s)

表1 各组药物作用后的瘤重和抑瘤率比较(n=3,±s)Table 1 Comparison of tumor weight and inhibitory rate among groups after treatment(n=3,±s)
与生理盐水对照组比较,*P<0.05;与As2O3+NT21MP组比较,#P<0.05
组别 瘤重(g) 抑瘤率(%)1.25±0.23 -As2O3组 0.75±0.12* # 40.0 NT21MP组 0.87±0.12*# 30.4 As2O3+ NT21MP组 0.57±0.10*生理盐水对照组54.4
2.3 As2O3和NT21MP抑制乳腺肿瘤增殖并诱导细胞凋亡
肿瘤细胞凋亡检测采用TUNEL法,增殖检测采用免疫组化SP染色法。结果显示,相对于生理盐水对照组,NT21MP组、As2O3组和NT21MP+As2O3组的PCNA表达均明显降低(均P<0.05),但凋亡指数明显升高(均P<0.05),以NT21MP+As2O3组更明显。见图3、图4和表2。
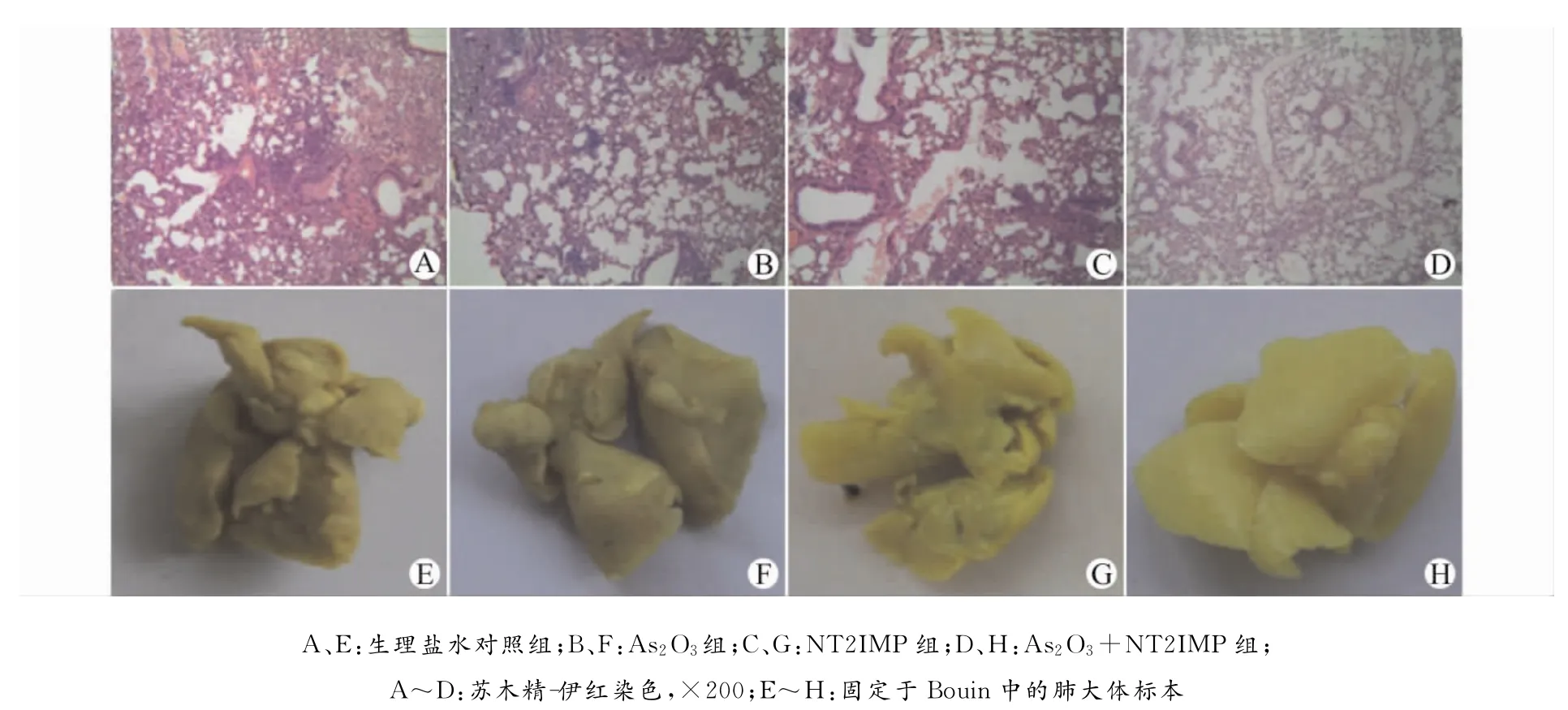
图2 NT21MP和As2O3对荷乳腺癌小鼠肺转移的抑制作用Fig.2 Inhibitory effect of NT21MP and As2O3on lung metastasis in the mouse model of breast cancer
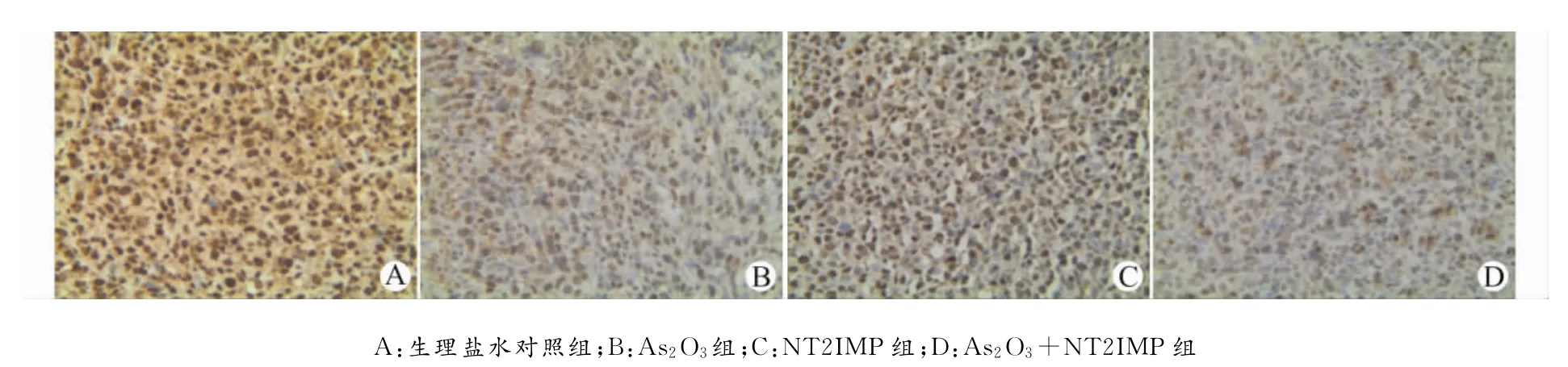
图3 免疫组化SP染色检测PCNA表达示NT21MP和As2O3对荷乳腺癌小鼠原发瘤的抗增殖作用(×400)Fig.3Immunohistochemistry showing the anti-proliferation effect of NT21MP and As2O3in the mouse model of breast cancer(×400)

图4 TUNEL法检测NT21MP和As2O3对荷乳腺癌小鼠原发瘤的促凋亡作用(×400)Fig.4 TUNEL assay showing the promoting effect of NT21MP and As2O3on apoptosis of tumors in the mouse model of breast cancer(×400)
表2 乳腺癌原发瘤组织PCNA标记指数和凋亡指数(%,n=3,±s)Table 2 Comparison of the AI and PCNA LI of primary tumors among groups(%,n=3,±s)

表2 乳腺癌原发瘤组织PCNA标记指数和凋亡指数(%,n=3,±s)Table 2 Comparison of the AI and PCNA LI of primary tumors among groups(%,n=3,±s)
与生理盐水对照组比较,*P<0.05;与As2O3+NT21MP组比较,#P<0.05
组别92.5±5.7 8.3±1.1 As2O3组 36.3±4.2*# 39.7±6.7*#NT21MP组 43.9±6.1*# 15.6±3.1*#As2O3+NT21MP组 22.7±4.9* 63.8±7.7 PCNA LI AI生理盐水对照组*
3 讨论
近年来,乳腺癌成为威胁女性健康的头号杀手。死亡原因往往与癌细胞恶性增殖和侵入到其它组织和器官,造成器官功能衰竭有关。因此联合应用抑制乳腺癌增殖和特异性阻断乳腺癌转移的治疗方法可提高疗效。近年研究表明趋化因子受体CXCR4和其配体SDF-1α的相互作用与肿瘤转移密切相关。SDF-1α与CXCR4结合后,可通过激活多种信号传导通路,包括 Ras-Raf-Mek-MAPKp42/44[7]和磷脂酰肌醇-3激酶(PI3K)/AKT[8]信号传导通路进而影响细胞的生物学行为。我们的前期研究表明NT21MP负性调控SDF-1α而抑制肿瘤细胞趋化效应,在体内外药效实验中均表现出抗乳腺癌活性[3]。
As2O3是中药砒霜的有效成分,在治疗急性早幼粒细胞白血病中取得了世人瞩目的突破进展[9]。临床报道 As2O3对多种恶性肿瘤有效[10-12],众多研究表明As2O3通过调控细胞周期或抑制端粒酶活性而抑制乳腺癌细胞的增殖和促进凋亡[13-14]。
本研究建立了乳腺癌小鼠动物模型,通过增殖和凋亡指标的检测判断NT21MP和As2O3抑制肿瘤细胞增殖的效应,通过肺转移指标检测2种药物抑制乳腺癌转移的效应,其目的是检测NT21MP和As2O3联合拮抗乳腺癌生长和转移的协同作用,为后续研究如何提高药效,降低单药浓度,从而降低NT21MP和As2O3潜在的副作用提供理论依据。
诱导更多肿瘤细胞的凋亡及降低肿瘤细胞的增殖是治疗肿瘤的途径之一。本研究发现,相对于生理盐水对照组,NT21MP和As2O3均可抑制肿瘤的生长,以联合用药组更显著(P<0.05)。PCNA是一种仅在增殖细胞中合成和表达的36kD的多肽,其表达和合成与细胞的增殖周期有关,可精确判断癌组织中增殖细胞所占比例。本研究结果显示:与生理盐水对照组相比,NT21MP和As2O3均可使PCNA LI下降(P<0.05),AI升高(P<0.05),并以联合用药组更显著(P<0.05)。
肺转移检测结果发现,生理盐水对照组小鼠肺脏表面可以见到多个散在的、体积较大的白色肿瘤转移结节;As2O3组可见散在的、小的单个肿瘤转移结节;NT21MP组仅见个别小结节;联合用药组肺表面肉眼没有看到明显的转移结节形成。肺组织HE染色光镜下可见各组的小鼠肺内形成不同程度的肿瘤转移病灶。生理盐水对照组的3只小鼠肺内均见转移性Lewis肺癌瘤灶,瘤灶范围广、数量多,且有血管壁破坏现象;As2O3组的3只小鼠肺内也均见转移性Lewis肺癌瘤灶,但瘤灶减小;NT21MP组中2只小鼠肺内见转移性Lewis肺癌瘤灶,并且范围小、数量少;NT21MP和As2O3联合用药组中2只小鼠肺内偶见肺泡壁上皮细胞癌变现象,未见明显的转移性Lewis瘤灶形成。
由此可见,NT21MP通过拮抗SDF-1/CXCR4生物轴的作用,抑制其下游Akt、ERK1/2和钙流等信号分子,抑制荷乳腺癌小鼠的肺转移效应[15]。联合As2O3抑制肿瘤细胞增殖效应,可提高NT21MP的药效,为药物的联合应用提供了支持和思路。
[1] Mines M A,Goodwin J S,Limbird L E,et al.Deubiquitination of CXCR4by USP14is critical for both CXCL12-induced CXCR4degradation and chemotaxis but not ERK activation[J].J Biol Chem,2009,284(9):5742-5752.
[2] 叶石敦,莫雪梅,张光,等.vMIP-Ⅱ各受体结合活性位点分析[J].中国现代医学杂志,2006,16(23):3546-3552.
[3] Yang Q L,Ding Y X,Chen C J,et al.Suppression of murine breast cancer metastasis by selective inhibition of CXCR4by synthetic polypeptide derived from viral macrophage inflammatory protein Ⅱ [J].Chinese Science Bulletin,2010,55(20):2152-2159.
[4] 张鹏,王树叶,胡龙虎,等 .三氧化二砷注射液治疗72例急性早幼粒细胞白血病[J].中华血液学杂志,1996,17(2):58-60.
[5] 魏玲,王兴武,左文述,等 .三氧化二砷抑制人乳腺癌细胞生长及其作用机制的初步研究[J].中华医药杂志,2005,85(17):1209-1213.
[6] Wang X,Gao P,Long M,et al.Essential role of cell cycle regulatory genes p21and p27expression in inhibition of breast cancer cells by arsenic trioxide[J].Med Oncol,2011,28(4):1225-1254.
[7] Busillo J M,Benovic J L.Regulation of CXCR4signaling[J].Biochim Biophys Acta,2007,1768(4):952-963.
[8] Shen X,Artinyan A,Jackson D,et al.Chemokine receptor CXCR4enhances proliferation in pancreatic cancer cells through AKT and ERK dependent pathways[J].Pancreas,2010,39(1):81-87.
[9] 张鹏,王树叶,胡龙虎,等 .三氧化二砷治疗急性早幼粒细胞白血病七年总结——附242例分析[J].中华血液学杂志,2000,21(2):67-70.
[10] Liu J,Lu Y,Wu Q,et al.Mineral arsenicals in traditional medicines:orpiment,realgar,and arsenolite[J].J Pharmacol Exp Ther,2008,326(2):363-368.
[11] Chen Z,Zhao W I.Arsenic trioxide and acute promyelocytic leukemia:clinical and biological[J].Curr Top Microbiol Immunol,2007,313(1):129-144.
[12] 耿建,石玉荣,王慧.三氧化二砷抑制苯并(a)芘诱导的HeLa细胞细胞色素P450 1A1的表达[J].华中科技大学学报:医学版,2012,41(2):161-164.
[13] Wang X,Gao P,Long M,et al.Essential role of cell cycle regulatory genes p21and p27expression in inhibition of breast cancer cells by arsenic trioxide[J].Med Oncol,2011,28(4):1225-1254.
[14] Ye J,Li A,Liu Q,et al.Inhibition of mitogen-activated protein kinase kinase enhances apoptosis induced by arsenic trioxide in human breast cancer MCF-7cells[J].Clin Exp Pharmacol Physiol,2005,32(12):1042-1048.
[15] Yang Q L,Chen C J,Ding Y X,et al.Suppression of breast cancer proliferation and induction of apoptosis via AKT and ERK1/2signal transduction pathways by synthetic polypeptide derived from viral macrophage inflammatory protein Ⅱ[J].J Huazhong Univ Sci Technol[Med Sci],2011,31(4):423-428.
