壳聚糖对苹果梨抗菌物质及抗性酶活性的诱导
2013-05-07刁春英毕阳李永才
刁春英,毕阳,李永才
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070;2.河北经贸大学生物科学与工程学院,河北石家庄050061)
苹果梨(Pyrus bretschneideri Rehd)是甘肃省特产水果,品质极佳,在国内外市场颇具声誉。但其果实极易遭受互隔交链孢(Alternaria alternata)的侵染而发生黑斑病,贮藏期间的发病率可高达37%[1],造成了明显的腐烂损失。因此,生产中亟待找到控制该病的方法。
虽然化学杀菌剂可有效控制果蔬腐烂,但由于杀菌剂残留,环境污染及诱导病原物产生抗药性等问题而逐渐受到限制。因此,近年来人们致力于发展新的、可替代化学杀菌剂的更为安全的方法。壳聚糖是几丁质分子脱去乙酰基的衍生物,其来源丰富,价格低廉无毒、副作用,可用于果蔬的防腐保鲜[2-3]。据报道,壳聚糖处理明显减少了草莓灰霉病[4]、脐橙青霉病[5]、桃软腐病和褐腐病[6-7]杏黑斑病[8]的发病率。
本研究在壳聚糖控制苹果梨黑斑病的基础上,探索壳聚糖处理后果皮抗菌物质及病程相关蛋白的变化,以丰富和完善壳聚糖的抗菌机理。
1 材料和方法
1.1 试剂与仪器
供试苹果梨10月3日采自甘肃省景泰县条山农场,单果包纸后,装箱运抵本校,在 0℃,RH(85±5)%[1]下贮藏待用。供试互隔交链孢(A.alternata)参照方中达法[9]分离自腐烂病果,纯化后在PDA上保存待用。供试壳聚糖由浙江大学化工系提供。
超净工作台:苏净集团苏州安泰技术有限公司;高压灭菌锅:北京广顺科技发展有限公司;电热恒温培养箱:上海一恒科技有限公司;色质联用仪(HP GC6890-MS5973):美国惠谱公司;冷冻高速离心机:德国Sigma(五洲东方);UV-2450型紫外-可见分光光度计:日本岛津。
1.2 方法
1.2.1 壳聚糖采后处理
取健康、表面光滑、表面无任何损伤、大小一致的果实,先用自来水进行表面冲洗,自然晾干后在3%的壳聚糖溶液中进行浸泡处理1 min,晾干后用于抗菌物质的测定,以未经任何处理者为对照。2%壳聚糖浸泡处理和0.75%壳聚糖切面涂抹处理者用于酶活性测定,以无菌水处理者作对照。每个处理用果实5个。
1.2.2 壳聚糖处理对果皮中抗菌物质的影响
1.2.2.1 抗菌物质的提取、分离与生物鉴定
参照李永才等[1]的方法,取处理后3 d的果皮组织200 g于研钵中,加入少量甲醇研碎后,加入甲醇浸泡24 h,抽滤后,在真空条件下(220 mmHg)下浓缩,然后用50 mL二氯甲烷萃取3次,萃取液经浓缩得提取物。取2 mL粗提物,在TLC(GF25460型薄层层析硅胶)板端1.5 cm处点样后层析,展开剂为正己烷∶乙酸乙酯∶甲醇=60∶40∶5。将纯化的 A.alternata 配成浓度为 1×106个孢子/mL的悬浮液,然后将孢子悬浮液和Czapek培养基按1∶1的比例充分混匀,同时加入20 μg/mL链霉素以防细菌污染,用小型喷雾器均匀喷于展开后的TLC板上,然后将板置于无菌、密闭且达饱和湿度的干燥器中,在25℃下培养6 d~7 d,观察计算比移值(Rf),并拍照记录结果。
1.2.2.2 果皮抗菌物质的成分分析
将上述抑菌带剥下,用甲醇提取5 min,然后用滤纸过滤浓缩,多次重复收集足够浓缩液,进行色质联用仪(HP GC6890-MS5973)分析。
测试条件:毛细管柱(30 m×0.25 m×0.25 μm),载气He的流速为1.2 m/min,进样口温度250℃;升温程序:60℃~260℃,以5℃/min升温。质谱上的参数:分离器温度280℃,离子源能量70 ev,数据采集范围33~550,数据采集间隔 2.85 次/s,谱库:NIST98。
1.2.3 壳聚糖处理对几丁质酶和β-1,3-葡聚糖酶活性的影响
1.2.3.1 粗酶液的提取
取5 g果肉组织,在4℃10 mL 50 mmol/L的磷酸pH5.0缓冲液中研成匀浆,匀浆在4℃下离心15 min,15 000 r/min,上清液为酶的粗提液。
1.2.3.2 几丁质酶活性的测定[10]
将0.5 mL酶液与0.5 mL胶状几丁质及0.1 mL磷酸缓冲液(pH6.4)于40℃水浴中保温1 h,冷却离心(4 000 r/min)5 min,取上清液0.5 mL加四硼酸钾0.1 mL,沸水中准确加热3 min,流水冷却后加入3 mL对-二甲氨基苯甲醛,混匀后立即放入36℃~38℃的水浴中,20 min后流水冷却,立即在585 nm下读数,在上述条件下测得的消光值作为酶的活性单位。
1.2.3.3 β-1,3-葡聚糖酶活性的测定[10]
酶提取液1 mL,0.1 mol/L柠檬酸-0.2 mol/L磷酸氢二钠缓冲液(pH4.8)2.5 mL,1%昆布糖 0.5 mL,30℃保温1 h,蒽酮法测糖生成量。以分光光度计上620 nm下的消光值为酶的活性单位。
2 结果与分析
2.1 壳聚糖处理对果皮抗菌物质的诱导
经壳聚糖处理的苹果梨果皮提取物经TLC生物活性分析,与未经处理的对照相比有不同比移值的抑菌带出现,对照比移值为0.692,壳聚糖处理的比移值为0.239(图1)。将不同比移值的抑菌带的甲醇洗脱液经浓缩后做GC/MS分析,结果见表1。
未经壳聚糖处理者果皮中主要的抗菌物质共有4类13种,分别为酯类、苯噻唑类、有机酸类和酚类,其中酯类含量最高,占总绝对含量的44.986%,苯噻唑类含量最低,占总绝对含量的2.751%。

图1 对照和壳聚糖浸泡处理果皮提取物TLC生物活性分析结果(Rf分别为0.692和0.239)Fig.1 The result of TLC bioactivity analysis of the extract from the peel of the control and chitosan treatment(Rf:0.692,0.239)
经壳聚糖处理的苹果梨果皮中的主要抗菌物共有6类17种,分别为酯类、烷类、酚类、苯噻唑、有机酸类和烯类,与对照相比,壳聚糖诱导出烷和烯及多种酯、酚、酸等抗菌物质。所有抗菌物质中酯类仍占绝对优势为67.396%,其次为有机酸类占18.961%,酚类物质占7.649%。酯类物质中以不同饱和程度的脂肪酸甲酯类含量较高,它们占所有酯类的70.291%。
2.2 壳聚糖处理对几丁质酶和β-1,3-葡聚糖酶活性的影响
壳聚糖处理者的几丁质酶活性分别高于对照48.18%和47.45%,据蒽酮法测糖含量,以620 nm下的消光值代表糖含量,同时代表酶的活性,结果为2%壳聚糖处理的完整果实为0.51D,0.75%壳聚糖处理的切开果实为0.52D,对照为0.42D,可见用2%壳聚糖处理的果实与用0.75%壳聚糖处理的果实β-1,3-葡聚糖酶活性无显著差异,而二者与对照相比,酶性分别提高了16.87%和16.65%。如图2。
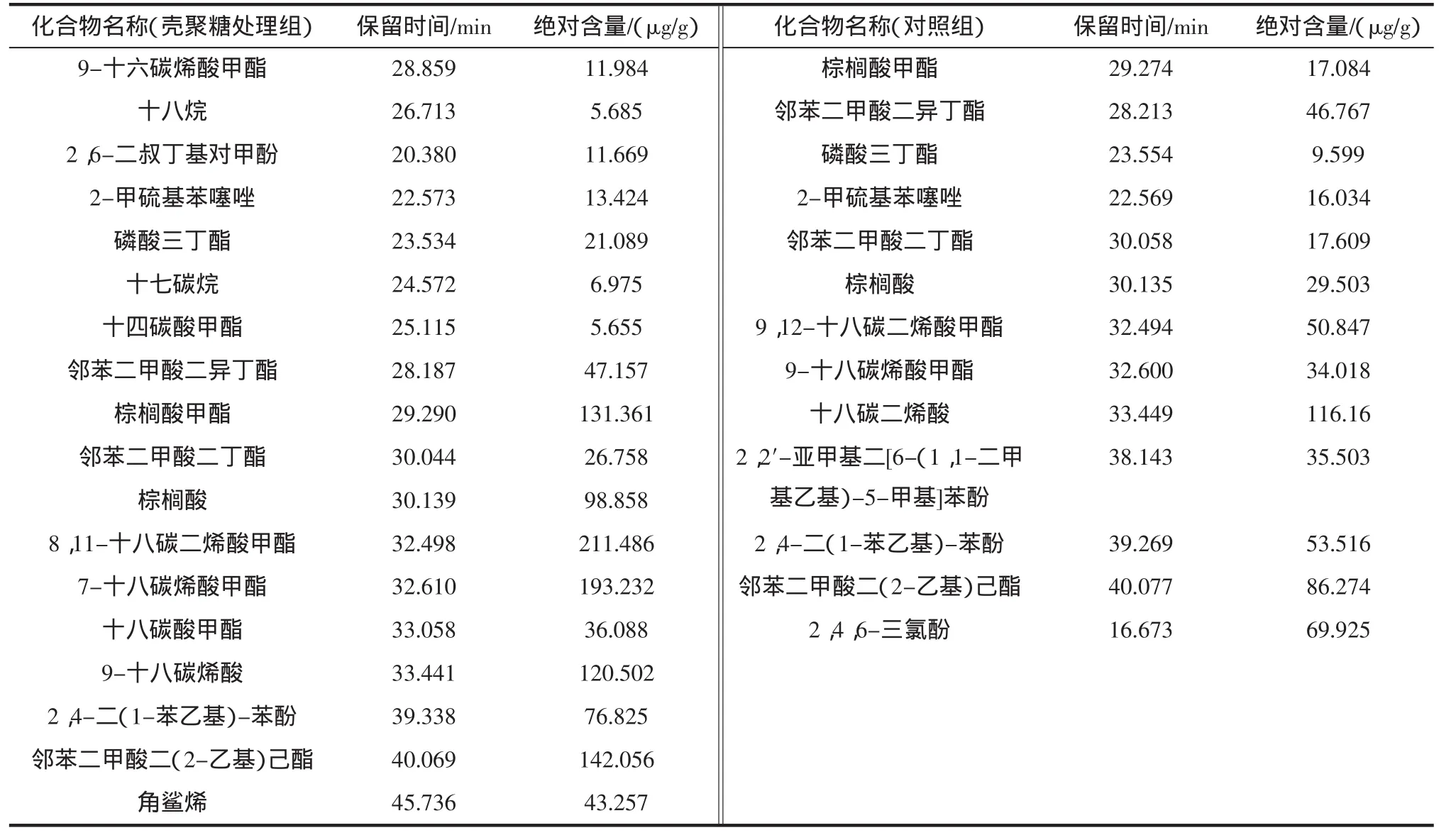
表1 对照和壳聚糖处理后果实果皮中主要抗菌物质成分分析Table 1 Analysis of major ingredient of antifungal compounds from the peel of the control and chitosan treatment fruit
3 结论与讨论
3.1 壳聚糖处理可诱导次生代谢物质的生成

图2 壳聚糖处理对苹果梨几丁质酶和β-1,3-葡聚糖酶活性的影响Fig.2 Effect of chitosan-treatment on the activity of chitinase and β-1,3-glucanase
酯类、烷类、酚类、苯噻唑、有机酸类和烯类是壳聚糖诱导产生的重要抗菌物质。李永才在对苹果梨果皮的抗菌物质成分分析时推测,不同种类的邻苯二甲酸酯类是采收后具有抗性的物质中的一类重要成分[1],本试验证实了此推测,与陈尚武等[11]在分离甜瓜抗菌物质时发现的邻苯二甲酸酯类物质是典型的抗菌物质结论一致。酚类(单宁、绿原酸等)化合物对真菌有毒,又是木质素形成的前体,所以植物体内酚类增多,不但自身可以抗病,而且还可促使病原侵染处木质化,因而使植物抗病能力增强。本试验中,对采后60 d的苹果梨果皮组织粗提液进行TLC生物活性分析,其抑菌成分中酚类是抗菌物质中较重要的物质。烯类物质也是本实验抑菌成分的重要物质。烯类作为果实的抑菌物质已有许多报道,如芒果未成熟时含有的间苯二酚-5-十七碳-12-烯可抑制盘长孢状刺盘孢的芽管伸长,鳄梨未成熟果实对盘长孢状刺盘孢的抗性与抑菌物质1-乙酸基-2-羟基-4-氧代-二十一碳-12,15-二烯及1-乙酸基-2,4-二羟基-n-十七碳-16-单烯有关。据报道[12],烯类物质是脂肪氧化酶的氧化基质[2],所以抑制脂肪氧化酶活性与推迟烯类物质降低和减少病害发生是一致的。
3.2 壳聚糖处理可诱导抗性蛋白的产生
本试验中壳聚糖处理能够明显提高苹果梨果肉组织中几丁质酶和β-1,3-葡聚糖酶的活性,这与El Ghaouth[4]在草莓及张东林等[13]在草莓和树莓上的结果相一致。据报道,壳聚糖能够诱导多种果蔬采后这两种酶的活性,另外可提高PAL和POD活性,从而激发苯丙烷类代谢,产生酚类和异黄酮类植保素等,并能刺激形成许多结构防御障碍[14]。Mauch F et al[15]证明在离体培养条件下,几丁质酶和β-1,3-葡聚糖酶能够有效抑制几种真菌的生长,但是这些酶在病害防卫中的作用尚未证实。在本试验中,2%壳聚糖对完整果实的涂膜与0.75%壳聚糖对切开果实涂膜相比酶活性无差异,这表明酶活性的引发需要与组织的直接接触,苹果梨的果皮结构可能物理性地导致壳聚糖与果肉组织的分隔,从而阻止了壳聚糖对酶活性的诱导。
[1]李永才.苹果梨黑斑病潜伏侵染及其预合成抗菌物质的变化和诱导[D].兰州:甘肃农业大学硕士学位论文,2000
[2]焦中高,刘杰超,郑恒.壳聚糖对果蔬的保鲜作用及其机理探讨[J].食品研究与开发,2003,10(24):114-116
[3] 肖丽霞,王乔.壳聚糖在果蔬贮藏保鲜中的应用[J].保鲜与加工,2005(1):4-6
[4] El Ghaouth A,et al.Antifungla activity of chitosan on two postharvest pathogens of strawberry fruits[J].Phytopathology,1992,82(4):398-402
[5] 刘峰,陈明,陈金印,等.壳聚糖对纽荷尔脐橙果实采后青霉病菌的抑菌作用研究[J].江西农业大学学报,2010,32(3):0489-0492
[6] 李红叶,黎军英.脱乙酰壳多糖对桃软腐、褐腐病菌的抑制和采后软腐病的防治研究[J].浙江农业学报,1997,9(2):87-92
[7] 黎军英,李红叶.壳聚糖对桃褐腐病菌的抑菌作用[J].电子显微学报,2002,21(2):138-140
[8] 刁春英,毕阳.采后壳聚糖涂膜处理对损伤接种杏黑斑病的影响[J].甘肃农业大学学报,2000(4):445-449
[9] 方中达.植病研究方法[M].3版.北京:中国农业出版社,1998
[10]中国科学院上海植物生理研究所,上海市植物生理学会编.现代植物生理学实验指南[M].北京:科学出版社,1978
[11]陈尚武,张维一,李学文.预合成抗菌物质抑制甜瓜的两种病害的侵染[J].植物病理学报,2000,30(2):65
[12]张惟一,毕阳编著.果蔬采后病害与控制[M].北京:中国农业出版社,1996:2
[13]DongLin Zhan g,Peter C.Quantick.Antifungal effects of chitosan coating on fresh strawberries and raspberries during storage[J].Journal of horticultural science&biotechnology,1998,73(6):763-767
[14]Liu J,Tian S P,Meng X H,et al.Effects of chitosan on control of postharvest diseases and physiological responses of tomato fruit[J].Postharvest biology and technology,2007,44(3):300-306
[15]Mauch F,Handwiger L A,Boller T.Ethylene:Symptom,not signal for the induction of chitinase and β-1,3-glucanase in pea pods by pathogens and elicitor[J].Plant Physiol,1984,76(3):607-611
