落葵果实多糖的提取及含量的测定
2013-05-07赵建芬李妍董基黄清华
赵建芬,李妍,董基,黄清华
(肇庆学院化学化工学院,广东肇庆526061)
落葵(Basella rubra L.)又称木耳菜、胭脂菜、紫藤菜、篱笆菜等,原产于亚洲南部地区,是一类生长迅速、适应性广、容易栽培的药菜兼用植物,我国各地均可种植[1]。落葵除含丰富的营养成分外,还含有皂甙、葡聚糖、黏多糖等药用成分[2]。落葵全株可入药,种子和叶片入中药味甘。成熟落葵果实为紫红色,含有甜菜花青素[3]和糖类物质。目前国内外的研究报道中鲜有从落葵果实中分离多糖的报道。多糖(Polysaccharide)是由10个以上单糖通过糖苷键连接而成的聚糖,是构成生命体的四大基本物质之一。当前的研究表明活性多糖与增强免疫力、抗氧化、抗肿瘤、抗病毒和降血脂等密切相关[3]。因此,对落葵果实多糖的提取将为其药理活性的研究打下基础,并有助于多糖资源的开发和利用。本工作采用超声法、索氏法和水提法3种方法提取落葵果实多糖,苯酚-硫酸比色法测定其含量。
1 材料与方法
1.1 材料
1.1.1 研究对象
新鲜红花落葵果实:采自高要市莲塘农家菜园。
1.1.2 仪器、试剂
S22/S22PC可见分光光度计:上海棱光技术有限公司;RE-5299旋转蒸发器:河南巩义市宇翔仪器有限公司;超声波清洗器SB25-12D:宁波新芝生物科技有限股份公司;索氏提取器:购自肇庆顺达有限公司;BS210S电子天平:北京赛多利斯仪器系统有限公司。铝片、无水碳酸钠、活性炭,葡萄糖对照品、浓硫酸、石油醚、95%乙醇、无水乙醇、丙酮、乙醚、氯仿、正丁醇等均为分析纯,苯酚为化学纯,药品均购自天津市广成化学试剂有限公司。
1.1.3 溶液的配置
1.1.3.1 5%苯酚试剂的制备
称取苯酚50 g于100 mL烧瓶中,加入0.05 g铝片和0.025 g碳酸氢钠,蒸馏。收取182℃馏分。然后称取纯苯酚固体7.5 g,加水溶解并定容至150 mL,置棕色瓶内放冰箱备用。
1.1.3.2 葡萄糖标准溶液的配置
称取105℃干燥恒重的葡萄糖0.025 0 g,加水溶解并定容至250 mL,配成浓度为100.0 μg/mL葡萄糖标准溶液,放冰箱备用。
1.2 方法
1.2.1 葡萄糖标准曲线的绘制
精密量取葡萄糖标准溶液 0.10、0.20、0.30、0.40、0.50、0.60、0.70 mL置干燥试管中,分别加水至1.00 mL,加入5%苯酚溶液1.50 mL,浓硫酸7.50 mL,摇匀。室温放置25 min,以不加葡萄糖标液的试剂空白为参比,在490 nm[4]处测定吸光度。以吸光度A为纵坐标,葡萄糖浓度C(μg/mL)为横坐标,绘制标准曲线,建立线性回归方程。
1.2.2 落葵果实多糖精制品的制备[4-5]
将新鲜的落葵果实清洗干净,于烘箱中60℃恒温干燥2 d,然后粉碎成粉末,密封备用。
称取落葵果实粉末50 g,用250 mL石油醚于60℃~80℃的水浴中回流脱脂2次,每次1 h。再用250 mL 80%乙醇于80℃~90℃的水浴中回流提取2次,每次2 h,除去单糖、双糖、低聚糖、皂苷类和多酚类等物质。残渣加水250 mL,90℃水浴中提取2次,每次2 h。合并两次水提取液,50℃减压浓缩至75 mL,加2 g~3 g活性炭进行脱色。经两次脱色后,滤液加5倍量95%乙醇,放置过夜,抽滤。抽滤后的沉淀加适量水溶解,采用Sevag法[6]脱去蛋白质,即按溶液1/5体积加入氯仿-正丁醇(预先配制成体积比为4∶1混合液),剧烈振摇20 min,静置分层,弃去水层与有机层交界处的变性蛋白,重复一次。取水相,50℃减压浓缩至适当体积,加5倍量95%乙醇沉淀,沉淀再分别以95%乙醇、无水乙醇、丙酮、乙醚洗涤3次,60℃干燥,即得纯度较高的白色落葵果实多糖。
1.2.3 落葵果实多糖换算因素的测定[4-5]
精确称取60℃干燥恒重的多糖精制品0.035 0 g,水溶解后定容至100 mL,为多糖精制品储备液。精确量取多糖精制品储备液0.20 mL加水至1.00 mL,按测定标准葡萄糖溶液的方法测其吸光度,代人回归方程,算出多糖溶液中葡萄糖的浓度C,从而计算换算因素:
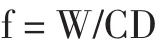
式中:W为多糖质量,μg;C为多糖溶液中葡萄糖的浓度,(μg/mL);D为多糖的稀释体积mL。
1.2.4 超声法、索氏法和水提法提取落葵果实多糖及其含量的测定
称取落葵果实粉末9份,每份约0.2 g,按下列步骤进行多糖的提取:①取3份样品,分别加入100 mL 80%乙醇,于45 kHz超声提取40 min,倾去上清液,再加100 mL 80%乙醇重复提取一次,以除去单糖、双糖和低聚糖。然后减压抽滤。残渣挥去乙醇溶剂后,加100 mL水,于45 kHz超声提取40 min,再加水重复超声提取一次。合并两次水提取液,反复洗至250 mL容量瓶中,定容,作为超声提取法的样品液。②取3份样品,分别用20 mL 80%乙醇浸泡过夜。再于索氏提取器中用80 mL 80%乙醇回流2 h,残渣挥去乙醇溶剂后继续用水回流提取2 h。用水反复洗至250 mL容量瓶中,定容,成为索氏提取法的样品液。③取3份样品,分别用100 mL石油醚70℃水浴提取2次,每次1 h,以除去油脂。去除石油醚溶剂后,分别用100 mL 80%的乙醇于80℃的水浴中提取2次,每次1 h,以除去单糖和低聚糖。再将残渣用100 mL水于90℃的水浴中提取2次,每次1 h。合并两次水提取液并定容为250 mL,成为水提取法的样品液。
分别精确吸取样品液1.00 mL,按测定标葡萄糖溶液的方法测其吸光度,根据回归方程计算浓度C,按下式分别计算多糖含量:
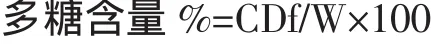
式中:C为样品溶液的葡萄糖浓度,(μg/mL);D为样品溶液的稀释体积,mL;f为落葵果实多糖换算因素;W为样品的质量,μg。
1.2.5 超声法提取多糖重现性和回收率的测定
精密吸取同一超声样品提取液0.50 mL(5份),分别精密加入多糖精制品储备液0.50 mL,按测定标准葡萄糖溶液方法测其吸光度,检验方法的重现性。
精密吸取同一超声样品提取液0.50 mL(5份),分别精密加入葡萄糖标准溶液 0.10、0.20、0.30、0.40、0.50 mL,按测定标准葡萄糖溶液方法测其吸光度,计算回收率。
2 结果与分析
2.1 葡萄糖标准曲线的绘制
根据葡萄糖标准溶液的溶度和测得的吸光值,绘制葡萄糖标准曲线,如图1所示。回归方程为A=0.065 2 C+0.000 2,R2=0.999 1,表明在 1.00 μg/mL ~7.00 μg/mL浓度范围内,葡萄糖标准曲线线性关系良好,可用于样品液的测定。
2.2 落葵果实多糖换算因素的测定
测得多糖精制品溶液的吸光度A=0.277,代人回归方程,算得显色反应液中葡萄糖浓度为4.258 μg/mL,则多糖液中葡萄糖的浓度C=4.258×10.0/0.20=212.9 μg/mL,计算换算因素:f=W/CD。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose solution
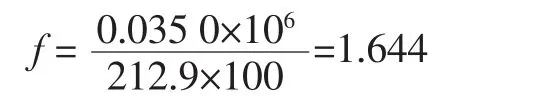
式中:W为多糖质量,μg;C为多糖液中葡萄糖的浓度,(μg/mL);D 为多糖的稀释体积,mL。
2.3 超声法、索氏法和水提法提取落葵果实多糖及其含量的测定
对超声法、索氏法和水提法提取的落葵果实多糖含量进行测定,计算结果如表1所示。

表1 3种方法提取落葵果实多糖的含量Table 1 Content of polysaccharide from the fruits of Basella extracted by three different methods
从表1可知,在考察的3种方法中,超声法提取的多糖含量是索氏法的1.62倍,是水提法的2.65倍。而且超声法提取时间短,无需加热,大大提高了多糖的提取效率。由此,超声提取多糖的方法优于其他两种方法。
2.4 超声法提取多糖重现性和回收率的测定
超声法提取落葵果实多糖重现性测定结果如表2所示,回收率测定结果如表3所示。
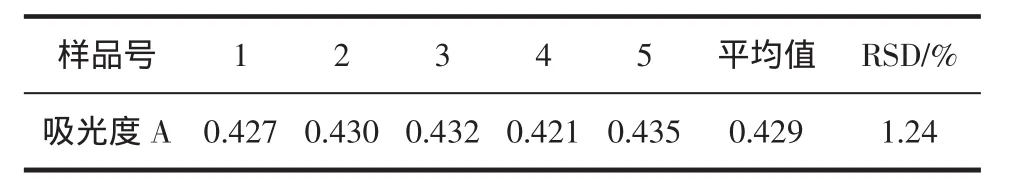
表2 重现性实验结果(n=5)Table 2 Result of reproducible test(n=5)
如表2所示,RSD=1.24%,说明方法重现性良好,精密度高。
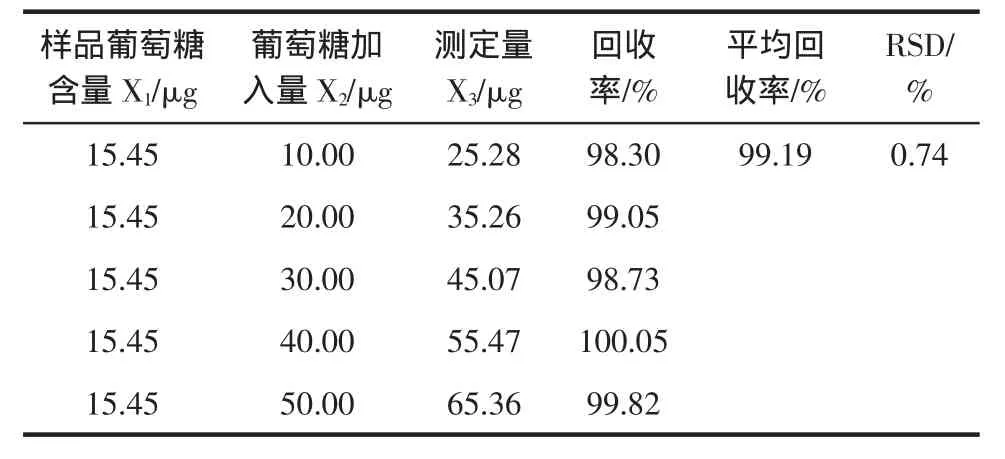
表3 回收率实验结果Table 3 Result of recovery experiment
微量组分的回收率在95%~110%,认为方法可靠[7]。从表3可知,落葵果实多糖平均回收率高,在微量组分回收率要求的范围内,且RSD值较小,由此可见,所建立的苯酚-硫酸比色法的准确度高、可靠性好。
3 结论
1)建立苯酚-硫酸比色法测定多糖的含量,回归方程为 A=0.065 2C+0.000 2,R2=0.999 1,在 1.00 μg/mL~7.00 μg/mL浓度范围内,葡萄糖标准曲线线性关系良好,而且方法可靠、重现性好,测定结果稳定、准确度高,适用于落葵果实多糖的测定。
2)采用精制落葵果实多糖测得落葵果实多糖对葡萄糖的换算因子f=1.644。
3)不同的提取方法对落葵果实多糖的提取率不同,超声法为6.240%,索氏法为3.854%,水提法为2.357%。三种方法中超声法提取率最高,提取时间最短,无需加热,所以超声法提取落葵果实多糖的效率高于其他两种方法。
[1] 陈连文,刘敬兰,师建华.落葵色素的提取及其稳定性的研究[J].化学世界,1995,49(11):581-583
[2] 卢毓星,岳森,卢隆杰.营养保健型蔬菜—落葵[J].特种经济动植物,2006,9(2):30-31
[3] 彭会军.落葵多糖的提取分离与药理学研究[D].武汉:华中农业大学生命科学技术学院,2008:8-13
[4] 王自军,邓红.白芥子多糖的超声提取及含量测定[J].数理医药学杂志,2004,17(2):175-176
[5] 王文平,郭祀远,李琳,等.苯酚-硫酸法测定野木瓜中多糖含量的研究[J].食品科学,2007,28(4):276-278
[6] 齐慧玲,魏绍云,王继伦,等.Sevag法去除白及多糖中蛋白的研究[J].天津化工,2000,13(3):20-21
[7] 华东理工大学,四川大学.分析化学[M].6版.北京:高等教育出版社,2009:12
