杜仲叶中绿原酸的提取分离及结构鉴定
2013-05-07杨秀芳汪洋马养民
杨秀芳,汪洋,马养民
(陕西科技大学教育部轻化工助剂化学与技术重点实验室,陕西西安 710021)
杜仲(Eucommia ulmoides Olive)为杜仲科杜仲属植物,仅一属一种。杜仲在我国研究和利用已有两千多年的历史[1]。传统中医以皮入药,但树皮生长缓慢,种植10年~20年后才能剥皮,每年杜仲皮的增长量仅为0.4 kg左右,紧缺的药源无法满足人类的需求[2]。为了保护和扩大药源,杜仲以叶代皮研究日益活跃,研究发现杜仲叶与皮有着相似的药理作用和化学成分,杜仲叶在临床上也具有较好的疗效[3]。杜仲属于落叶乔木,杜仲叶具有廉价、采摘方便、可循环再生等特点。这为杜仲叶的进一步利用奠定了物质基础,也为缓解紧缺的杜仲资源开辟了途径[4]。
杜仲叶中富含活性化合物绿原酸,绿原酸又称3-咖啡酰奎尼酸,是一种广泛分布于植物体内的苯丙素类物质。经研究发现其具有抗菌、抗炎、保肝、利胆等多种功效,广泛的应用于医药、食品、日用化工等行业,对绿原酸的提取纯化为合理开发杜仲资源具有十分重要的意义[5]。本实验通过对杜仲叶中绿原酸提取工艺和分离纯化方法进行了研究,进一步为杜仲综合利用提供参考。
1 仪器、试剂与材料
1.1 仪器与设备
SENCO电热恒温浴锅:上海申生科技有限公司;RE52CS-1旋转蒸发器:郑州南北仪器设备有限公司;Unic-2100型紫外可见光分光光度计:尤尼柯上海仪器有限公司;X-6精密显微微量熔点测定仪:巩义市予华仪器有限责任公司;Bruker avanceⅢ-400Hz超导核磁共振仪:瑞士布鲁克公司。
1.2 材料与试剂
杜仲叶、皮均采自西北农林科技大学苗圃;绿原酸标准品:中国药品生物制品检验所;D-101大孔吸附树脂:山东鲁抗医药股份有限公司;柱层析硅胶:青岛海立信精细硅胶化工有限公司;薄层层析硅胶G:青岛久隆盛业硅胶干燥剂有限公司;Sephadex LH-20:上海宝曼生物科技有限公司;甲醇、乙酸(色谱纯)。
2 方法和结果
2.1 绿原酸水提工艺研究
2.1.1 绿原酸标准曲线的建立
准确称取绿原酸标准品2.5 mg,甲醇溶解并定容至50 mL,得到绿原酸标准溶液(0.05 g/L)。分别从标准溶液中精确移取 1、2、3、4、5、7 mL 溶液至 10 mL 容量瓶中,甲醇定容,紫外分光光度计于328 nm处测定其吸光度[6]。以绿原酸浓度为横坐标,吸光度为纵坐标,绘制标准曲线,建立回归方程。
2.1.2 水提法正交试验
以水提法作为杜仲叶中绿原酸的提取方法。在单因素实验的基础上,选取料液比、提取时间、提取温度为考察因素进行正交实验,正交因素设计见表1。
准确称取阴干粉碎后的杜仲叶2 g,以水为溶剂,按正交水平表的工艺条件提取2次。提取液过滤并减压蒸干,用甲醇溶解,过滤除去不溶物。将滤液转移至50 mL容量瓶中,甲醇定容。再从上述容量瓶中精确移取1 mL溶液到100 mL容量瓶中,定容,利用紫外可见光分光光度计測其吸光度,由标准曲线得出绿原酸含量并计算得率。
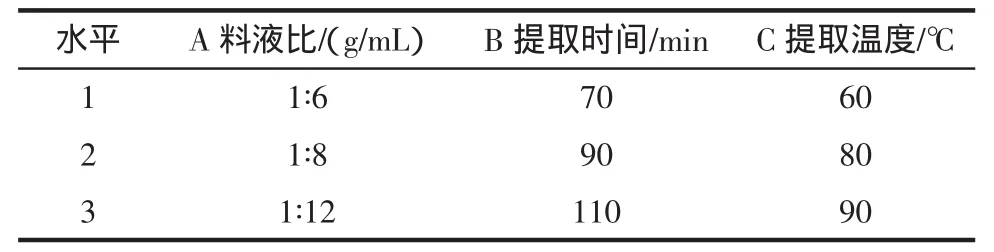
表1 正交因素表Table 1 Factors of orthogonal experiments
2.1.3 实验结果
依据实验数据,绘制标准曲线见图1,建立回归方程。

图1 绿原酸标准曲线Fig.1 Standard curve of chlorogenic acid
由标准曲线可知,绿原酸在5mg/L~35mg/L浓度范围内线性关系良好,回归方程为:y=0.061 4x-0.056 39,r=0.999 79,SD=0.015 26。水提法提取绿原酸正交试验结果见表2。
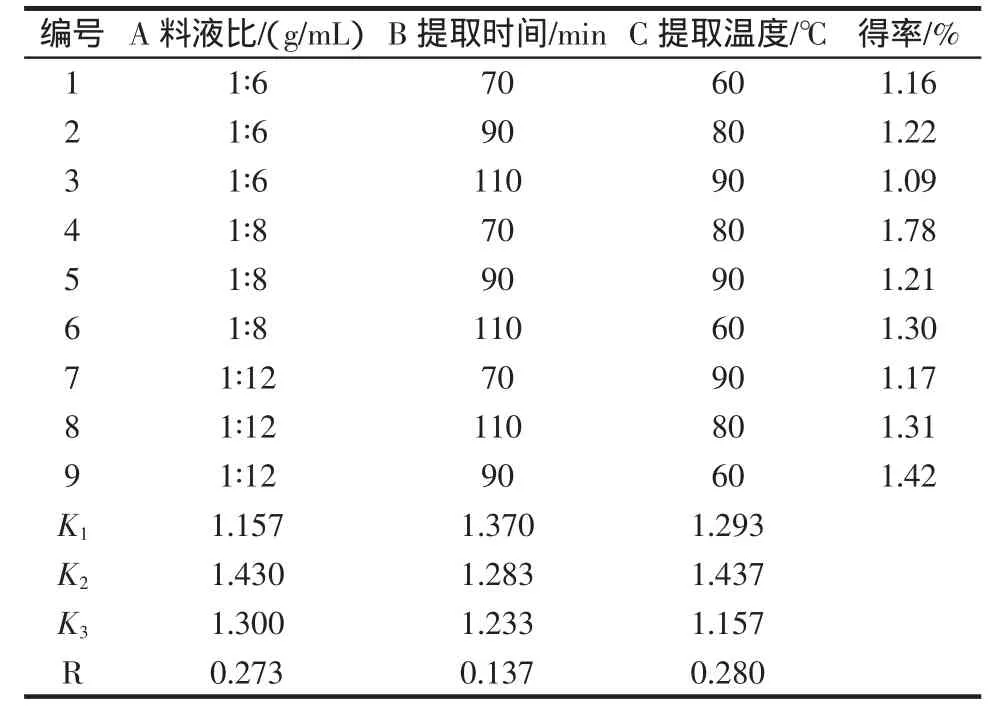
表2 正交试验结果Table 2 Result of orthogonal experiments
极差分析表明,各因素对绿原酸得率的影响程度为:C>A>B,即提取温度对绿原酸得率影响最大,其次是料液比,影响最小的因素是提取时间。比较A、B、C等因素的K1、K2和K3数据,3个因素的最优组合是A2B1C2,即绿原酸水提法的最佳工艺条件是:料液比为1∶8,提取时间 70 min,提取温度 80℃,以热水作为溶剂提取杜仲叶2次,测得此条件下的绿原酸得率为1.78%。
2.2 绿原酸的纯化工艺研究
2.2.1 绿原酸的纯化
将杜仲叶阴干并粉碎,按2.1.3确定的最佳工艺进行提取。将提取物减压浓缩得到粗提物。向粗提物中添加等量的工业酒精,经过多次的搅拌、沉淀,乙醇部分合并,减压浓缩至无乙醇蒸出。通过此操作除去浸膏中大量的多糖、淀粉、蛋白质等得粗浸膏。利用D-101大孔吸附树脂纯化所得粗浸膏,水-乙醇进行梯度洗脱,收集水相部分,减压浓缩得到浸膏。利用硅胶柱层析进一步对浸膏进行纯化。以乙酸乙酯-甲醇进行梯度洗脱(乙酸乙酯-甲醇体积比分别为 1∶0,20∶1,10∶1,5∶1,10∶3,5∶2,2∶1,5∶3,10∶7,1∶1,0∶1),利用薄层层析,结合标准品对化合物进行比较。经薄层层析后发现5∶2梯度洗脱液含有与绿原酸标准品相同Rf值的斑点。经多次硅胶柱层析后,再以甲醇为洗脱剂,利用Sephadex LH-20凝胶柱层析进行纯化。收集、合并与标准品具有相同Rf值斑点的洗脱液,挥干洗脱剂后得到白色固体。
2.2.2 化合物纯度检测与结构鉴定
以不同极性的展开剂将上述白色固体进行薄层层析,显色后在紫外灯下进行观察,看是否呈现单一斑点,若始终呈现单一的特征斑点;或利用熔点仪测定熔点,若熔程较短且与文献值相符,可确定为纯品化合物。
同时,利用1H-NMR、13C-NMR等波谱技术进行分析测定,确定化合物的结构。
2.2.3 结果
2.2.3.1 纯度的检测
分离得到的白色固体,易溶于乙醇、丙酮等极性溶剂,难溶于氯仿等低极性溶剂。经检测其熔点为207℃~208℃,与绿原酸的熔点相同,向白色固体中加入少量绿原酸标准品,其熔点不发生变化。同时薄层色谱呈现出单一斑点,且与标准品有相同的Rf值,由此可初步确定白色固体为绿原酸。
2.2.3.2 结构鉴定
1H-NMR(400 Hz,DMSO-d6)δ:12.45(1H,s,H-7′)为羧基氢的信号峰;9.63(1H,s,H-4),9.19(1H,s,H-3)为苯环上羟基氢的信号峰;7.04(1H,d,J=1.8,H-2),7.00 (1H,dd,J=1.8Hz,8.2Hz,H -5),6.78 (1H,d,J=8.1Hz,H-6)为苯环上未被取代的氢原子信号峰;7.44(1H,d,J=15.9 Hz,H-7),6.17(1H,d,J=15.9 Hz,H-8)为烯基氢的信号峰;5.57,4.98,4.81为与六元环直接相连的羟基氢信号峰;5.08(1H,m,H-3′),3.57(1H,s,H-4′),3.92 (1H,s,H-5′),2.05 (2H,m,H-6′),1.95(2H,m,H-2′)为六元环上的氢原子信号峰。
13C-NMR (100 Hz,DMSO- d6)δ:126.02 (C-1),116.17(C-2),148.79(C-3),145.43(C-4),115.20(C-5),121.84(C-6)为苯环上的六个碳原子的信号峰;146.00(C-7),114.69(C-8)为烯基碳的信号峰;166.17(C-9)为酯基碳的信号峰;73.84(C-1′),37.63(C-2′),68.42(C-3′),71.34(C-4′),70.68(C-5′),36.54(C-6′)为六元环上的碳原子信号峰;175.41(C-7′)为羧基碳的信号峰。
以上核磁数据与文献[7]中绿原酸的数据基本一致,故鉴定该白色固体为绿原酸。
3 结论
研究表明杜仲叶中绿原酸的含量远大于其皮中的含量。本文探讨了杜仲叶中绿原酸的提取工艺,为开发利用该资源提供了有益的参考。杜仲叶中绿原酸的最佳水提工艺条件为:料液比1∶8,提取时间70 min,提取温度80℃,以水作为溶剂提取杜仲叶2次,测得此条件下的绿原酸得率为1.78%。粗提物经醇沉工艺除杂后,依次利用D-101大孔吸附树脂、硅胶柱层析、Sephadex LH-20凝胶柱层析对所得浸膏进行纯化,分离得到的化合物经1H-NMR、13C-NMR波谱鉴定和文献对比为绿原酸。
[1] 艾伦强,李婷婷,何银生,等.杜仲的应用研究进展[J].亚太传统医药,2010,6(10):163-165
[2] 兰小艳,张学俊,龚桂珍.杜仲叶中绿原酸的研究进展[J].中国农学通报,2009,25(21):86-89
[3] 卢琪,段家彩,高丽,等.杜仲绿原酸的提取纯化及结构鉴定[J].食品科学,2010,31(14):275-279
[4] 张军民,高振川,张琪,等.杜仲叶及提取物营养价值和药用成分研究[J].氨基酸和生物资源,2002,24(1):1-2
[5] 张英锋,张立艳,马子川,等.植物绿原酸的研究进展[J].中国教育,2011(4):1-2
[6] 向昌国,李文芳,聂琴,等.甘薯茎叶中绿原酸提取方法的研究及含量测定[J].食品科学,2007,28:126-130
[7] 陈立娜,李萍.牵牛子化学成分研究[J].林产化学与工业,2007,27(6):105-108
