吡咯列酮与瑞舒伐他汀联合使用对大鼠胸主动脉外膜成纤维细胞氧化和炎症的保护作用
2013-05-07陶杨晨缪培智赵莉芳高平进顾水明
陶杨晨,缪培智,赵莉芳,高平进,顾水明
(1.江苏大学临床医学院,江苏 镇江212001;2.上海市徐汇区中心医院心内科,上海200031;3.上海市瑞金医院高血压研究所,上海200031)
血管外膜成纤维细胞(adventitial fibroblast,AF)被激活后能够发生表型转化,从而具有增殖和迁移的功能,参与高血压新生内膜的形成和血管重构[1-3]。血管重构是高血压靶器官损害的病理基础,在高血压的发生发展中起到重要的作用,而氧化和炎症反应是导致血管重构的主要因素。过氧化物酶体增殖物激活受体(peroxisome proliferators activated receptor ,PPAR)γ 是一种核受体,被配体激活后可调节靶基因的转录。多项研究证实PPARγ 激活对心血管疾病发挥有益的作用,如抑制平滑肌细胞的增殖和AF 的迁移等。他汀类药物具有抗氧化和抗炎的特性[4]。故联合使用PPARγ 激动剂和他汀类药物能更有效地对抗心血管病变。本研究通过体外实验探讨PPARγ 激动剂吡咯列酮与他汀类药物瑞舒伐他汀联合应用对血管紧张素(Ang)Ⅱ诱导的血管氧化及炎症反应的作用及可能机制。
1 材料与方法
1.1 材料
DMEM 细胞培养液、胎牛血清、胰蛋白酶等均购自Gibco 公司,培养皿购自Coming 公司,AngⅡ、吡格列酮购自Sigma 公司,瑞舒伐他汀钙购自大连美仑生物有限公司,RT-PCR 反应试剂盒购自Promega 公司,尼克酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶亚型一抗购自Santa Cruz 公司,二抗购自Amersham Life Sciences 公司,电泳迁移材料及转录因子探针购自Invitrogen 公司,PPARγ 及GAPDH引物由上海生物工程公司合成,SD 大鼠由上海市实验动物研究中心提供。
1.2 方法
1.2.1 细胞培养 取8 周龄的雄性SD 大鼠,分离胸主动脉外膜,将其剪碎,贴片于培养皿底部,用含20%胎牛血清的DMEM 培养液培养AFs,实验使用传代培养至第4 代的细胞。
1.2.2 蛋白质印迹法检测NADPH 氧化酶亚型待AFs 长至亚融合状态时,以无血清DMEM 处理24 h。实验分成5 组进行:对照组,AngⅡ组(浓度为10-6mol/L),PPARγ 激动剂干预组:吡咯列酮(浓度为10 ×10-6mol/L)+AngⅡ,他汀类药物干预组:瑞舒伐他汀(浓度为10 ×10-6mol/L)+AngⅡ,联合用药组:吡咯列酮+瑞舒伐他汀+AngⅡ(浓度同上)。AngⅡ诱导24 h,干预组药物在AngⅡ诱导前0.5 h 加入。收集上清及细胞,提取细胞总蛋白,BCA 法蛋白定量,取50 μg 蛋白与上样缓冲液变性后经聚丙烯酰胺凝胶电泳,4 ℃100 V 2 h 转膜,丽春红染色观察转移效果。5% 脱脂奶粉室温封闭2 h,4 ℃一抗孵育过夜(稀释倍数分别为羊抗-p22phox,1 ∶200;羊抗-p67phox,1 ∶200),TBST 洗3 次,每次10 min,结合辣根过氧化物酶标记的兔抗羊的二抗(1 ∶5000 稀释),室温孵育1 h,TBST 洗3 次。用蛋白质印迹荧光检测试剂盒显示于X 线片上。用Alphalmager 3400 Imaging 图像分析系统扫描胶片,以对照组的面积灰度值为100%与实验组进行比较分析。实验重复3 次。
1.2.3 电泳迁移 实验分组及药物干预处理同“1.2.2”。收集细胞,提取细胞核。设定的互补寡核苷酸序列:NF-κB,5'-AGTTGAGGGGACTTTCCCAGGC-3';AP-1,5'-CGCTTGATGACTCAGCCCGAA-3'。用[γ-32P]ATP,并在T4多聚核苷酸激酶的作用下标记探针,放射性标记探针与细胞核提取物在室温下、50 mmol/L Tris·HCl 缓冲液(pH =7.5)中共同孵育30 min。6%非变性聚丙烯酰胺凝胶电泳分离脱氧核糖核酸蛋白复合物,在干胶仪器上干燥凝胶,然后用X 光片压片检测。
1.2.4 RT-PCR 测定PPARγ mRNA 待AFs 长至亚融合状态时,以无血清DMEM 处理24 h。实验分成4 组进行:对照组,瑞舒伐他汀组(浓度为10 ×10-6mol/L),吡咯列酮组(浓度为10 ×10-6mol/L),瑞舒伐他汀+吡咯列酮组(浓度同上)。药物诱导24 h 后收集各组细胞,提取总RNA,取2 μg 逆转录为cDNA。设计PPARγ 引物序列:上游5'-TGTGAAGCCCATTGAAGACA-3',下 游5'-GAGCGGGTGAAGACTCATGT-3',扩增片段长度为199 bp。RTPCR 反应条件:95 ℃温育15 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共30 个循环;同时设GAPDH 内参基因。反应结束后取反应产物6 μL进行1.5%琼脂糖凝胶电泳。用Alphalmager 3400 Imaging 图像分析系统采集并处理电泳图,以目的基因与GAPDH 基因灰度比值代表目的基因的表达水平。实验重复3 次。
1.3统计学方法
2 结果
2.1 吡咯列酮和瑞舒伐他汀对AngⅡ诱导NADPH氧化酶的作用
见图1,与对照组相比,Ang Ⅱ显著增加NADPH氧化酶两个关键亚型p22phox和p67phox的表达(P<0.01);与AngⅡ组相比,瑞舒伐他汀单独预处理组没有明显抑制AngⅡ的这种诱导作用(P>0.05),而吡咯列酮单独预处理组明显抑制氧化酶表达(P<0.01 或P<0.05),并且该两种药物合用更显著地抑制了AngⅡ诱导的NADPH 氧化酶亚型表达(P<0.01)。
2.2 吡咯列酮和瑞舒伐他汀对AngⅡ诱导转录因子的作用
见图2,与对照组相比,AngⅡ组显著增加转录因子NF-κB 和AP-1 的活性,吡咯列酮预处理组可明显抑制NF-κB 的活性,而瑞舒伐他汀预处理组能明显抑制AP-1 的活性,吡咯列酮和瑞舒伐他汀联合使用能显著抑制AngⅡ诱导的NF-κB 及AP-1 的活性。

图2 吡咯列酮和瑞舒伐他汀对AngⅡ诱导转录因子的作用Fig 2 Ang Ⅱ-induced transcription factors and modulation by pioglitazone and rosuvastatin
2.3 瑞舒伐他汀对PPARγ 表达的影响
见图3,与对照组相比,瑞舒伐他汀与吡咯列酮单独使用或两者联合应用均能显著地增加PPARγ mRNA 的表达(P<0.01),而瑞舒伐他汀与吡咯列酮联合应用则更能明显地增强PPARγ 的表达水平(P<0.05)。
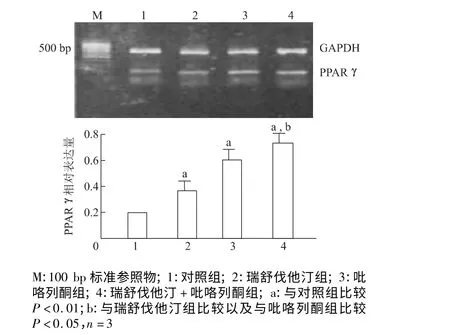
图3 瑞舒伐他汀对PPARγ mRNA 表达的影响Fig 3 The effect of rosuvastatin on PPARγ
3 讨论
随着对高血压发病机制的研究和降压药物的发展,患者血压的控制已经得到明显改善,但其伴发的心、脑、血管、肾等靶器官的损害尚未得到很好的控制,因此靶器官损害已成为高血压治疗的一个新靶点。心脏和血管的重塑是靶器官损害的共同病理基础。血管外膜成纤维细胞向内膜下迁移并增殖是血管重塑的重要发生机制之一,已知多种血管活性物质如转化生长因子β1等均可促进AF 迁移活性增强,其中AngⅡ是导致血管重构的重要因子。Reddy 等[5]报道血管外膜存在RAAS 系统,而且外膜在受到损伤刺激后血管紧张素转换酶被激活。Ang Ⅱ通过血压依赖或不依赖的途径引起炎症,并通过增强氧化应激[6]和血管通透性等机制加速心血管的重塑。
许多研究已经证实,由活性氧自由基(ROS )所导致的氧化应激(OS )是心血管疾病发生的病理生理基础的关键。许多酶可以诱导产生ROS,包括NADPH 氧化酶等,而在心血管系统中,NADPH 氧化酶是血管组织主要的氧化酶,是血管组织活性氧的主要来源,p22phox和p67phox是NADPH 氧化酶的两个关键亚型部件。有研究认为,血管外膜AFs 的NADPH 氧化酶可能是血管病变和重塑的先驱及启动者[7-8]。本研究结果表明PPARγ 激动剂吡咯列酮明显抑制AngⅡ诱导的NADPH 氧化酶亚型的表达,且两种药物合用时这种抑制作用更明显。
炎症反应在血管损伤后的修复中起到关键作用,以往一直认为血管损伤后的炎症反应是由内膜引发,并由内向外发展。但近期有研究指出在内膜增生前,外膜成纤维细胞就能合成并分泌炎症因子和趋化因子,这与其增殖、迁移以及表型转化等密切相关[9]。AFs 还可以通过释放活性氧、各种细胞因子、基质金属蛋白酶等来影响炎症反应,多种炎症因子相互作用引起外膜炎症从而影响新生内膜形成和血管重塑。本研究结果显示PPARγ 激动剂吡咯列酮明显抑制由AngⅡ刺激产生的转录因子NF-κB 的活性,瑞舒伐他汀可抑制AP-1 的活性,并且两种药物合用效果更佳,而大部分的炎症因子正是由NFκB、AP-1 等转录因子介导产生的。
有研究证明他汀类药物能够通过环氧合酶(COX )-2 等途径激活PPARγ 的表达,从而发挥抗炎作用[10]。本研究结果表明,他汀类药物联合应用PPARγ 激动剂后,与两者单独作用比较,可进一步激活PPARγ 的表达,表现出协同效应。这表明两种药物联合应用可能更有效地控制血管的氧化和炎症作用。本研究为PPARγ 激动剂和他汀类药物控制心血管病变的临床联合用药提供了理论依据。
[1]Zhou HY,Chen WD,Zhu DL,et al. The PDE1A-PKCalpha signaling pathway is involved in the upregulation of alpha-smooth muscle actin by TGF-betal in adventitial fibroblasts[J]. Vasc Res,2010,47 (1):9-15.
[2]Misra S,Fu AA,Misra KD,et al. Hypoxia-induced phenotypic switch of fibroblasts to myofibroblasts through a matrix metalloproteinase 2/tissue inhibitor of metalloproteinase-mediated pathway:implications for venous neointimal hyperplasia in hemodialysis access[J]. Vasc Interv Radiol,2010,21 (6):896-902.
[3]Das M,Burns N,Wilson SJ,et al. Hypoxia exposure induces the emergence of fibroblasts lacking replication repressor signals of PKCzeta in the pulmonary artery adventitia[J]. Cardiovasc Res,2008,78 (3):440-448.
[5]Reddy R,Chahoud G,Mehta JL. Modulation of cardiovascular remodeling with statins:fact or fictiong[J].Curr Vasc Pharmacol,2005,3 (1):69-79.
[6]Griendling KK,Sorescu D,Ushio-Fukai M. NAD(P)H oxidase:role in cardiovascular biology anddisease[J].Circ Res,2000,86(5):494501.
[7]Haurani MJ,Pagano PJ. Adventitial fiborblast reactive oxygen specis as autacrine and paracrine mediators of remodeling:Bellwether for vasculardisease?[J]. Cardiovasc Res,2007,75 (4):679-689.
[8]Chan EC,Datla SR,Dilley R,et al. Adventitial application of the NADPH oxidase inhibitor apocynin in vivo reduces neointima formation and endothelialdysfunction in rabbits[J]. Cardiovasc Res,2007,75 (4):710-718.
[9]Ji J,Xu F,Li L,et al. Activation of adventitial fiborblasts in the early stage of the aortic transplant vasculopathy in rat[J]. Transplantation,2010,89 (8):945-953.
[10]Yano M,Matsumura T,Senokuchi T,et al. Statins activate peroxisome proliferator-activated receptor γ through extracellular signal-regulated kinase 1/2 and p38 mitogen-activated protein kinase-dependent cyclooxygenase-2 expression in macrophages[J]. Circ Res,2007,100(10):1442-1451.
