类风湿关节炎患者外周血髓源性抑制细胞的检测及与Th1/Th2 细胞的相关性分析
2013-05-07许为民龚爱华王慧花盛浩王旭辉陈艳尤海燕焦志军
许为民,龚爱华,王慧,花盛浩,王旭辉,陈艳,尤海燕,焦志军
(1.江苏大学附属医院检验科,江苏 镇江212001;2.江苏大学基础医学与医学技术学院,江苏 镇江212013)
类风湿关节炎(rheumatoid arthritis,RA)是以关节和关节周围组织非感染性炎症为主的、系统性自身免疫性疾病。RA 的发病机制仍不清楚,目前认为该病的发生发展与CD4+T 细胞(Th 细胞)亚群失衡及功能异常密切相关[1-2]。髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)是一群分化成熟受阻而形成的异质细胞,可通过分泌诱导性一氧化氮合酶(iNOS)、Ⅰ型精氨酸酶(ARG-1)等抑制T 细胞的增殖和分化[3-4]。此类细胞在RA 外周血中的分布情况尚未见报道。本文拟通过流式细胞术检测RA 患者外周血中MDSCs 的比例并分析其与Th1/Th2 细胞的相关性。
1 对象与方法
1.1 研究对象
选择2012年4月至7月于江苏大学附属医院门诊及住院的RA 患者36例,其中,男4例,女32例,年龄30 ~80(51.7 ±12.0)岁。所有病例符合1987年美国风湿病学会诊断标准。根据肿胀关节数、压痛关节数、C 反应蛋白、红细胞沉降率等临床检测指标,计算DAS28 评分,分为2 组:活动组(n =20)和稳定组(n =16)。另选江苏大学附属医院健康查体人员10例作为对照组,男2例,女8例,年龄32 ~75(52.1 ±15.2)岁,无类风湿关节炎及其他自身免疫性疾病、感染、肿瘤等。以上标本获取时均取得受试者的知情同意。
1.2 主要试剂和仪器
荧光标记的抗体:CD4-PE、IFN-γ-FITC、IL-4-FITC、CD14-PEcy5、HLA-DR-FITC、CD11b-APC、CD33-PE(eBioscience);RPMI-1640、Hanks 液、PBS缓冲液、胎牛血清(Gibco);Ficoll 分离液(Lymphoprep);固定破膜剂(Beckman);流式细胞仪(BD FACS Calibur)。
1.3 标本采集
分别抽取RA 患者和健康者外周血3 mL,置于EDTA 抗凝管中。
1.4 MDSCs 膜表面标志染色
取100 μL 抗凝全血于流式管中,加入鼠抗人荧光标志CD14-PEcy5、HLA-DR-FITC、CD11b-APC、CD33-PE 各5 μL,室温避光孵育15 min。加入1 mL溶血剂,混匀,室温避光,反应10 min。PBS 洗涤,2000 r/min,离心5 min。弃上清,加入200 μL PBS,混匀,用流式细胞仪进行检测。
1.5 外周血单个核细胞( peripheral blood mononuclear cell,PBMC) 分离
取抗凝血2 mL,1500 r/min,离心5 min,吸出血浆后,加入等体积PBS 稀释、混匀,按照1 ∶1 比例,移至Ficoll 分离液中,2000 r/min,离心10 min,用吸管将白膜层移入无菌玻璃管,用PBS 洗涤,1500 r/min,离心5 min,弃去上清液。用RPMI-1640 培养液(含10%胎牛血清)调整细胞悬液密度为1 ×106/mL。
1.6 膜表面标志及胞内细胞因子染色
在PBMC 悬液中加入2 μL 佛波醇酯(50 mg/L)和1 μL 离子霉素(100 mg/L),于37 ℃和5%CO2孵育箱中培养5 h。取出刺激培养的PBMC,用PBS 离心洗涤后加入5 μL CD4-PE,涡旋混匀,室温避光孵育15 min。经洗涤、固定和破膜后将样品分成2 管,分别加入5 μL IFN-γ-FITC 和5 μL IL-4-FITC,混匀,室温避光孵育15 min。PBS 洗涤,离心,弃去上清,加入200 μL PBS,混匀,用流式细胞仪进行检测。
1.7 FCM 检测分析
以CD4+INF-γ+的表达比例表示Th1 细胞百分比,以CD4+IL-4+的表达比例表示Th2 细胞百分比,以CD14-HLA-DR-CD33+CD11b+的表达比例表示MDSCs 百分比。结果分析采用Cellquest软件。
1.8 统计学分析
实验数据采用GraphPad Prism 5.0 软件进行分析,多组间均数比较采用单因素方差分析,进一步两两比较采用LSD-t 检验。相关性分析采用Spearman检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 RA 患者外周血MDSCs 的比例
以CD14-HLA-DR-CD33+CD11b+作为外周血MDSCs 的表面标志,采用流式细胞术四色标志检测36例RA 患者外周MDSCs 比例,结果显示,活动组RA 患者外周血中MDSCs 比例(61.14 ±2.68)%明显高于稳定组(48.29 ±3.96)%和对照组(46.91 ±5.01)%(P 均<0.05);稳定组虽略高于对照组,但差异无统计学意义(P>0.05),见图1。
2.2 RA 患者外周血MDSCs 与Th1、Th2 细胞的相关性
在检测MDSCs 的同时,我们检测了外周血中Th1、Th2 细胞的比例,经Spearman 相关分析,结果显示,MDSCs 比例与Th1 细胞比例呈负相关(r =-0.424,P=0.0219),而与Th2 细胞比例无明显相关性(r=-0.213,P>0.05),见图2。
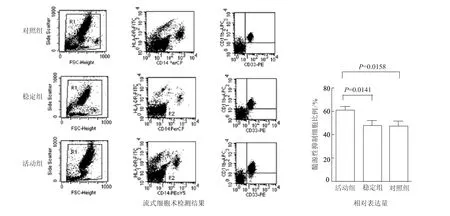
图1 类风湿关节炎患者外周血中髓源性抑制细胞的检测结果Fig 1 Detection of myeloid-derived suppressor cells in peripheral blood from patients with rheumatoid arthritis

图2 类风湿关节炎患者外周血MDSCs 与Th1、Th2细胞的相关性分析Fig 2 The correlations between myeloid-derived suppressor cells and Th1/Th2 cell in peripheral blood from patients with rheumatoid arthritis
3 讨论
MDSCs 是一群具有强免疫抑制功能的异质细胞,通过分泌iNOS、ARG-1、活性氧等产物抑制T 细胞增殖活化,促进T 细胞凋亡,减弱机体的免疫监视功能,从而成为机体抗肿瘤免疫的最主要障碍。MDSCs在自身免疫性疾病中也发挥作用,如Zhu 等[5]、Slaney 等[6]通过对实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)动物模型的研究发现,MDSCs 能够发挥免疫抑制作用,缓解EAE 的症状。这一发现使MDSCs 成为近年来研究自身免疫性疾病的新热点。
本研究结果显示,活动组MDSCs 的比例明显高于稳定组和对照组,而稳定组虽然在总体上略高于对照组,但是差异无统计学意义。结果表明,RA 患者外周血中MDSCs 的比例增高,尤其在活动期更为明显。在急慢性炎症患者和动物模型中(如肿瘤[7-8]、急性移植排斥反应[9]以及自身免疫性疾病[5-6,10]),MDSCs 均有显著增高,这与本文的研究结果相一致,说明MDSCs 在炎症状态下显著增多,检测其比例可作为炎性活动的评估指标。
根据上述结果,我们推测RA 外周血MDSCs 增多的可能原因如下。在炎症状态下,大量活化的T细胞亚群、异常增多的炎性因子和趋化因子,通过各种途径,传递信号至骨髓,使得骨髓造血干细胞和祖细胞大量增殖,并且将尚未分化成熟的MDSCs 提前释放入血,当病情稳定以后,由于炎性细胞因子的水平降低,可能刺激招募MDSCs 的信号减弱,所以MDSCs 的比例也逐渐降低。
在本研究中,我们发现RA 患者的病情越严重,MDSCs 的比例越高,增多的MDSCs 似乎未能有效抑制其病情。我们推测可能随着病情的加重,炎症局部的炎性因子水平过高,MDSCs 的抑制能力无法与其抗衡;或者致炎细胞及其分泌的细胞因子阻碍MDSCs 进入炎性局部发挥抑制作用;或者MDSCs 只是受到炎性信号的反馈刺激,仅仅表现为数量上的增多,并无抑制功能;或者MDSCs 本身就是一把双刃剑,在不同的疾病中,扮演不同的角色,促炎或是抑炎。King 等[11]和Milder 等[12]研究表明,内源性的MDSCs 并不能抑制自身免疫性疾病的发展,甚至会加重病情。所以,在后续实验中,我们将进一步研究MDSCs 在RA 中的具体功能。
CD4+T 细胞的大量浸润及其亚群的平衡失调是RA 发病机制的一个重要环节[1-2]。经相关性分析发现,MDSCs 比例与Th1 细胞比例呈负相关,而与Th2细胞比例无明显相关性,表明在RA 患者体内,MDSCs 和Th1 细胞功能可能是互相拮抗的,MDSCs 对体内Th1/Th2 平衡的调节主要在于对Th1 细胞功能的抑制。体外研究[13-14]表明,MDSCs 可抑制Th1 细胞的分化与功能的发挥。此外,Chou 等[15]指出,MDSCs能促进调节性T 细胞(regulatory T celll,Treg)的增殖与分化,降低移植胰岛的排斥反应,促进移植物存活。在RA 中,MDSCs 抑制功能的发挥也可能与Treg 细胞有关,值得进一步研究。
总之,本研究表明,RA 患者外周血中MDSCs 比例增高,且与Th1 细胞呈负相关,有关MDSCs 细胞的功能及其与T 细胞亚群的作用机制有待进一步探讨。
[1]Jadidi-Niaragh F,Mirshafiey A. Regulatory T-cell as orchestra leader in immunosuppression process of multiple sclerosis[J]. Immunopharmacol Immunotoxicol,2011,33(3):545-567.
[2]Klareskog L,Catrina AI,Paget S. Rheumatoid arthritis[J]. Lancet,2009,373 (9664):659-672.
[3]Cripps JG,Gorham JD. MDSC in autoimmunity[J]. Int Immunopharmacol,2011,11 (7):789-793.
[4]Gabrilovich DI,Nagaraj S. Myeloid-derived suppressor cells as regulators of the immune system[J]. Nat Rev Immunol,2009,9(3):162-174.
[5]Zhu B,Bando Y,Xiao S,et al. CD11b+Ly-6Chisuppressive monocytes in experimental autoimmune encephalomyelitis[J]. J Immunol,2007,179(8):5228-5237.
[6]Slaney CY,Toker A,La Flamme A,et al. Naïve blood monocytes suppress T-cell function. A possible mechanism for protection from autoimmunity[J]. Immunol Cell Biol,2011,89(1):7-13.
[7]Gonda K,Shibata M,Ohtake T,et al. Myeloid-derived suppressor cells in patients with breast cancer[J]. Gan To Kagaku Ryoho,2012,39(9):1363-1368.
[8]Sun HL,Zhou X,Xue YF,et al. Increased frequency and clinical significance of myeloid-derived suppressor cells in human colorectal carcinoma[J]. World J Gastroenterol,2012,18(25):3303-3309.
[9]Mougiakakos D,Jitschin R,von Bahr L,et al. Immunosuppressive CD14+HLA-DRlow/negIDO+myeloid cells in patients following allogeneic hematopoietic stem cell transplantation[J]. Leukemia,2013,27(2):377-388.
[10]Iwata Y,Furuichi K,Kitagawa K,et al. Involvement of CD11b+GR-1lowcells in autoimmunedisorder in MRLFas lpr mouse[J]. Clin Exp Nephrol,2010,14(5):411-417.
[11]King IL,Dickendesher TL,Segal BM. Circulating Ly-6C+ myeloid precursors migrate to the CNS and play a pathogenic roleduring autoimmunedemyelinatingdisease[J]. Blood,2009,113(14):3190-3197.
[12]Mildner A,Mack M,Schmidt H,et al.CCR2+Ly-6Chi monocytes are crucial for the effector phase of autoimmunity in the central nervous system[J]. Brain,2009,132(Pt 9):2487-2500.
[13]Wang L,Chang EW,Wong SC,et al. Increased myeloid-derived suppressor cells in gastric cancer correlate with cancer stage and plasma S100A8/A9 proinflammatory proteins[J]. J Immunol,2013,190(2):794-804.
[14]Zheng Y,Xu M,Li X,et al. Cimetidine suppresses lung tumor growth in mice through proapoptosis of myeloid-derived suppressor cells[J]. Mol Immunol,2013,54(1):74-83.
[15]Chou HS,Hsieh CC,Charles R,et al. Myeloid-derived suppressor cells protect islet transplants by B7-H1 mediated enhancement of T regulatory cells[J]. Transplantation,2012,93(3):272-282.
