抑郁症患者海马氢质子磁共振波谱分析
2013-05-07包和华李国海李一云马海波王冬青张礼荣
包和华,李国海,李一云,马海波,王冬青,张礼荣
(江苏大学附属第四医院心理卫生中心,江苏镇江212001;2.江苏大学附属医院磁共振中心,江苏 镇江212002)
抑郁症是一类严重影响人类心理健康的慢性精神疾病,病因和病理机制不明,发病率高,治愈率低,治疗困难,预后相对较差。精神障碍所致全球疾病负担排名显示,单相重度抑郁症所致的疾病负担最重。因此,抑郁症发病机制的阐明,将有助于临床上寻求其治疗的积极有效措施。本研究利用3.0 T 磁共振对抑郁症患者海马进行多体素氢质子磁共振波谱(1H magnetic resonance spectroscopy,1H-MRS)分析,探讨抑郁症发病的生化机制。
1 对象与方法
1.1 对象
收集2011年8月至2012年1月在江苏大学附属四院精神科治疗的抑郁症患者13例,作为抑郁症组。其中,男2例,女11例;平均年龄(35±8)岁;平均受教育时间(12±3)年;汉密尔顿抑郁量表(HAMD)平均得分(29±4)分;平均病程(184±113)天。
选择志愿参加本研究的职工及其家属13例,作为对照组。其中,男3例,女10例;平均年龄(34 ±6)岁;平均受教育时间(15±4)年;HAMD 得分<8 分。
入选标准:抑郁症组为初发抑郁症或因停止抗抑郁治疗导致复发的抑郁症患者,符合美国精神障碍与诊断手册第4 版(DSM-IV)抑郁症诊断标准,所有患者入组时24 项HAMD 得分>20 分,均未服用抗抑郁剂,复发患者停止抗抑郁治疗至少1 个月。对照组无精神分裂症、心境障碍、焦虑障碍、进食障碍、精神发育迟滞等精神疾病史;无颅脑外伤及严重的躯体疾病和脑器质性疾病史;无精神活性物质滥用史或非精神活性物质中毒史;一级亲属中无精神分裂症、心境障碍及其他严重性精神疾病史。
比较两组受试者性别、年龄和受教育年限,差异无统计学意义,具有可比性(P>0.05)。本研究受试者均为右利手,对本研究内容知情,并签署知情同意书。
1.2 方法
1.2.11H-MRS 检查及数据采集 抑郁症组治疗前作HAMD 评定,给予选择性5-羟色胺再摄取抑制剂进行抗抑郁治疗,为期6 周,治疗末再次行HAMD评定。在抗抑郁治疗前和治疗后分别行1H-MRS 检查,对照组只行1 次1H-MRS 检查。
采用西门子公司3.0 T 超导磁共振成像系统(Magnetom Trio Tim,Siemens),首先以SE 序列行MRI 常规扫描排除脑部病变,并为1H-MRS 定位,本研究采用三轴定位。定位后选定感兴趣区(16 ×16),体素1 cm×1 cm×1.5 cm,避开颅骨、脂肪、气腔及脑脊液等结构,并使用饱和带,避免周围组织对检查结果的影响。体素内匀场、水抑制均由扫描程序自动完成。采用多体素(Multi voxel imaging,MVS)3D-CSI(chemical shift image)序列进行1HMRS 扫描,重复时间1700 ms,回复时间135 ms。
1.2.2 资料处理 扫描完成后使用随机LEONARDO 程序进行基线校正和相位校正。测定的生化物质为N-乙酰天门冬氨酸(NAA)、谷氨酸-谷氨酰胺复合物(GLx)、胆碱复合物(Cho)、肌醇(mI)、肌酸(Cr)。以Cr 为内对照,以NAA、Glx、Cho、mI 与Cr的比值作为NAA、Glx、Cho、mI 的含量。
1.3 统计学分析
用SPSS 17.0 软件进行统计学处理,计量资料用均数±标准差(+s)表示;两组间均数比较采用t检验,以P<0.05 为差异统计学意义。
2 结果
2.1 治疗前海马各生化指标的比较
抑郁症组双侧海马NAA/Cr 值均明显低于对照组(P均为0.000);抑郁症组Glx、Cho、mI 的含量与对照组比较,差异无统计学意义(P均>0.05),见表1。
表1 治疗前海马各生化指标的比较±sTab 1 Comparison ofdifferent metabolites in hippocampus before treatment between two groups
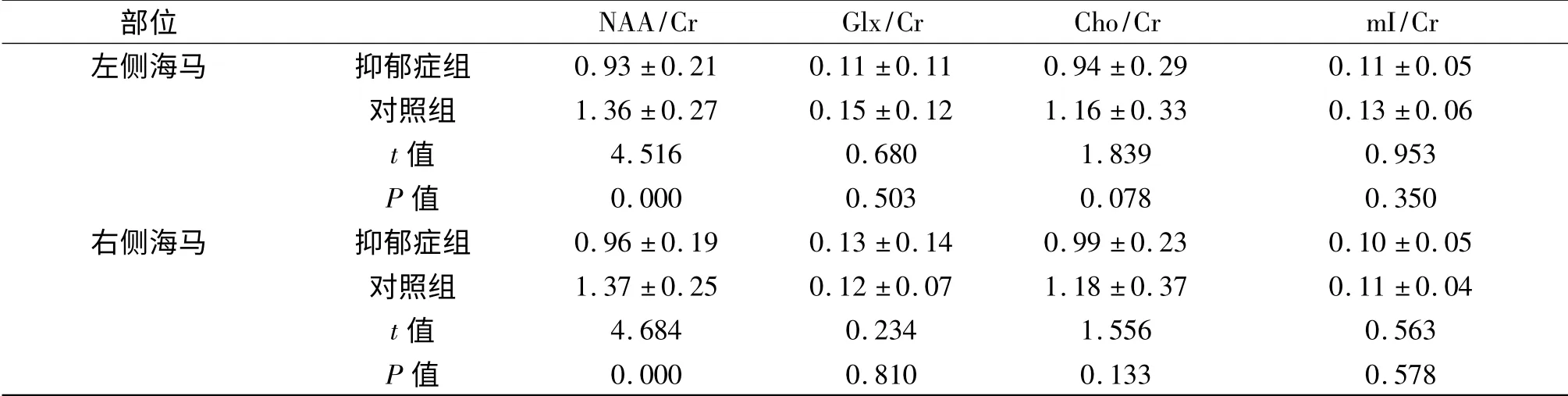
表1 治疗前海马各生化指标的比较±sTab 1 Comparison ofdifferent metabolites in hippocampus before treatment between two groups
部位NAA/Cr Glx/Cr Cho/Cr mI/Cr左侧海马 抑郁症组0.93 ±0.21 0.11 ±0.11 0.94 ±0.29 0.11 ±0.05对照组 1.36 ±0.27 0.15 ±0.12 1.16 ±0.33 0.13 ±0.06 t 值 4.516 0.680 1.839 0.953 P 值 0.000 0.503 0.078 0.350右侧海马 抑郁症组 0.96 ±0.19 0.13 ±0.14 0.99 ±0.23 0.10 ±0.05对照组 1.37 ±0.25 0.12 ±0.07 1.18 ±0.37 0.11 ±0.04 t 值 4.684 0.234 1.556 0.563 P 值0.000 0.810 0.133 0.578
2.2 抗抑郁治疗前后海马各生化指标的比较
抗抑郁治疗后,左、右两侧海马各生化指标与治疗前比较,差异均无统计学意义(P均>0.05)。见表2。
表2 抑郁症患者治疗前后海马各生化指标的比较±sTab 2 Comparison of metabolites in hippocampus between before and after treatment
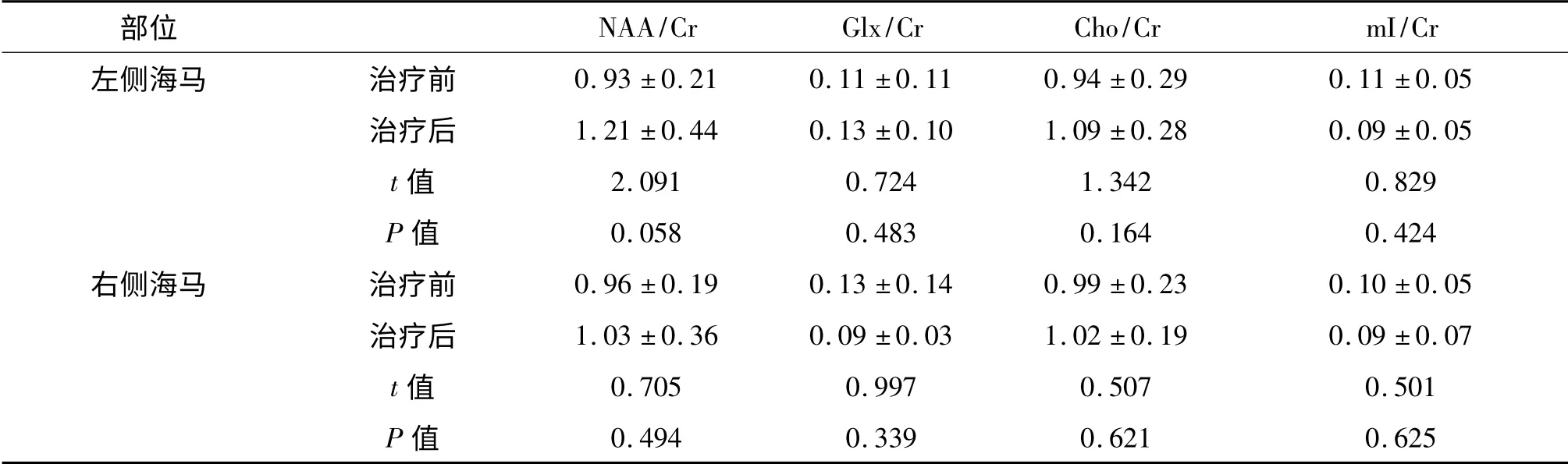
表2 抑郁症患者治疗前后海马各生化指标的比较±sTab 2 Comparison of metabolites in hippocampus between before and after treatment
部位NAA/Cr Glx/Cr Cho/Cr mI/Cr左侧海马 治疗前0.93 ±0.21 0.11 ±0.11 0.94 ±0.29 0.11 ±0.05治疗后 1.21 ±0.44 0.13 ±0.10 1.09 ±0.28 0.09 ±0.05 t 值 2.091 0.724 1.342 0.829 P 值 0.058 0.483 0.164 0.424右侧海马 治疗前 0.96 ±0.19 0.13 ±0.14 0.99 ±0.23 0.10 ±0.05治疗后 1.03 ±0.36 0.09 ±0.03 1.02 ±0.19 0.09 ±0.07 t 值 0.705 0.997 0.507 0.501 P 值0.494 0.339 0.621 0.625
2.3 治疗前后海马各生化指标的变化值与HAMD变化分值的相关性分析
结果显示,治疗前与治疗后海马各生化指标的变化值与HAMD 评分减分值均无明显相关性。见表3。

表3 治疗前后海马代谢物的变化值与HAMD 变化分值的相关性Tab 3 Correlation between hippocampus metabolites and Hamilton Depression Scale scores before and after treatment
3 讨论
海马与记忆、注意及情绪相关,也是应激损伤的主要易感部位[1],重度抑郁症患者的海马体积缩小。我们曾对海马头、体、尾三个部位体积分别进行研究,结果显示,抑郁症患者两侧海马及其尾部的体积均小于健康对照者,提示海马体积缩小与抑郁症的发生有关[2]。在此基础上,对抑郁症患者的海马功能状况进行研究是非常有必要的。但是,关于抑郁症患者海马生化代谢的MRS 研究还很少。
本研究发现,抑郁症患者双侧海马NAA/Cr 值均较对照组降低,与林铮等[3]研究结果(左侧海马NAA/Cr 值降低)部分一致。Frey 等[4]研究发现,双相障碍患者海马NAA 水平也降低,经心境稳定剂治疗后可恢复到正常水平。但也有一些研究[5-6]发现,抑郁症初发者海马NAA 水平与健康对照者比较,差异无统计学意义。NAA 是一种在神经元内合成的氨基酸,只存在于神经元和突触,可作为神经元完整性、发育能力及活力的指标。其水平降低,提示神经元丧失,神经元代谢功能异常。因此,本研究结果提示,抑郁症患者海马神经元活力降低,存在神经元的丧失,神经元代谢功能异常,且该异常在抑郁症的早期就已存在;与前文提及抑郁症患者的海马体积缩小相吻合。本研究未发现抑郁症初发者Cho 的含量有显著改变,与部分研究[5-6]结果一致。Milne等[6]发现,虽然抑郁症初发者Cho 水平无改变,但抑郁症反复发作者Cho 水平却升高,提示Cho 的改变可能与病程相关,抑郁症反复发作时病理损害更严重。Glx 是兴奋性氨基酸的标志物。本研究未发现抑郁症患者双侧海马Glx 的含量有改变,与Milne等[6]研究结果相符。Block 等[5]发现,抑郁症患者治疗后双侧海马Glx 的含量较治疗前降低,但差异无统计学意义。肌醇是神经胶质细胞的标志物。本研究发现抑郁症初发者肌醇的含量无改变,与Block等[5]结果一致;Milne 等[6]发现抑郁症初发者肌醇升高,与之矛盾。
本研究未发现抗抑郁治疗后各项生化指标有显著改变,与Block 等[5]结果相符,但Gonul 等[7]却发现,抗抑郁治疗症状改善后,NAA 水平升高。虽然本研究未发现NAA 治疗前与治疗后的差异有统计学意义,但结果显示,左侧海马NAA 水平有升高的趋势(P=0.058)。相关分析结果显示,治疗前与治疗后海马各生化指标的变化与抑郁症状的改善无明显相关性,与前述结果相吻合。但也有研究[5]发现,抗抑郁治疗的疗效与NAA 水平升高相关,提示抑郁症患者大脑生化代谢的异常是特性标志还是状态标志还需进一步研究。
目前,关于抑郁症MRS 研究的结果还不一致,可能与诸多因素有关:①混杂因素,包括药物的作用、病期、共病、性别等影响,特别是还没有标准化的最佳的定量方法;定量方法有差异,这样对不同的研究结果进行比较就有困难。②现有的MRS 所能测定的化学物质还较少,一些关键物质,如多巴胺、5-羟色胺、去甲肾上腺素等神经递质还测不出[8]。因此,虽然MRS 是检测活体组织器官能量代谢、生化改变以及化合物相对含量的一种非创伤性检测技术,但要阐明抑郁症发生的生化机制,还需要做大量的工作。如果MRS 能明确抑郁症的生化标志,则可作为临床诊断的客观指标并有助于发现药物治疗的新靶点。
本研究样本量较小,如果能扩大样本量,按抗抑郁治疗后的疗效进行分组,再比较不同疗效的抑郁症患者之间神经生化改变的差异,将有助于找到预测疗效的生化标志,从神经生化的角度做到治疗的个体化。
[1]申变红,李国海.情感障碍脑磁共振质子波谱研究现状[J].国际精神病学杂志,2009,36(3):154-157.
[2]李月峰,罗香,王冬青,等.女性抑郁状态患者海马形态体积的变化[J]. 中华精神科杂志,2010,43(1):37-41.
[3]林铮,李惠春,龚向阳,等. 抑郁症患者前额叶、海马磁共振质子波谱成像的研究[J]. 中华精神科杂志,2005,38(4):193-197.
[4]Frey BN,Andreazza AC,Nery FG,et al. The role of hippocampus in the pathophysiology of bipolardisorder[J]. Behav Pharmaco,2007,18(5/6):419-430.
[5]Block W,Tr ber F,von Widdern O,et al. Proton MR spectroscopy of the hippocampus at 3T in patients with unipolar majordepressivedisorder:correlates and predictors of treatment response[J]. Int J Neuropsychopahrmacol,2009,12(3):415-422.
[6]Milne A,MacQueen GM,Yucel K,et al. Hippocampal metabolic abnormalities at first onset and with recurrent episodes of a majordepressivedisorder :a proton magnetic resonance spectroscopy study[J]. Neuroimage,2009,47(1):36-41.
[7]Gonul AS,Kitis O,Ozan E,et al. The effect of antidepressant treatment on N-acetyl aspartate levels of medial frontal cortex indrug-freedepressed patients[J]. Prog Neuropsychopharmacol Biol Psychiatry,2006,30(1):120-125.
[8]Kondo DG,Hellem TL,Sung YH,et al. Review:magnetic resonance spectroscopy studies of pediatric majordepressivedisorder[J]. Depress Res Treat,2011,2011:650450.
