西地那非对胃癌移植瘤小鼠髓源抑制细胞免疫活性的调节作用
2013-05-07蒋健张尤历徐萍朱立宁蒋晓猛徐岷
蒋健,张尤历,徐萍,朱立宁,蒋晓猛,徐岷
(江苏大学附属医院消化内科,江苏镇江212001)
近年来研究发现,在荷瘤小鼠脾脏、血液及肿瘤组织或者肿瘤患者外周血及肿瘤组织中聚集有大量的未成熟髓源抑制细胞(myeloidderived suppressor cells,MDSCs),它可以通过多种机制参与肿瘤的免疫逃逸,促进肿瘤细胞生长[1]。西地那非是磷酸二酯酶5(PDE5)抑制剂,能抑制荷瘤小鼠中MDSC 介导的免疫抑制效应,增强机体抗肿瘤免疫,抑制肿瘤生长[2]。本研究建立小鼠胃癌皮下移植瘤模型,检测荷瘤小鼠外周血MDSC、CD4+、CD8+细胞亚群的比例变化,观察西地那非对荷瘤小鼠的抗肿瘤作用,及对MDSC 免疫活性的影响,探讨西地那非在抗肿瘤免疫机制方面所发挥的作用以及MDSC 在胃癌免疫逃逸中的作用机制。
1 材料与方法
1.1 主要材料
1.1.1 实验动物 健康615 近交系小鼠18 只,SPF级,鼠龄6 ~8 周,雌性,体质量20 ~25 g(购自中科院天津血液病研究所,合格证号:SCXK 津2009-0002),饲养于江苏大学实验动物中心。
1.1.2 细胞株 小鼠前胃癌细胞株MFC(购自中科院上海生命科学院)。
1.1. 3 主要试剂 RPMI1640 培养基、小牛血清(Gibco 公司,美国),FITC-anti-CD11b、PE-anti-Gr-1、anti-CD16/CD32、PE-anti-CD3、PE/Cy5-anti-CD8、FITC-anti-CD4 以及同型对照抗体(eBioscience 公司,美国),西地那非(Pfizer,美国)。
1.2 荷瘤小鼠模型构建
收集处于对数生长期的MFC 细胞,用1×PBS 调整细胞密度为1 ×107个/mL,取0.2 mL 细胞悬液皮下注射至615 小鼠的右侧背部。建立皮下肿瘤模型。选择接种后7 ~10d,肿瘤生长旺盛且无溃破的动物,脱颈处死后消毒操作部位皮肤然后切开,选择生长良好的瘤组织置于无菌平皿内(平皿内放置少许生理盐水或细胞培养液)。将肿瘤组织剪成2 ~3 mm3的小块,向无菌套管内塞入一小块,接种于健康动物前腋窝皮下,接种后小鼠自由饮食饮水饲养,观察成瘤后,每隔3d 用游标卡尺测量肿瘤的大小,记录并绘制肿瘤生长曲线,肿瘤体积按照公式V=ab2/2计算,a 为肿瘤的最长径,b 为垂直径,长度单位mm。
1.3 分组及用药
将18 只6 周龄雌性615 小鼠随机分成3 组(每组6 只):正常对照组、荷瘤PBS 组和荷瘤西地那非组。建立MFC 荷瘤小鼠模型,接种移植瘤24 h 后荷瘤西地那非组每天给予西地那非灌胃(20 mg/kg),荷瘤PBS 组每天给予等体积的PBS 灌胃。28d 后(肿瘤生长至直径1 ~2 cm 时),摘眼球取外周血约0.4 mL 左右,处死小鼠,再剥离肿瘤、称重,计算抑瘤率,公式:(荷瘤PBS 组小鼠平均瘤重-荷瘤西地那非组小鼠平均瘤重)/(荷瘤PBS 组小鼠平均瘤重)。
1.4 流式细胞术检测细胞比例
1.4.1 MDSC 比例 取外周血100 μL 加入到流式管中,每个管中加入CD16/CD32(1 μg/mL)冰上封闭20 min,PBS 洗涤后依次加入抗体荧光标记抗体FITC-anti-CD11b、PE-anti-Gr-1 各2 μL,2 ~8 ℃避光孵育30 ~60 min。加入2 mL 1 ×红细胞裂解液,轻柔混合后避光室温孵育10 min,PBS 洗涤后适量流式染色缓冲液重悬染色细胞并流式分析。
1.4.2 CD4+、CD8+淋巴细胞比例 取外周血100 μL 加入到流式管中,每个管中加入荧光标记抗体CD3-PE、CD4-FITC、CD8-PE/Cy5 各2 μL,2 ~8 ℃避光孵育30 ~60 min。加入2 mL 1 ×红细胞裂解液,轻柔混合后避光室温孵育10 min,PBS 洗涤后适量流式染色缓冲液重悬染色细胞并流式分析。
1.5 统计学处理
采用SPSS 19.0 统计软件进行处理,计量数据用均数±标准差(±s)表示,采用两独立样本t 检验进行比较,P<0.05 为差异有统计学意义。采用Pearson相关分析,P<0.05 为差异有统计学意义。
2 结果
2.1 胃癌MFC 荷瘤小鼠肿瘤生长情况
615 小鼠在胃癌移植瘤接种后每隔3d 测量肿瘤体积,第6 天左右开始可在体外触及米粒至黄豆大小的肿块,第18 天后随着肿块继续增大,小鼠开始出现不同程度的消瘦、竖毛、精神不振、活动量减少,成瘤率为100%。
2.2 西地那非对荷瘤小鼠肿瘤生长的影响
西地那非能显著抑制荷瘤小鼠肿瘤生长,615小鼠的肿瘤生长曲线如图1。荷瘤PBS 组小鼠和荷瘤西地那非组小鼠肿瘤的平均质量分别为(2.78 ±0.57)g、(1.64 ±0.15)g,两组小鼠肿瘤体质量之间的差异有统计学意义(t =4.779,P<0.05)。西地那非组干预28 天后的抑瘤率为41.2%。

图1 615 荷瘤小鼠的肿瘤生长曲线Fig 1 Tumor growth curve of 615 tumor-bearing mice
2.3 西地那非对荷瘤小鼠外周血MDSC、CD4+、CD8+T 细胞比例的影响
流式细胞仪检测结果显示,荷瘤PBS 组比正常对照组小鼠外周血MDSC 比例升高(P<0.05),而荷瘤西地那非组比荷瘤PBS 组小鼠外周血MDSC 的比例下降(P<0.05)。见表1、图2。荷瘤PBS 组比正常对照组小鼠外周血CD4+/CD8+比值下降(P<0.05),荷瘤西地那非组比荷瘤PBS 组小鼠外周血CD4+/CD8+的比值升高(P<0.05)。见图2、表1。
2.4 MDSC 比例与CD4+ /CD8+比值相关性分析
采用Pearson 相关分析发现,在荷瘤小鼠的外周血中MDSC 比例与CD4+/CD8+比值存在显著负相关(r=-0.858,P<0.01)。见图3。
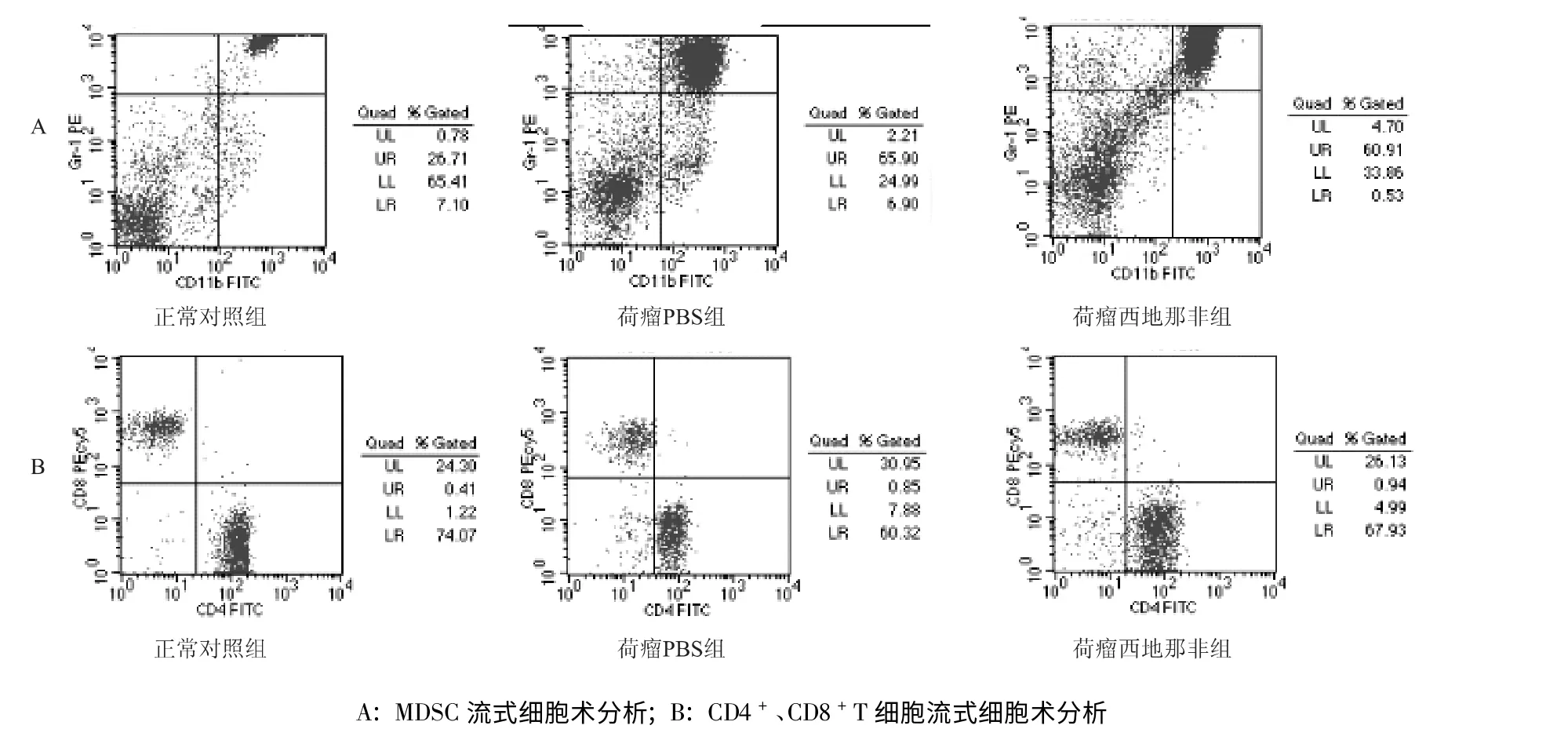
图2 MDSC、CD4 +、CD8 +T 细胞比例流式细胞术分析Fig 2 Percentages of circulating MDSC、CD4 +T and CD8 +Tdetermined by flow cytometry
表1 各组外周血MDSC、T 淋巴细胞亚群检测结果±sTab 1 Test results of circulating MDSC and T lymphocyte subsets in all groups

表1 各组外周血MDSC、T 淋巴细胞亚群检测结果±sTab 1 Test results of circulating MDSC and T lymphocyte subsets in all groups
与正常对照组比较,a:P<0.05;与荷瘤PBS 组比较,b:P<0.05
分组 MDSCs 比例∕% CD4 +∕% CD8 +∕% CD4 +/CD8+25.75 ±4.49 74.72 ±3.45 22.53 ±2.96 3.33 ±0.66荷瘤PBS 组 67.10 ±4.11a 55.83 ±7.00a 38.71 ±7.45a 1.52 ±0.44a荷瘤西地那非组 55.92 ±5.76b 65.60 ±2.04b 29.24 ±2.28b 2.26 ±0.24正常对照组b
3 讨论
MDSC 是一群异质细胞,来源于骨髓祖细胞和未成熟髓细胞,可在肿瘤来源因子(TDFs)的作用下,通过多种机制抑制宿主抗肿瘤免疫,促进肿瘤的发生和发展。荷瘤小鼠体内的MDSC 共表达髓系分化抗原Gr1 和CD11b(即Gr1+CD11b+细胞),正常小鼠脾脏内Gr1+CD11b+细胞数量很少,但在荷瘤小鼠脾脏内Gr1+CD11b+细胞数量可以高达80%[3]。MDSC 参与诱导免疫耐受的机制为通过表达高水平的精氨酸酶1(ARG-1)、诱导型一氧化氮合酶(iNOS)和活性氧(ROS),抑制T 细胞介导的抗肿瘤免疫[4-5]。最近研究显示MDSCs 表达的整合素-金属蛋白酶7 能下调T 细胞表达L-选择素,T 细胞不能有效迁移到能够接受肿瘤抗原刺激的淋巴结,导致活化的CD4+和CD8+T 细胞数量减少[6]。在荷瘤小鼠体内表现出CD4+T 细胞减少、CD8+T细胞增加、CD4+/CD8+比值下降,此种现象也同时存在于胃癌患者的外周血中,并已经得到验证[7]。本研究发现在荷瘤小鼠外周血中MDSC 的比例较正常对照组升高,西地那非干预后其比例下降。

图3 荷瘤小鼠外周血中MDSC 比例与CD4 + /CD8 +比值相关性Fig 3 Correlation of MDSC proportion and CD4 + /CD8 +ratio in the tumor-bearing peripheral blood
西地那非是磷酸二酯酶5(PDE5)抑制剂,能下调ARG-1 和iNOS-2 的表达,抑制MDSC 介导的免疫抑制效应,同时增加肿瘤部位激活的T 细胞的数量,减缓肿瘤生长速度,促进T 细胞抗肿瘤效应[8]。在黑色素瘤模型中,西地那非可以通过抑制炎症介质IL-1β、IL-6、VEGF、S100A9 的分泌降低MDSC 数量,削弱MDSC 免疫抑制作用,提示西地那非有抗炎作用[9]。
本研究将MFC 胃癌细胞接种到615 小鼠背部皮下,建立小鼠皮下荷瘤模型,成瘤24 h 后给予西地那非灌胃,28d 后测量肿瘤体积,流式细胞仪检测外周血MDSC 及CD4+/CD8+比例变化,结果显示荷瘤小鼠比正常对照组小鼠外周血MDSC 比例升高,而西地那非干预后MDSC 的比例下降。荷瘤小鼠比正常对照组小鼠外周血CD4+/CD8+比例下降,西地那非干预后CD4+/CD8+的比例升高,表明胃癌移植瘤小鼠体内的肿瘤细胞可能通过诱导外周血MDSC 比例升高,致CD4+、CD8+T 细胞亚群比例失调从而抑制T细胞免疫。西地那非可抑制胃癌移植瘤小鼠肿瘤生长,并可能通过降低荷瘤小鼠外周血MDSC 的比例,提高外周血CD4+/CD8+的比例,削弱MDSC 的免疫抑制作用,部分恢复T 细胞免疫功能,延缓肿瘤生长。综上所述,MDSC 在肿瘤的发生发展中起重要的作用,西地那非可能通过抑制MDSC 数量,调节T 细胞亚群的比例,增强抗肿瘤免疫,发挥抑制肿瘤生长的作用。
[1]Ko JS,Bukowski RM,Fincke JH. Myeloid-derived suppressor cells:a novel therapeutic target[J]. Curr Oncol Rep,2009,11(2):87-93.
[2]Serafini P,Mgebroff S,Noonan K,et al. Myeloid-derived suppressor cells promote cross-tolerance in B-cell lymphoma by expanding regulatory T cells[J]. Cancer Res,2008,68(13):5439-5449.
[3]Sica A,Bronte V. Altered macrophagedifferentiation and immunedysfunction in tumordevelopment[J]. J Clin Invest,2007,117(5):1155-1166.
[4]Gabrilovich DI,Nagaraj S. Myeloid-derived suppressor cells as regulators of the immune system[J]. Nat Rev Immunol,2009,9(3):162-174.
[5]Rodriguez PC,Quiceno DG,Ochoa AC. L-arginine availability regulates T-lymphocyte cell-cycle progression[J]. Blood,2007,109(4):1568-1573.
[6]Hanson EM,Clements VK,Sinha P,et al. Myeloid-derived suppressor cellsdown-regulate L-selectin expression on CD4+and CD8+T cells[J]. J Immunol,2009,183(2):937-944.
[7]朱立宁,徐岷,张尤历,等. 幽门螺杆菌感染诱导髓源抑制细胞在胃癌发生中的作用[J]. 江苏医药,2012,38(12):1404-1406.
[8]Serafini P,Meckel K,Kelso M,et al. Phosphodiesterase-5 inhibition augments endogenous antitumor immunity by reducing myeloid-derived suppressor cell function[J]. J Exp Med,2006,203(12):2691-2702.
[9]Meyer C,Sevko A,Ramacher M,et al. Chronic inflammation promotes myeloid-derived suppressor cell activation blocking antitumor immunity in transgenic mouse melanoma model[J]. Proc Natl Acad Sci U S A,2011,108(41):17111-17116.
