TBHQ 对不同饱和程度油脂的抗氧化性能比较研究
2013-04-23刘翠芳毕艳兰刘太宇侯团伟杨国龙朱生辉马传国
刘翠芳,毕艳兰,刘太宇,侯团伟,杨国龙,朱生辉,马传国
(河南工业大学 粮油食学院,河南 郑州 450001)
0 引言
受油脂本身结构及自然环境温湿度、光线、空气等因素的影响,油脂及富油食品在生产、加工、贮藏中易发生酸败变质[1-3].目前认为预防和延缓油脂氧化酸败最有效的方法是添加外源抗氧化剂,而叔丁基对苯二酚(TBHQ)作为一种相对低毒、高效的抗氧化剂,被广泛应用于油脂及富油食品的抗氧化中[4-6].
目前,国内外学者对TBHQ 在各种常见动植物油脂中的抗氧化效果及其与其他抗氧化剂的差异性和协同作用已有深入和广泛的研究,证实了TBHQ 相对优越的抗氧化性能[7-10].但是在相关研究中,有学者发现TBHQ 对不同油脂显现出不同的抗氧化保护作用.例如,郭祀远等[11]在研究TBHQ的应用时,发现其对棕榈油、花生油和猪油的抗氧化保护作用具有差异性.经查阅资料发现,对于TBHQ 在不同种类油脂中的抗氧化性能的差异性尚未有学者进行系统的研究.因此,本研究着重从饱和度的角度研究TBHQ 对不同种类植物油的抗氧化保护作用的差异.
将TBHQ 按一定比例添加到大豆油、棕榈油、茶油、红花籽油、亚麻籽油5 种植物油中,采用氧化酸败仪法比较研究TBHQ 对不同饱和程度植物油的抗氧化保护性能的差异,并分析差异存在的原因,为在不同油脂中合理添加TBHQ 提供科学依据.
1 材料与方法
1.1 材料
一级大豆油:山东香驰粮油有限公司;棕榈油(33 ℃):中储粮镇江粮油有限公司;茶油:湖南金浩茶油股份有限公司;红花籽油:酒泉市肃州区新地新一油坊;亚麻籽油:呼和浩特市蒙谷香生物科技有限公司.以上油样均未添加任何外源抗氧化剂及其他营养强化物质.
1.2 仪器
743Rancimat 食用油脂氧化稳定性测定仪:瑞士万通公司;Agilent 6890N 型气相色谱仪:美国Agilent 公司;BS201S 型微量电子天平:北京赛多利斯天平有限公司.
1.3 试剂
TBHQ(纯度≥99.0%):美国SIGMA-ALDRIOH公司.
正己烷(色谱纯)、乙醇(分析纯)、甲醇(色谱纯):天津科密欧化学试剂有限公司;三氯甲烷(分析纯)、丙酮(分析纯):洛阳昊华化学试剂有限公司.
1.4 主要测定方法
1.4.1 原料油基本指标的测定
1.4.1.1 酸值的测定
参照GB/T 5009.37—2003.
1.4.1.2 过氧化值的测定
参照AOCS Cd 8-53.
1.4.2 油脂脂肪酸组成分析
采用气相色谱法.
1.4.2.1 甲酯化方法
采用简易碱式甲酯化方法[12].
1.4.2.2 气相色谱分析条件
参考GB/T 17377—2008.
1.4.3 油脂碘值的计算[13]

式中:ai——第i 种脂肪酸的质量分数,%;
fi——第i 种脂肪酸所对应的影响因子.
1.4.4 油样的配制
准确称取大豆油、亚麻籽油、红花籽油、茶油、棕榈油各10 g,分别加入0.02 g TBHQ 完全溶解,得到含TBHQ 2 000 mg/kg 的油样母液.
准确称取已配好的母液1 g,分别加入9 g 的不含TBHQ 的油,混匀,即得200 mg/kg TBHQ 的油样10 g.
同样方法,利用各油脂母液与其相对应的不含TBHQ 的油可分别稀释成浓度为5、10、50、100、150、200 mg/kg 的油样.
1.4.5 油脂氧化稳定性的测定
1.4.5.1 油脂氧化稳定性测定方法
动植物油脂氧化稳定性的测定(加速氧化测试):AOCS Cd 12b-92;空气流量:20 L/h.
1.4.5.2 抗氧化保护系数(PI)计算及货架寿命预测
由添加抗氧化剂前后油样的诱导时间比值,可计算出TBHQ 对某种油样的抗氧化保护系数.利用不同温度下的氧化诱导时间,采用外推法,由氧化诱导时间的对数ln(k)与热力学温度的倒数1/T作图,通过阿伦尼乌斯方程建立关系可预测油脂货架寿命.
2 结果与讨论
2.1 原料油分析
本研究考察脂肪酸组成差异较大的植物油对TBHQ 抗氧化性能的影响,以大豆油、亚麻籽油、红花籽油、茶油和棕榈油(33 ℃)5 种具有一定代表性的油脂为原料油,对原料油脂的酸值、过氧化值进行分析,并测定其脂肪酸组成,结果分别见表1、表2.

表1 原料油酸值和过氧化值

表2 原料油的主要脂肪酸组成与相对含量(面积归一化百分比)
由表1 可知,5 种原料油酸值均小于2 mg/g,过氧化值初值均小于10 mmol/kg,符合本实验用油标准.
由表2 可以看出5 种原料油的主要脂肪酸种类和含量不同,直接导致油脂饱和程度的差异.经计算,棕榈油、茶油、大豆油、红花籽油和亚麻籽油主要脂肪酸中的不饱和脂肪酸相对含量分别为49.58%、88.16%、81.52%、92.62%和89.12%.但由于不饱和脂肪酸中多不饱和脂肪酸较单不饱和脂肪酸对不饱和度的贡献大,故不能单纯依靠不饱和脂肪酸总量来判断油脂的不饱和程度.由于考虑到各脂肪酸的影响因子,碘值可以更直观地反映油脂不饱和程度的大小,碘值越大则不饱和程度越大.根据油脂的脂肪酸组成可以计算5 种原料油的碘值,结果见表3.

表3 原料油的碘值 g·(100g)-1
由表3 可知,5 种原料油的碘值大小顺序为亚麻籽油>红花籽油>大豆油>茶油>棕榈油,即饱和程度顺序为棕榈油>茶油>大豆油>红花籽油>亚麻籽油.
2.2 不同含量的TBHQ 对油脂的抗氧化保护作用
采用氧化酸败仪法,以红花籽油、大豆油、亚麻籽油、棕榈油和茶油为原料,测得含有不同浓度TBHQ(0、5、10、50、100、150、200 mg/kg)的油 脂在温度为100 ℃、110 ℃、120 ℃、130 ℃、140 ℃下的氧化诱导时间,并推断货架寿命,研究TBHQ 对油脂的抗氧化保护作用与其添加量和氧化温度的关系.
在各种温度条件下,红花籽油、大豆油、亚麻籽油、棕榈油和茶油的氧化诱导时间随TBHQ 添加量的变化趋势见图1、图2、图3、图4 和图5.

图1 不同温度下红花籽油的氧化诱导时间

图2 不同温度下大豆油的氧化诱导时间

图3 不同温度下亚麻籽油的氧化诱导时间
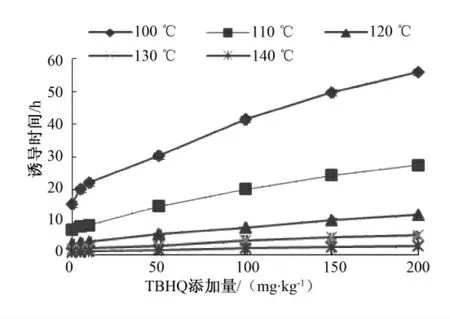
图4 不同温度下茶籽油的氧化诱导时间

图5 不同温度下棕榈油的氧化诱导时间
从图1—图5 可以看出:对于同一种油脂,在同一TBHQ 的添加量下,油脂氧化诱导时间随温度的升高而显著降低.例如在红花籽油中,TBHQ 添加量为100 mg/kg 下,氧化温度为100 ℃时其氧化诱导时间为19.93 h,而当氧化温度升至110 ℃、120℃、130 ℃、140 ℃时,诱导时间分别降为9.36 h、4.44 h、2.22 h 和1.11 h.可以看出,在110~140 ℃范围内,温度每升高10 ℃,氧化诱导时间降低约一半.这是由多方面原因造成的:首先,温度升高,油脂的氧化分解速率加快,电导率迅速增加,造成氧化诱导时间的减小;另外,有研究报道在高温下TBHQ 有挥发损耗的现象出现[14],可以推测温度升高后有少量的TBHQ 随空气挥发出去,降低了其抗氧化效果,造成氧化诱导时间的减小.
另外,在相同的氧化温度下,随着油脂中TBHQ 含量的增高,油脂的氧化诱导时间明显延长.但在TBHQ 添加量处于50 mg/kg 以下时,其抗氧化效果并不十分显著.例如加热温度为100 ℃时,没有添加抗氧化剂时大豆油的氧化诱导时间为11.92 h,添加10 mg/kg TBHQ 后,其氧化诱导时间仅延长至13.22 h,保护系数仅为1.11;而添加量达到50 mg/kg 和200 mg/kg TBHQ 后其氧化诱导时间分别延长至17.59 h 和32.77 h,保护系数分别达到1.48 和2.75.可见在允许添加范围内,TBHQ的添加量的增加可以显著提高其对油脂的抗氧化保护作用.
为验证同一温度下TBHQ 的添加量是否与氧化诱导时间成正比以及线性关系是否良好,分别对图1—图5 中各个温度下红花籽油、大豆油和亚麻籽油的氧化诱导时间与TBHQ 的添加量的趋势图添加拟合曲线,建立线性关系,通过相关性系数的比较证明线性关系是否良好,结果见表4.
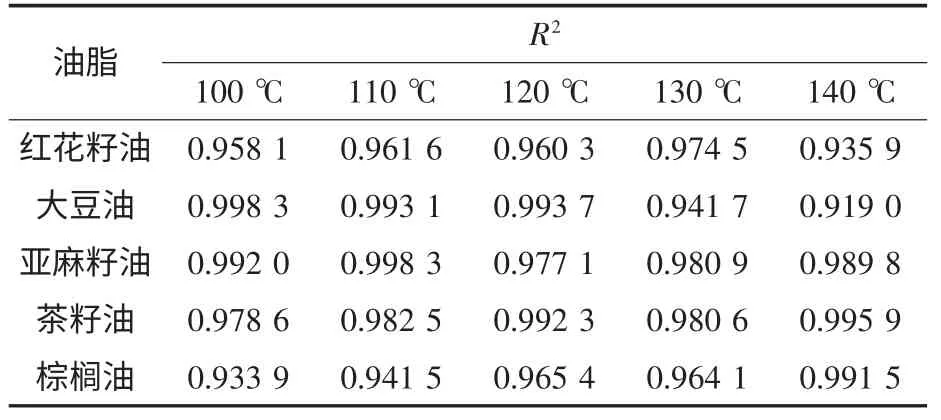
表4 TBHQ 的添加量与氧化诱导时间的线性相关系数
由表4 可以看出:几种油脂中TBHQ 的添加量与氧化诱导时间的相关系数均大于0.91,这说明,对同一种油脂,氧化诱导时间与TBHQ 的添加量具有良好的线性关系,二者成正比.这也证实了在一定范围内,TBHQ 的添加量越大,对油脂的抗氧化保护作用越强.但同时也可以发现,5 种不同油脂的氧化诱导时间与TBHQ 添加量的相关系数存在差异,可能原因会在2.3 中解释分析.
根据1.4.5.2 中的方法推导25 ℃下红花籽油、大豆油和亚麻籽油在不同TBHQ 添加量下的货架寿命,结果见表5.
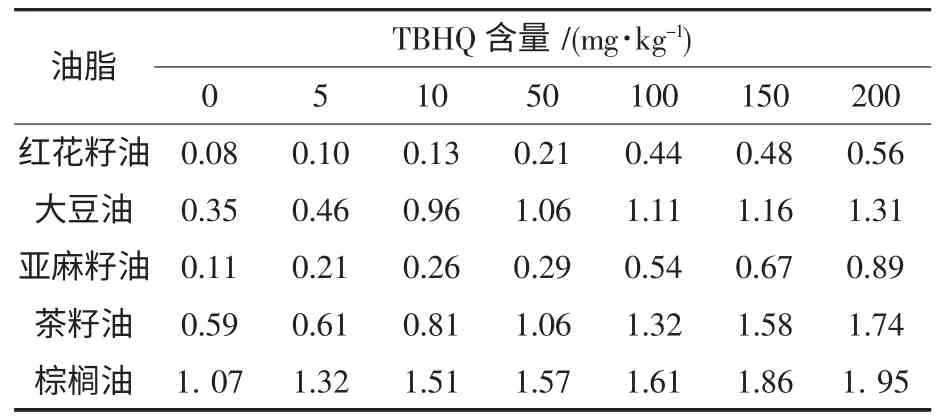
表5 不同TBHQ 添加量下预测油脂货架寿命a
由表5 可见,随着TBHQ 添加量的增大,5 种油脂的货架寿命基本上呈现增加的趋势.例如:未添加TBHQ 时红花籽油、大豆油、亚麻籽油、茶籽油和棕榈油的货架寿命分别为0.08、0.35、0.11、0.59 和1.07 a,而添加量达到200 mg/kg 时三者的货架寿命分别延长至0.56、1.31、0.89、1.74 和1.95 a,说明一定添加范围内的外源抗氧化剂能加强对油脂的抗氧化保护作用,延长油脂的货架期.
2.3 200 mg/kg 的TBHQ 对不同饱和度油脂的抗氧化保护作用比较
采用氧化酸败仪法,测定空白样及含有200 mg/kg 的TBHQ 的大豆油、棕榈油、茶油、红花籽油、亚麻籽茶油,在100 ℃、110 ℃、120 ℃、130 ℃、140 ℃不同温度条件下的氧化诱导时间,研究TBHQ 在不同饱和程度油脂中的抗氧化性能.

图6 含200 mg/kg TBHQ 的不同饱和度油脂的氧化诱导时间

图7 未添加TBHQ 的不同饱和度油脂的氧化诱导时间
由图4 可知,在TBHQ 添加量均为200 mg/kg的情况下,几种不同种类油脂的诱导时间均随温度的升高而下降,且在同一温度下氧化诱导时间均呈现棕榈油>茶油>大豆油>红花籽油>亚麻籽油的趋势,这与2.1 中分析的原料油的饱和程度趋势相同.但由于原料油的饱和度不同造成空白油样亦存在这一趋势,因此我们无法单纯根据氧化诱导时间来推断结果.
为直接反映TBHQ 对油脂的抗氧化效果的强弱,比较了TBHQ 添加量均为200 mg/kg 时不同油脂在各个温度下的抗氧化保护系数.图8—图12分别为100 ℃、110 ℃、120 ℃、130 ℃、140 ℃下棕榈油、茶油、大豆油、红花籽油和亚麻籽油在TBHQ添加量为200 mg/kg 下的抗氧化保护系数.

图8 100 ℃下油脂的抗氧化保护系数
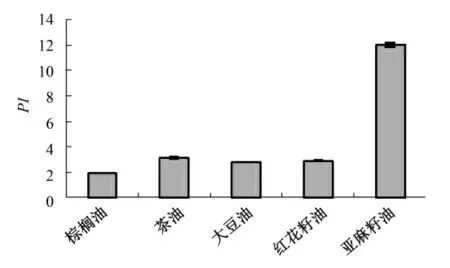
图9 110 ℃下油脂的抗氧化保护系数

图10 120 ℃下油脂的抗氧化保护系数

图11 130 ℃下油脂的抗氧化保护系数
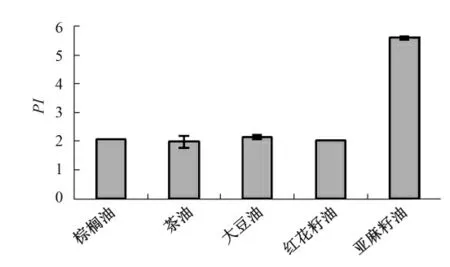
图12 140 ℃下油脂的抗氧化保护系数
由图8—图12 可以直观地看出,在100 ℃、110 ℃、120 ℃、130 ℃、140 ℃下,添加200 mg/kg TBHQ 的不同油脂抗氧化保护系数存在差异,例如在110 ℃下,棕榈油、茶油、大豆油、红花籽油和亚麻籽油的抗氧化保护系数分别为1.85、2.77、2.75、3.06 和5.80,与油脂的饱和程度基本成反比.在各个温度下,棕榈油的保护系数分别为1.85、1.95、1.57、1.51 和2.08,基本是几种油脂中最低的,而亚麻籽油的保护系数分别为5.80、11.98、8.67、10.44和5.60,显著高于其他油脂.这说明:油脂的饱和程度对TBHQ 的抗氧化效果是有影响的,相对来说TBHQ 对不饱和程度较高的油脂的抗氧化保护作用更好.这可能是由于不饱和度较高的油脂含有双键的数量较多,造成双键旁的α 碳失去质子形成自由基的几率增加,油脂更容易发生氧化,那么为了防止该油脂被氧化,TBHQ 作为自由基吸收剂就更易与氧自由基反应,从而阻断自由基链反应,相对地,TBHQ 在不饱和程度较高的油脂中起到的抗氧化作用就更大.
但由于不同种类油脂在黏度、熔点、含水量以及本身含有的抗氧化物质的多少等其他理化指标上亦存在很大差异,而本文中只针对饱和度因素,并未考察其他影响因素.因此造成TBHQ 对不同饱和程度油脂抗氧化效果的差异可能亦有其他因素的影响,这从图6—图10 中茶油、大豆油和红花籽油在同一温度下的抗氧化保护系数的差异并不明显也可以看出来.要完全精确地分析TBHQ 对不同种类油脂抗氧化效果不同的原因,需要进一步地研究TBHQ 对纯粹甘三酯的抗氧化效果.
3 结论
通过比较不同浓度的TBHQ(0、5、10、50、100、150、200 mg/kg)对同一种油脂的抗氧化保护作用和相同浓度的TBHQ(200 mg/kg)对不同饱和程度的油脂的抗氧化保护作用,得出以下结论:对同一种油脂来说,在允许添加范围内,TBHQ 的抗氧化保护作用与其添加量成正比,与加热温度成反比;油脂的货架寿命大体上随着TBHQ 添加量的增多而增大.合理添加TBHQ,可以有效延长油脂及油脂食品的货架期;高温下,相同浓度的TBHQ 对不同种类油脂的抗氧化保护效果不同,不饱和程度越大,保护系数越大,其抗氧化效果越好.
[1]毕艳兰.油脂化学[M].北京:化学工业出版社,2005:1-2.
[2]Eldin A K.Effect of fatty acids and toco -pheraos on the oxidative stability of vegetable oils[J].Eur J Lipid Sci Technol,2006,58:1051-1061.
[3]Eldin A K,Andersson R.A multivariate study of the correlation between tocopherol content and fatty acid composition in vegetable oils[J].J Am Oil Chem Soc,1997,74(4):375-380.
[4]彭辉.油脂、含油食品的氧化、抗氧化以及抗氧化剂[J].食品工业,2004(3):34-36.
[5]Ke P J,Nash D M,Ackman R G.Mackerel skin lipids as an unsaturated fat model system for the determination of antioxidative potency of TBHQ and other antioxidant compounds[J].J Am Oil Chem Soc,1977,54:417-420.
[6]Yoon Kyung Chung,Ahmed E Y.Inactivation of barotolerant strains of Listeria monocyto -genes and Escherichia coli O157:H7 by ultra high pressure and tert-butylhydroquinone combination[J].The Journal of Microbiology,2008,46(3):289-294.
[7]Huffaker J E.Tertiary-butyl hydroquinone treatment for crude palm oils[J].J Am Oil Chem Soc,1982,59(9):381-383.
[8]Kiritsakis A K,Stine C M,Dugan JR L R.Effect of selected antioxidants on the stability of virgin olive oil[J].J Am Oil Chem Soc,1983,60(7):1286-1290.
[9]Luckadoo B M,Sherwin E R.Tertiary butylhydroquinone as antioxidant for crude sunflower seed oil[J].J Am Oil Chem Soc,1972,49:95-97.
[10]Ruger Christopher W,Klinker Eric J,Earl G.Abilities of some antioxidants to stabilize soybean oil in industrial[J].J Am Oil Chem Soc,2002,79(7):733-736.
[11]郭祀远,蔡妙颜,李琳,等.油脂抗氧化剂TBHQ 的应用研究[J].中国油脂,1995,20(3):50-52.
[12]AOCS.Official methods and recommended practices of the American Oil Chemists’Society[S].Champaign,Illinois:AOCS Press,1997:2 -66.
[13]EN 14214:2003.Automotive fuels -fatty acid methyl esters(FAME)for diesel engines:Requirements and test methods[S].
[14]Buck D F.Antioxidants in soya oil[J].J Am Oil Chem Soc,1981,58(3):275-278.
