Alcalase 2.4 L 酶解玉米蛋白水解产物抗氧化活性研究
2013-04-23吴欣欣胡二坤崔慧娟杨萌萌郭兴凤
吴欣欣,胡二坤,崔慧娟,郑 慧,杨萌萌,郭兴凤*
(1.河南工业大学 粮油食品学院,河南 郑州 450001;2.河南职业技术学院 烹饪食品系,河南 郑州 450002)
0 前言
抗氧化剂是阻止氧气产生不良影响、帮助捕获并中和自由基、从而祛除自由基对人体损害的一类物质,它在食品、医学、化妆品及饲料等领域都有着广泛的应用.近年来,随着对生物活性肽抗氧化活性研究的深入,发现许多生物活性多肽除了自身的营养作用外,还具有抗氧化能力,能帮助机体清除多余的自由基,提高机体抗衰老、抗疾病能力.目前,国内外学者从多种食物蛋白如大豆蛋白、肉类蛋白、海洋蛋白、废弃蛋白资源等的酶解液中分离出具有抗氧化活性的肽片段[1].从食品安全角度考虑,生物活性肽比化学合成抗氧化剂更具安全性,比一些天然抗氧化剂(VE、草本植物)提取物成本更低,且不会影响食品的风味和色泽[2].
玉米蛋白粉(CGM)是玉米湿法加工生产淀粉的副产品,蛋白质含量60%左右,有的高达70%以上[3].玉米蛋白作为一种非完全蛋白,虽然在食品中的应用受到限制,但利用玉米蛋白可制备出具有各种生物功能的活性肽[4].本研究以玉米蛋白粉为原料,用Alcalase 2.4 L 进行水解,以还原力为测定指标,在单因素试验的基础上,利用Box-Benhnken 响应面分析法对玉米蛋白酶解条件进行优化,制备玉米蛋白活性肽,为玉米蛋白多肽的开发利用提供试验基础和数据.
1 材料和方法
1.1 原料和试剂
玉米蛋白粉:郑州华冠生物技术开发有限公司,蛋白质含量约60%;蛋白酶:Novo Nordisk,Alcalase 2.4 L FG(酶活力2.4AU-A/g);铁氰化钾、三氯化铁、三氯乙酸等试剂均为分析纯.
1.2 主要设备
722S 可见光分光光度计:上海精密科学仪器有限公司;CHA-S 气浴恒温振荡器:金坛市华锋仪器有限公司;HH-S 型数显恒温水浴锅:巩义市英峪予华仪器厂;101 型电热鼓风干燥箱:北京市永光明医疗仪器厂;AY120 型电子分析天平:日本岛津公司.
1.3 方法
1.3.1 玉米蛋白粉各组分的测定
粗蛋白含量的测定:按GB/T 5009.5—2010;粗脂肪含量的测定:按GB/T 14772—2008;水分的测定:按GB/T 5009.3—2010;灰分的测定:按GB/T 5009.4—2010.
1.3.2 玉米蛋白粉的酶水解
称取一定量的玉米蛋白粉,加入磷酸缓冲溶液和蛋白酶,混匀,置于气浴恒温振荡器中振荡水解,完成后放入90 ℃的恒温水浴锅中加热10 min灭酶,取出后立即冷却至室温,定容.将酶解液过滤,取滤液进行抗氧化活性分析.每个试验做2 个平行样,结果用平均值表示.
1.3.3 玉米蛋白酶解液的抗氧化活性测定
蛋白质的水解度与水解物抗氧化活性之间不存在线性关系,而是只有在特定的水解度条件下,蛋白水解物才具有最大的抗氧化能力[5-6].所以用水解度为指标来判断蛋白水解物的抗氧化活性并不准确,试验选用还原力作为指标来检验酶解工艺条件的优化程度.抗氧化剂清除自由基是通过其自身的还原作用给出电子而实现的,还原力越强,其抗氧化性就越强,因此可以通过测定抗氧化肽的还原力来说明其抗氧化活性的强弱.
还原力的测定参照Cumby 等[7]的方法并做适当修改.取酶解液1.0 mL,加入2.5 mL 0.2 mol/L pH6.6 的磷酸缓冲液调节其pH 值,再加入1.0 %的铁氰化钾2.5 mL(缓冲液为空白),摇匀.将该混合物置于50.0 ℃水浴中反应20 min,然后加入2.5 mL 10%(W/V)三氯乙酸,充分混合后吸取2.5 mL于10 mL 的比色管中,再加入0.5 mL 1.0 mg/mL的三氯化铁,定容,静置10 min,测定吸光值A700.吸光值越大表明还原力越强,抗氧化活性也越强.
1.3.4 试验设计
在探讨底物体积分数、酶与底物比([E]/[S])、pH 值、酶解温度和时间等单因素对玉米蛋白酶解液抗氧化活性影响的基础上,采用Box-Benhken 响应面分析法,设计4 因素3 水平共29 个试验点的响应面分析试验来优化玉米蛋白粉酶水解条件[8-9].
2 结果与分析
2.1 玉米蛋白粉的基本组成(表1)

表1 玉米蛋白粉的基本组成 %
2.2 各因素对玉米蛋白粉酶解液还原力的影响
2.2.1 酶与底物比对玉米蛋白酶解液还原力的影响
在底物体积分数6.00%,pH8.04,酶解温度50.0 ℃,酶解时间3.0 h 的条件下,比较[E]/[S]对酶解液还原力的影响,结果如图1 所示.
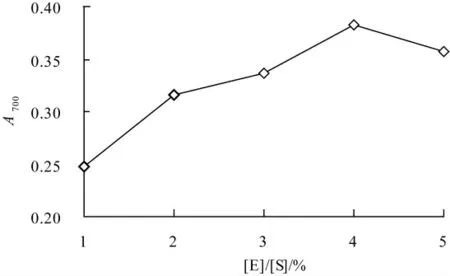
图1 [E]/[S]对玉米蛋白酶解液还原力的影响
由图1 可知,[E]/[S]在1.00%~4.00%的范围内,随着[E]/[S]的增加,酶解产物的还原力不断增大,[E]/[S]在4.00%时还原力达到最大,[E]/[S]超过4.00%以后,随着[E]/[S]的增加酶解产物还原力反而降低.这是因为酶促反应主要酶的活性基团与底物作用的结果,在一定的底物体积分数条件下,随着[E]/[S]的增加,酶的活性基团增多,加速了酶促反应,生成的具有抗氧化活性的小分子肽也增多,故还原力增大;但是随着[E]/[S]的继续增加,可能导致抗氧化玉米蛋白肽的过度水解,酶解产物的还原力却降低[10].
2.2.2 底物体积分数对玉米蛋白酶解液还原力的影响
在[E]/[S]为4.00%,pH8.04,酶解温度50.0 ℃,酶解时间为3.0 h 的条件下,比较水解过程中不同底物体积分数对玉米蛋白酶解液还原力的影响,结果如图2 所示.

图2 底物体积分数对玉米蛋白酶解液还原力的影响
由图2 可以看出,在底物体积分数是2.00%时得到的玉米蛋白酶解液的还原力明显大于1.00%时的酶解液,但在底物体积分数2.00%~5.00%范围内,酶解液的还原力随着底物体积分数的增大反而降低.这是因为在底物体积分数相对较低时,增加底物体积分数可使底物充分占据酶活性中心,提高了反应速率,利于获得目标产物;底物体积分数大于2.00%时,酶反应可能会受到不同类型的抑制,改变了产物的组成,降低了抗氧化能力.试验中的原料蛋白经酶解作用后生成抗氧化活性产物,但当底物体积分数达到一定程度时酶促反应速率保持恒定,随着底物体积分数的增加,产物抗氧化活性有所下降但并不明显,可能是玉米蛋白成分复杂影响了产物的抗氧化活性[11].
2.2.3 pH 值对玉米蛋白酶解液还原力的影响
在底物体积分数2.00%,[E]/[S]为4.00%,酶解温度50.0 ℃,水解时间3.0 h 的条件下,比较pH 值对酶解液还原力的影响,结果如图3 所示.
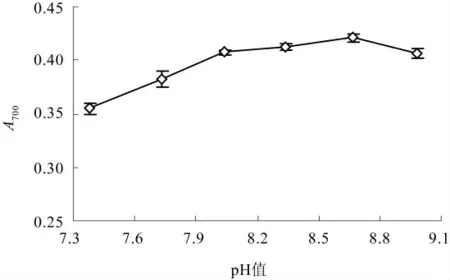
图3 pH 值对玉米蛋白酶解液还原力的影响
蛋白酶具有一个或多个由结合部位和催化部位所组成的活性部位.酶的活性部位只有在蛋白酶保持一定的空间构象时才能存在,并发挥催化功能.结合部位和催化部位的基团对反应体系pH 值的变化比较敏感,结合部位影响生成肽链的结构,催化部位影响蛋白酶的催化活性.另外,作为底物的玉米蛋白也随着pH 值的变化表现出不同的解离状态[12].玉米蛋白水解物的抗氧化活性与其肽链结构具有相关性[13].由图3 可知,随pH 值增大,即碱性增强,酶解液的还原力增大;在pH8.67 时,酶解液的还原力达到最大值;而当pH 值再增大时,酶解液的吸光度却呈下降趋势.这说明在pH8.67条件下的酶与底物的结合位点和催化活性有利于具有抗氧化活性产物的生成.
2.2.4 酶解温度对玉米蛋白酶解液还原力的影响
在底物体积分数2.00%,[E]/[S]为4.00%,pH8.67,水解时间3.0 h 的条件下,比较酶解温度对酶解液还原力的影响,结果如图4 所示.

图4 酶解温度对玉米蛋白酶解液还原力的影响
由图4 可以看出,在酶解温度40.0~55.0 ℃范围内,酶解液的还原力随着温度升高而增大,在酶解温度55 ℃时还原力达到最大,当温度继续上升,还原力下降.这可能是由于酶分子吸收了过多的能量,引起维持酶分子结构的次级键解体,导致蛋白酶的空间结构发生改变,使得酶活力减弱[14].
2.2.5 水解时间对玉米蛋白酶解液还原力的影响
在底物体积分数2.00%,[E]/[S]为4.00%,pH8.67,酶解温度55.0 ℃的条件下,比较水解时间对酶解液还原力的影响,结果如图5 所示.
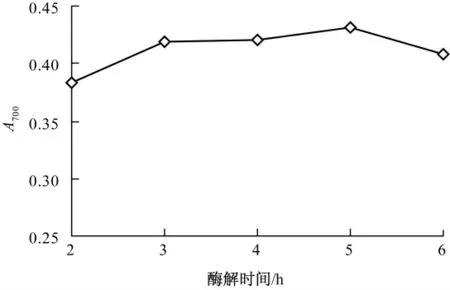
图5 水解时间对玉米蛋白酶解液还原力的影响
由图5 可知,在水解时间2~5 h 内,玉米蛋白酶解液的还原力随着水解时间的延长呈增长趋势,水解5.0 h 时还原力最大,继续延长水解时间还原力却有所下降.这是因为玉米蛋白水解物的抗氧化活性与其分子质量分布具有相关性,在水解5.0 h 后,随着水解时间的延长,具有还原能力的肽段被进一步水解,破坏了维持其抗氧化活性肽段结构的完整特征,生成了不具还原能力的短肽或氨基酸所造成的[15].
2.3 Alcalase 2.4 L 酶解玉米蛋白工艺条件的优化
2.3.1 Box-Benhnken 响应面试验设计
在单因素试验结果的基础上,固定pH8.67,以玉米蛋白酶解液的还原力为响应值,底物体积分数(A)、[E]/[S](B)、温度(C)、酶解时间(D)为自变量,选取各单因素试验的最优值为中心点,因素与水平如表2 所示.
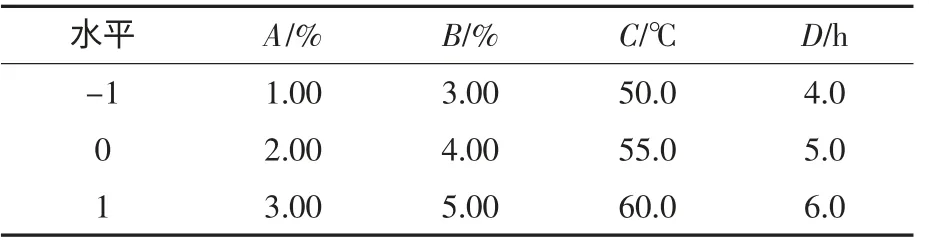
表2 Box-Benhnken 响应面因素与水平
2.3.2 玉米蛋白酶解条件的优化
根据Box-Benhnken 响应面试验设计了4 因素3 水平共29 个试验点,其中5 个中心试验用来估计试验误差,其余24 个试验点为析因点.
2.3.2.1 响应面试验结果
响应面试验设计及结果如表3 所示.
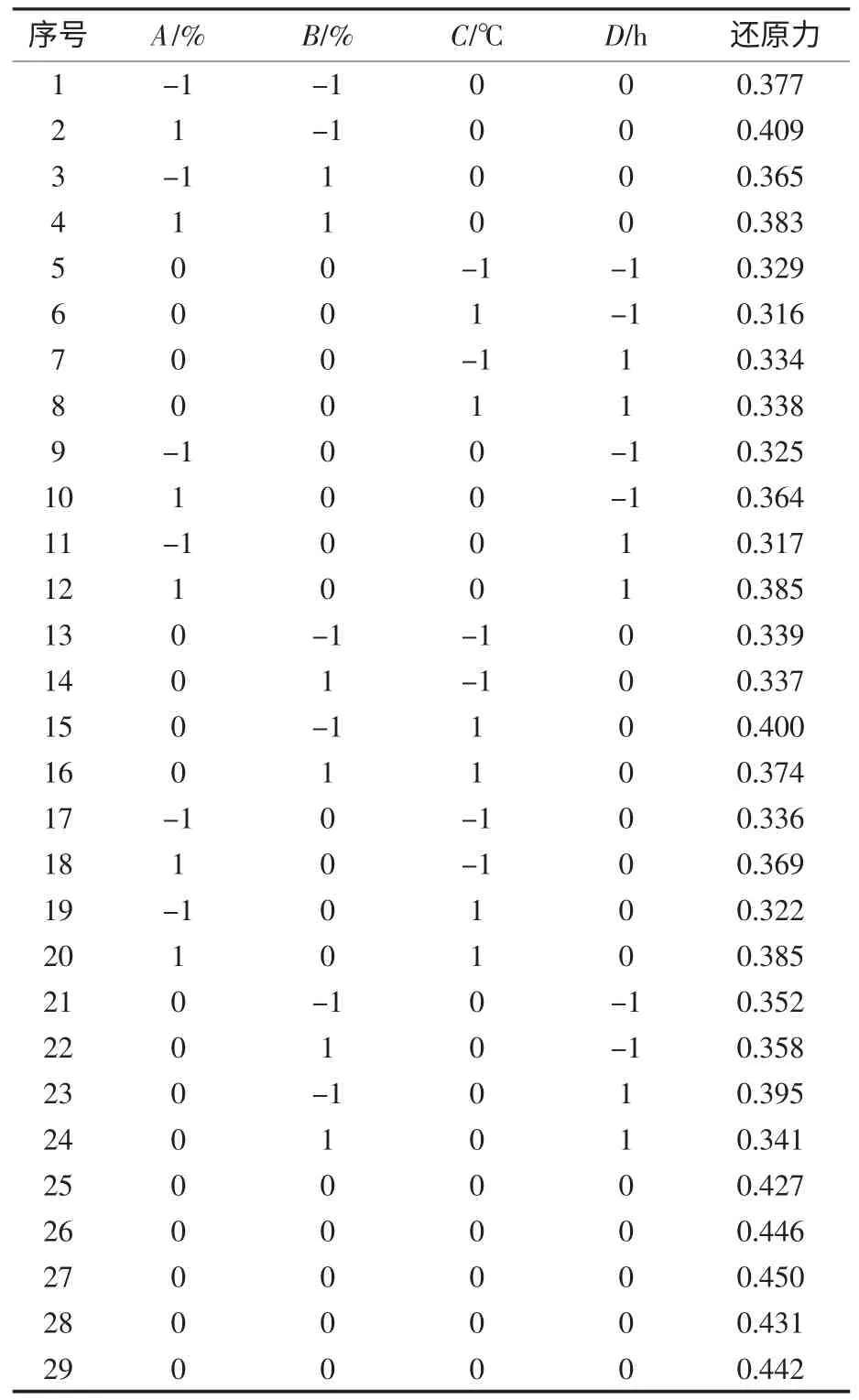
表3 Box-Benhnken 响应面试验设计及结果
2.3.2.2 模型建立及差异显著性检验
采用Design-Expert 6.0 分析玉米蛋白酶解产物对还原力回归模型的显著性,结果如表4 所示.

表4 Box-Benhnken 响应面试验回归模型方差分析
由表4 可知,模型的F 值为16.45,P<0.000 1,表明该回归模型显著.失拟项的F 值2.37,P=0.210 9>0.05,说明模型失拟项不显著.决定系数R2=0.942 7,信噪比为11.96>4.00,体现模型可得到足够强的响应信号,回归方程拟合度良好,试验误差小,表明各因素值和响应值之间的关系可以用模型来函数化.利用Design-Expert 6.0 对数据进行多元回归拟合,得到A、B、C、D 4 个因素的二次多项回归方程(变量为编码值)为:
还原力=0.439 2+0.021 1A-0.009 5B+0.007 6C+0.005 5D-0.033 7A2-0.022 1B2-0.053 5C2-0.056 6D2-0.003 5AB+0.007 5AC+0.007 3AD-0.006 0BC-0.015 0BD+0.004 3CD.
回归方程的显著性检验结果显示,A、B、A2、B2、C2、D2和BD 对水解产物的还原能力的影响都是显著的.显著性证明,回归方程可以很好地描述各因素与响应值之间的关系,可以用该模型对试验结果进行分析和预测,确定Alcalase 2.4 L 酶解玉米蛋白的最佳工艺[16-18].
2.3.2.3 Box-Benhnken Design 响应面分析与条件优化
模型的响应曲面如图6 所示,直观反映了各因素间的交互作用.由曲面图的弯曲程度和等高线的封闭情况可以看出,交互作用的稳定点均落在试验范围内,说明酶解液还原力的极值出现在试验范围内.由图6 可知,除B、D 交互作用曲面图的极大值出现位置不同,其他因素交互作用曲面图的极大值位置几乎处于同一水平,结合方程中交互项的显著性分析,说明B、D 因素间有一定的交互作用.B、D 交互作用曲面图显示:不同酶与底物比条件下,酶解物还原力的极值点位置沿酶解时间增加的方向移动,而酶与底物比过大或反应时间过长则会出现单因素试验中相同的现象,即还原力降低.
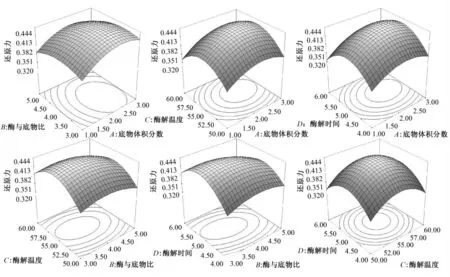
图6 各因素交互作用对玉米蛋白酶解液还原力的响应曲面
对回归方程进行分析,得到优化结果为:底物体积分数2.35%,[E]/[S]3.70%,酶解温度55.59℃,酶解时间5.12 h,pH8.67,还原力预测值为0.445.采用所得最佳水解条件进行验证,为方便操作将酶解温度设为55 ℃,其他条件不变,经3 次平行试验测得Alcalase 2.4 L 酶解玉米蛋白所得产物的蛋白质含量为13.25 mg/mL,还原力(A700)为0.436,与预测值0.445 相比,相对误差为0.09,说明拟合模型优化出的条件较为准确,证明了最佳酶解条件的可靠性和预测方法的可行性.
参照文献[19],在各自的最佳酶解条件下,玉米蛋白粉酶解液的抗氧化活性要略低于大豆分离蛋白酶解液抗氧化活性,但和大豆蛋白酶水解相比,明显减少了原料和蛋白酶的用量,降低了生产成本.而且酶解液只是水解之后的混合物,如果经过分离提纯制得抗氧化活性较高的肽段或氨基酸,其抗氧化活性将还会有很大的提高,显示了其在食品等行业的应用潜力.
2.3.2.4 抗氧化效果比较
玉米蛋白粉的酶解产物是水溶性的,还原力的测定也是在水溶体系中进行的,故选取水溶性抗氧化剂VC作为对比.不同VC添加量的还原力(A700)测定结果如表5 所示.

表5 VC 还原力测定结果
由表5 可以看出,优化后Alcalase 2.4 L 水解玉米蛋白所得产物的还原力明显要大于添加量为60 μg/mL 的Vc 溶液,低于添加量为100 μg/mL 的VC溶液,但接近于添加量为80 μg/mL 的VC溶液的抗氧化活性.
3 结论
试验用Alcalase 2.4 L 水解玉米蛋白粉,在单因素的基础上,用Box-Benhnken 响应面分析法对Alcalase 2.4 L 水解玉米蛋白粉制备高效抗氧化产物的工艺参数进行了优化.得到最佳工艺条件为:底物体积分数2.35%,[E]/[S]3.70%,酶解温度55.59 ℃,酶解时间5.12 h,pH8.67.在此条件下Alcalase 2.4 L 水解玉米蛋白酶解液的蛋白质含量为12.25 mg/mL,还原力(A700)为0.436.与酶解前的蛋白溶液(14.08 mg/mL)相比,蛋白质损失量很少;酶解后酶解液的还原力接近于添加量为80 μg/mL 的VC溶液的抗氧化活性,可以作为抗氧化成分应用到食品中.
[1]郭兴凤,吴欣欣,薛园园,等.碱性蛋白酶水解豌豆蛋白及其产物抗氧化活性研究[J].河南工业大学学报:自然科学版,2012,33(1):6-10.
[2]王瑞雪,孙洋,钱方.抗氧化肽及其研究进展[J].食品科技,2011,36(5):83-86.
[3]秦思思,宋俊梅,刘天蒙.玉米黄粉酶解工艺条件研究[J].粮食与油脂,2010(7):17-19.
[4]陈红漫,杜晓霞,阚国仕,等.玉米抗氧化肽的酶解工艺条件优化研究[J].食品科技,2010,35(8):55-60.
[5]王晶.玉米蛋白酶水解物抗氧化活性及应用研究[D].哈尔滨:东北农业大学,2007.
[6]彭地纬.米渣抗氧化肽的制备及特性研究[D].南昌:南昌大学,2010.
[7]Cumby N,Zhong Y,Naczk M.Antioxidant activity and water-holding capacity of canola protein hydrolysates[J].Food Chemistry,2008,109:144-148.
[8]幕运动.响应面方法及其在食品工业中的应用[J].郑州工程学院学报,2001,22(3):91-94.
[9]郑明洋,王元秀,张桂香,等.响应面法优化玉米黄粉蛋白的酶解工艺[J].食品科学,2012,33(4):71-76.
[10]王若兰,杨壮,周菲.中性酶从米糠中制取抗氧化性活性肽的研究[J].河南工业大学学报:自然科学版,2008,29(6):36-38.
[11]徐鑫,何佳易,刘国艳,等.小黄鱼抗氧化肽制备条件的响应面优化[J].食品科学,2011,32(21):165-170.
[12]蒋艳,王泽南,李佐雄,等.酶法制备碎米抗氧化肽的研究[J].食品工业科技,2011,32(11):191-194.
[13]代衍峰,何志勇,陈洁,等.抗氧化性玉米肽的分离纯化及其性质[J].食品与机械,2008,24(5):5-8.
[14]陈丽花,王跃,朱锦爵.大豆蛋白抗氧化活性肽的制备工艺研究[J].食品工业,2011(3):31-34.
[15]Bamdad F,Wu J P,Chen L Y.Effects of enzymatic hydrolysis on molecular structure and antioxidant activity of barley hordein[J].Journal of Cereal Science,2011,54:20-28.
[16]Kunamneni A,Singh S.Response surface optimization of enzymatic hydrolysis of maize starch for higher glucose production[J].Biochemical Engineering Journal,2005,27:179-190.
[17]Nazeer R A,Naqash S Y.Optimization of enzymatic hydrolysis conditions for the production of antioxidant peptides from muscles of Nemipterus japonicus and Exocoetus volitans using response surface methodology[J].Amino Acids,2012,43(12):337-345.
[18]刘秀红,张东杰.响应面分析法优化大豆抗氧化肽水解条件的研究[J].黑龙江八一农垦大学学报,2009,21(5):44-49.
[19]焦驼文,孔繁东,孙浩.大豆分离蛋白酶解液体外抗氧化性的研究[J].中国乳品工业,2007,35(7):49-52.
