醇溶液体系中蔗糖酯修饰猪胰脂酶的研究
2013-04-23孙江彦杨国龙毕艳兰陈素琴孙尚德梁少华
孙江彦,杨国龙,毕艳兰,陈素琴,孙尚德,梁少华
(河南工业大学 粮油食品学院,河南 郑州 450001)
0 引言
近些年,功能性与营养性油脂的需求越来越大[1],因此以更经济、更环保的方法制取这些油脂成为一个值得研究的课题.由于酶促反应具有特定专一性、低温、高酶活性等优点,酶促酯交换的研究显得越来越重要.提高脂肪酶的活性、稳定性与溶解性一直是研究的热点,采用的方式主要有聚乙二醇修饰法、脂肪酸共价偶联法、阴离子交换树脂固定法[2-5],但由于各种原因,这些方法得到的酶的酶促反应速率小,由于水的存在还会产生各种副产物,如甘油二酯、甘油一酯.最近有研究利用非离子表面活性剂修饰脂肪酶,其研究的是脂肪酶和非离子表面活性剂的混合物,混合物中非离子表面活性剂的亲水基团连在脂肪酶表面,疏水基团排列在脂肪酶外边,这种排列使修饰酶在有机溶剂中具有更好的溶解性、更高的反应活性,同时能减少副反应[6-11].
笔者采用蔗糖酯修饰猪胰脂酶,利用酶催化茶油与软脂酸反应的酯交换量为考察指标,探讨蔗糖酯添加量、醇水比和搅拌时间对修饰酶活性的影响,同时研究了修饰酶与未修饰酶的热稳定性,为非离子表面活性剂修饰酶的研究提供科学依据.
1 材料与方法
1.1 材料与仪器
猪胰脂酶:丹麦诺维信公司;茶油:河南信阳长园野生茶油有限公司;棕榈酸(纯度≥98%):Sigma公司;蔗糖酯:三菱化学食品株式会社;正己烷:天津市科密欧化学试剂有限公司,色谱纯;无水乙醚、甲酸等均为分析纯.
Agilent6890N 气相色谱仪:美国Agilent 公司;BPX-70 色谱柱(30.0 m×250 μm×0.25 μm):澳大利亚SGE 公司;DF-101C 型集热式恒温加热磁力搅拌器;BS201s 电子天平;ZF-I 型三用紫外分析仪;薄层板(20 cm×20 cm).
1.2 试验方法
1.2.1 脂肪酶的修饰
取一定量的蔗糖酯加入无水乙醇中,在40 ℃下搅拌(600 r/min),缓慢加入适量蒸馏水,搅拌至蔗糖酯完全溶解,而后向蔗糖酯/乙醇水溶液中加入猪胰脂酶,在恒温条件下搅拌一定时间后,混合物离心分离,冷冻干燥后得到修饰酶.
1.2.2 修饰前后脂肪酶促酯交换反应的催化活性测定
称取2 g 茶油置于50 mL 烧瓶中,加入20 mL异辛烷和软脂酸(n(软脂酸)∶n(茶油)=2∶1),混合体系与脂肪酶(ω(茶油)=15%)一起置于密闭环境下静置48 h,以饱和碳酸钾溶液控制反应体系的水活度(αW=0.43);然后将酶加到反应体系中,40℃下反应4 h;分离混合物中的甘三酯,用气相色谱仪分析其脂肪酸组成;以4 h 后的酯交换量来评价脂肪酶修饰前后的催化活性.
酶的催化活性=产物甘三酯中软脂酸的质量百分数-原料茶油中软脂酸的质量百分数.
1.2.3 酯交换产物中甘三酯的组成分析
取1 mL 反应产物置于离心管中,离心分离后吸取上层0.5 mL,点在20 cm×20 cm 的薄层板上,用展开剂(石油醚∶乙醚∶甲酸=70∶30∶1)展开,在距离顶端1.5 cm 时取出薄层板,在通风橱中晾干,均匀喷上2,7-二氯荧光素显色,在紫外分析仪上观察并刮下甘三酯的谱带,简易碱式甲酯化后用气相色谱分析脂肪酸组成.
1.2.4 甘三酯简易碱式甲酯化方法
从薄层板上刮下甘三酯的谱带(甘三酯与硅胶的混合物)溶于2.5 mL 正己烷中,再加入1 mL 0.5 mol/L 的甲醇钠溶液,混合后室温下轻摇5 min,加入适量无水硫酸钠,静置1 h 后,于2 000~3 000 r/min 下离心2 min,吸取上清液用于气相色谱分析.
2 结果与讨论
2.1 蔗糖酯添加量对修饰酶活性的影响
在30 ℃,醇水比1∶3,搅拌时间40 min的条件下,考察6 种蔗糖酯(S-370、S-570、S-770、S-970、S-1170、S-1670)的添加量对修饰酶活性的影响,结果见图1.
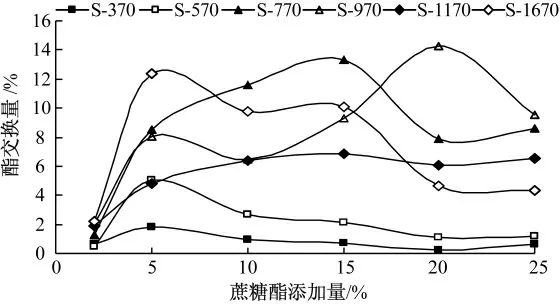
图1 蔗糖酯添加量对修饰酶活性的影响
由图1 可知,随着添加量的增加,6 种蔗糖酯修饰的猪胰脂酶催化酯交换的酯交换量的变化规律大致相同,均先增大后减小,但变化的大小程度不同.S-370、S-570、S-1670 的添加量在5%时,其修饰的猪胰脂酶催化酯交换的酯交换量达到最大,接着开始下降.S-770 的添加量在15%时,修饰酶催化酯交换的酯交换量达到最大,接着显著变小.S-1170 的添加量在2%~15%时,修饰酶催化酯交换的酯交换量缓慢增加,在添加量达到15%时达到最大,然后缓慢降低.S-970 的添加量在20%时,修饰酶催化酯交换的酯交换量显著增大达到最大,接着明显减小.
Thakar 等[12]研究表明,表面活性剂的种类和用量对修饰酶催化酯交换反应有重要的影响,阴离子型表面活性剂会抑制修饰酶活力,阳离子表面活性剂和非离子表面活性剂会促进酶活力的发挥,非离子型表面活性剂修饰效果比阳离子型的效果好,较低的表面活性剂用量能显著提高修饰酶的活性.乙醇溶液体系中Span 修饰猪胰脂酶的研究结果表明,Span 用量在20%~25%时,修饰酶具有较高的催化活性[13].乙醇溶液体系中Tween 修饰猪胰脂酶的研究结果显示,Tween 用量为5%~20%时修饰酶具有较好的催化活性[14].
2.2 醇水比对修饰酶活性的影响
在30 ℃,蔗糖酯添加量分别为S-370、S-570和S-1670 为5%,S-770 和S-1170 为15%,S-970为20%,搅拌时间为40 min 的条件下,考察醇水比对修饰酶活性的影响,结果见图2.
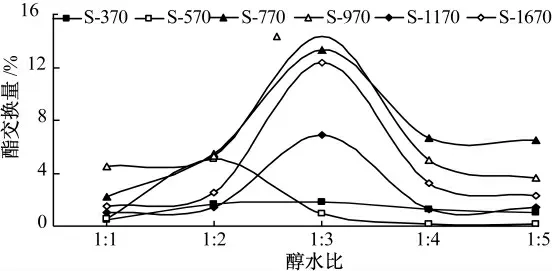
图2 醇水比对修饰酶活性的影响
由图2 可见,随着醇水比的增加,酯交换量均是先增加后减少,但酯交换量的变化趋势与蔗糖酯的种类有关.S-370、S-770、S-970、S-1170、S-1670 均在醇水比为1∶3 时,修饰酶催化酯交换的酯交换量达到最大;S-570 在醇水比为1∶2 时,修饰酶催化酯交换的酯交换量达到最大.
Kamiya 等[15]采用表面活性剂在缓冲溶液/乙醇混合体系中修饰脂肪酶,结果表明混合体系可以提高表面活性剂的分散性,还可以改变酶的溶解性,当乙醇体积占总体积的0~20%时,修饰酶活性略有提高.曾俊等[13]的研究结果表明,乙醇占溶液总体积的20%~50%时,修饰猪胰脂酶具有较高的催化活性.张洁等[14]研究乙醇溶液体系中Tweens 修饰猪胰脂酶时,发现乙醇与水的比例在1∶2~1∶3 间时,修饰酶的催化活性较高.
2.3 搅拌时间对修饰酶活性的影响
在30 ℃,蔗糖酯添加量分别为S-370、S-570和S-1670 为5%,S-770 和S-1170 为15%,S-970为20%,S-370、S-770、S-970、S-1170 和S-1670的醇水比为1∶3,S-570 的醇水比为1∶2 的条件下,考察搅拌时间对修饰酶活性的影响,结果见图3.
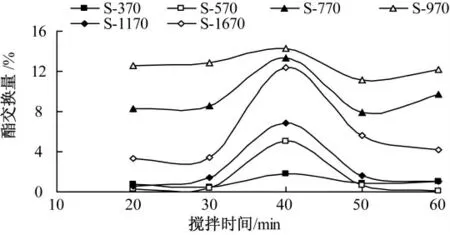
图3 搅拌时间对修饰酶活性的影响
由图3 可见,随着搅拌时间的增加,酯交换量均是先增加后减少.S-370 和S-970 修饰的猪胰脂酶的酯交换量随搅拌时间变化不大,搅拌时间为40 min 时酯交换量达到最大.S-570、S-770、S-1170 和S-1670 修饰的猪胰脂酶的酯交换量受搅拌时间的影响较大,搅拌时间为40 min 时,酯交换量达到最大,远高于其他搅拌时间下的酯交换量.乙醇溶液中Span 和Tweens 修饰猪胰脂酶时,搅拌30 min 均可完成修饰[13-14].
2.4 修饰酶的热稳定性
在30℃,蔗糖酯添加量分别为S-370、S-570和S-1670 为5%,S-770 和S-1170 为15%,S-970为20%,S-370、S-770、S-970、S-1170 和S-1670的醇水比为1∶3,S-570 的醇水比为1∶2,搅拌时间40 min 的条件下,考察反应温度对修饰酶活性的影响,结果见图4.
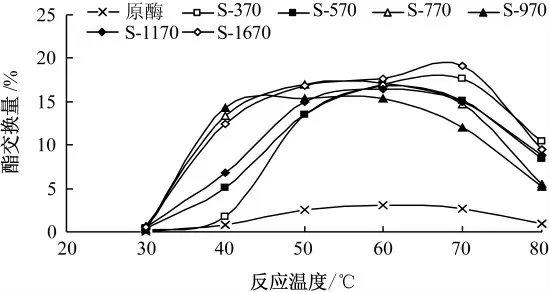
图4 温度对修饰酶活性的影响
由图4 可知,在40~80 ℃的反应条件下,6 种修饰酶的催化活性均高于未修饰酶,修饰酶在30℃下催化活性几乎为零,在50~70℃催化活性分别达到最大,而未修饰酶的催化活性在60 ℃达到最大.80 ℃时酶催化活性急剧下降,可能是高温导致酶失活的原因.蔗糖酯修饰的猪胰脂酶在40~80℃间催化反应活性都高于未修饰酶,在50~70 ℃间,修饰酶均有较好的催化活性.
3 结论
在醇溶液体系下采用蔗糖酯修饰猪胰脂酶,研究不同修饰条件对修饰酶活性的影响.研究发现:在30 ℃下40 min 即可完成蔗糖酯对猪胰脂酶的修饰,但各种蔗糖酯修饰的最佳条件并不相同.S-370 修饰的最佳条件是添加量5%,醇水比1∶3;S-570 修饰的最佳条件是添加量5%,醇水比1∶2;S-770 修饰的最优条件是添加量15%,醇水比1∶3;S-970 修饰的最优条件是添加量20%,醇水比1∶3;S-1170 修饰的最优条件是添加量15%,醇水比1∶3;S-1670 修饰的最优条件是添加量5%,醇水比1∶3.热稳定性试验表明,6 种蔗糖酯修饰的猪胰脂酶在40~80 ℃催化反应活性都高于未修饰酶,在50~70℃,修饰酶均有较高的催化活性.
[1]Abigor R D,Marmer W N,Foglia T A,et al.Production of cocoa butter-like fats by the lipase-catalyzed interesterification of palm oil and hydrogenated soybean oil[J].J Am Oil Chem Soc,2003,80(12):1193-1196.
[2]Park K,Kim H,Maken S,et al.Characteristics of the lipase from Candida rugosa modified with copolymers of pol yoxyethylene derivative and maleic acid anhydride[J].Korean J Chem Eng,2005,22(3):412-417 .
[3]Babali B,Tuter M,Ustun G.Enzymatic esterification of(-)-menthol with lauric acid in isooctane by sorbitan monostearate-coated lipase from Candida rugosa[J].J Am Oil Chem Soc,2001,78(2):173-175.
[4]Ponvel K M,Lee D G,Woo E J,et al.Immobilization of lipase on surface modified magnetic nanoparticles using alkyl benzenesulfonate[J].Korean J Chem Eng,2009,26(1):127-130.
[5]Rønne T H,Pedersen L S,Xu X B.Triglyceride selectivity of immobilized Thermomyces lanuginosa lipase in interesterification[J].J Am Oil Chem Soc,2005,82(10):737-743 .
[6]Basheer S,Cogan U,Nakajima M.Esterification kinetics of long-chain fatty acids and fatty alcohols with a surfactant-coated lipase in n-hexane[J].J Am Oil Chem Soc,1998,75(12):1785-1790.
[7]Mogi K I,Nakajima M.Selection of surfactantmodified lipases for interesterification of triglyceride and fatty acid[J].J Am Oil Chem Soc,1996,73(11):1505-1512.
[8]Mogi K I,Nakajima M,Mukataka S.Surfactant modification of lipases for lipid interesterification and hydrolysis reactions[J].J Am Oil Chem Soc,1999,76(11):1259-1264.
[9]Wu J C,Song B D,Xing A H,et al.Esterification reactions catalyzed by surfactant-coated Candida rugosa lipase in organic solvents[J].Process Biochemistry,2002,37(11):1229-1233.
[10]Isono Y,Nabetani H,Nakajima M.Lipase-surfactant complex as catalyst of interesterification and esterification in organic media[J].J Ferment Bioeng,1995,80(2):170-175.
[11]Masahiro G,Noriho K,Masaki M,et al.Enzymatic esterification by surfactant-coated lipase in organic media[J].Biotechnol Prog,1994,10(3):263-268.
[12]Thakar A,Madamwar D.Enhanced ethyl butyrate production by surfactant coated lipase immobilized on silica[J].Proc Biochem,2005,40(10):3263-3266.
[13]曾俊,杨国龙,毕艳兰,等.乙醇溶液体系中Span 修饰猪胰脂酶的研究[J].食品工业科技,2011,32(9):187-189.
[14]张洁,杨国龙,毕艳兰,等.乙醇溶液中Tweens对猪胰脂酶的修饰作用[J].食品与发酵工业,2012,38(2):44-45.
[15]Kamiya N,Murakami E,Goto M,et al.Effect of using a co-solvent in the preparation of surfactant-coated lipases on catalytic activity in organic media[J].J Ferment Bioeng,1996,82(1):37-41.
