肝素对家兔心肺复苏后炎性因子的影响研究
2013-04-20王白永孙仁华屈百鸣郭振军
王白永,孙仁华,屈百鸣,郭振军
心肺复苏(CPR)是对心搏骤停患者采取的维持人工循环和通气的关键技术和方法,及时、有效的CPR可明显提高患者的生存率[1]。CPR后随着自主循环的建立会出现再灌注损伤,其程度影响着CPR患者的预后[2]。缺血再灌注损伤是一个包括中性粒细胞活化、多种因子及黏附分子过度表达、伴有多种炎性递质及信号传导分子参加的复杂过程。研究发现,肝素可通过多种机制或途径起到抗炎作用[3],并对炎症级联反应中的多种炎性递质有抑制作用。本研究的目的即观察肝素对家兔CPR后核转录因子κB (NF-κB)、肿瘤坏死因子α(TNF-α)的影响。
1 材料与方法
1.1 实验动物及分组 健康实验用新西兰家兔40只,雌雄各半,体质量2.0~2.5 kg,由杭州医学科学院提供,动物合格证号2009SCXK(浙)2009-0039。饲养于清洁环境中,自由饮水,12 h光照。采用随机数字表法分3组:正常对照组8只;肝素组16只,给予肝素钠200 U/kg;0.9%氯化钠溶液组16只,给予0.9%氯化钠溶液2 ml/kg。
1.2 手术操作 术前12 h禁食不禁水,20%乌拉坦3 ml/kg经兔耳缘静脉缓慢推注,麻醉成功后,背部固定于家兔试验手术台,用动物皮肤电极连接标准导联进行心电监护,常规消毒皮肤,沿颈正中线纵行切开皮肤、气管,置入小儿气管导管,吸入氧气3 L/min,缝合局部皮肤,分离右侧股动脉,缓慢置入动静脉留置针,监测血压。
1.3 诱发心室纤颤和CPR[4]肝素组和0.9%氯化钠溶液组采用家兔体表贴膜法电刺激诱导心室纤颤,在胸壁心尖搏动点和右锁骨下分别粘贴贴膜,接通100 V交流电,连续放电6 s后,观察心电图和动脉压力波形,必要时重复直至出现心室纤颤波形,平均动脉压<20 mm Hg(1 mm Hg=0.133 kPa),心室纤颤5 min后,按分组给予肝素钠200 U/kg或等量0.9%氯化钠溶液,用除颤仪接贴膜60 J除颤1次,并接小动物呼吸机辅助通气,容控模式,潮气量10 ml/kg,呼吸频率45 次/min,吸入氧浓度100%,并于胸外心脏按压,频率180 次/min,按压深度为胸廓前后径的1/3,耳缘静脉推注肾上腺素20 μg/kg,除颤不超过3次,所有上述操作均在3 min内完成。CPR成功标准为心电图出现窦性心律,平均动脉压稳定在60 mm Hg以上,并维持5 min为自主循环恢复,记录CPR时间及自主呼吸恢复时间,自主呼吸恢复后停止机械通气,继续通过气管导管吸氧(流量3 L/min)。CPR成功动物在CPR后按既定时间点持续观察,在此期间不给予其他药物。CPR 5 min未恢复自主循环者,为CPR失败,停止抢救。
1.4 血流动力学数据采集 分别于造模前、CPR成功即刻(T0)、CPR成功后1 min(T1)、30 min(T2)、60 min(T3),记录心率、平均动脉压。
1.5 心室肌标本采集 空白对照组气管插管,股动脉置管后处死家兔,肝素组和0.9%氯化钠溶液组分别于CPR成功后1 h处死家兔取左心室心肌厚3 mm,采用免疫组织化学方法(北京康为世纪生物科技有限公司)测定心肌NF-κB活化情况[5]。
1.6 免疫组织化学结果的判定 显微镜观察并予以表达量高低评分。NF-κB阳性定位于心肌细胞核及细胞质内,阳性呈黄色或黄褐色。计分标准,参考Arai等[6]的计分标准,按着色细胞染色强度及面积计分:基本不着色者为0分,着色淡者为1分,着色适中者为2分,着色深者为3分;着色细胞占计数细胞的百分率≤5%记0分,6%~25%记1分,26%~50%记2分,≥51%记3分。将每张切片的染色程度与染色细胞百分率得分相乘,其乘积为最后得分。0~1分为阴性(-),2~3分为弱阳性(+),4~6分为中等阳性(++),>6分为强阳性(+++)。将表达(-/+)划为低表达组,(++~+++)划为高表达组。
1.7 心肌TNF-α含量测定 空白对照组、肝素组和0.9%氯化钠溶液组处死家兔,取心肌称重,加入液氮手工研磨,磨成粉末后加入一定量磷酸盐缓冲液(PBS)(pH=7.4)使标本匀浆化,2 000~3 000 r/min,离心半径13.5 cm,4 ℃低温离心20 min,收集上清液,保存于-80 ℃冰箱。严格按试剂盒操作用酶联免疫吸附剂法(ELISA)测心肌TNF-α含量。
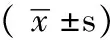
2 结果
2.1 3组心室纤颤前体质量、心率、平均动脉压比较 3组心室纤颤前体质量、心率、平均动脉压比较,差异均无统计学意义(P>0.05,见表1)。
2.2 肝素组与0.9%氯化钠溶液组CPR效果比较 电击致颤后,肝素组与0.9%氯化钠溶液组均出现心室纤颤,各组均死亡1只,标准体外CPR后,肝素组自主循环恢复时间较0.9%氯化钠溶液组缩短,差异有统计学意义(P<0.05);两组自主呼吸恢复时间及CPR成功率比较,差异均无统计学意义(P>0.05,见表2)。
2.3 肝素组与0.9%氯化钠溶液组CPR后心率和平均动脉压变化比较 肝素组与0.9%氯化钠溶液组CPR后不同时间点心率和平均动脉压比较,差异均有统计学意义(心率:F组间=66.54,F时间=88.80,P<0.001;平均动脉压:F组间=101.86,F时间=2.36,P<0.001,见表3)。

表1 实验前各组家兔基本生理指标情况
表2 肝素组与0.9%氯化钠溶液组CPR效果比较
Table2 Comparison of the efficacy of CPR between the heparin group and the sodium chloride solution group

组别只数自主循环恢复时间(s)自主呼吸恢复时间(s)CPR成功率肝素组15100±10370±10314/1509%氯化钠溶液组15157±23420±1219/15检验统计量值-865∗-127∗466P值<001 022 008
注:*为t值,余检验统计量值为χ2值;CPR=心肺复苏
2.4 CPR后心肌NF-κB表达情况 光镜下可见正常对照组心肌细胞内有散在颗粒状棕黄色沉淀物,其NF-κB为低水平表达(见图1A);肝素组可见胞内有较多点颗粒及条索状棕黄色沉淀,其NF-κB为低水平表达(见图1B);0.9%氯化钠溶液组可见细胞核内及胞质遍布颗粒及条索状棕褐色沉淀物,NF-κB呈高水平表达(见图1C)。3组NF-κB表达情况比较,差异有统计学意义(u=43.00,P<0.05);其中肝素组和0.9%氯化钠溶液组NF-κB高表达率较正常对照组升高,0.9%氯化钠溶液组较肝素组升高,差异均有统计学意义(P<0.05,见表4)。

表4 家兔CPR后心肌NF-κB表达情况(只)
2.5 CPR后心肌TNF-α含量比较 CPR 1 h后心肌TNF-α含量正常对照组为(126±23)pg/ml,肝素组为(221±36)pg/ml,0.9%氯化钠溶液组为(300±29)pg/ml,3组比较差异有统计学意义(F=135.21,P<0.01);0.9%氯化钠溶液组较肝素组升高,差异有统计学意义(q=-8.11,P<0.01)。
2.6 NF-κB的表达量与TNF-α含量的相关性 经Spearman相关分析,NF-κB的表达量与TNF-α含量呈正相关(r=0.801,P<0.01,见图2)。
3 讨论
在CPR发展的50年过程中,尽管已逐渐提高了CPR的成功率,但其预后一直是一个重大难题。其机制与缺血-再灌注、缺氧、应激等一系列病理生理改变有关。国外研究发现,肝素可阻止由于缺血再灌注引起的心肌损伤[7]。家兔体表贴膜法电刺激诱导心室纤颤,不需开胸,避免开胸直接刺激家兔心脏以及对其他组织器官的影响,造模简便、易于操作[8],为家兔心搏骤停模型的常用方法。本研究在该模型基础上,给予肝素钠或等量0.9%氯化钠溶液,之后进行CPR,比较各组CPR成功率及NF-κB、TNF-α的表达水平。结果发现,肝素用于电击所致的家兔心室纤颤后,与0.9%氯化钠溶液组比较,可使家兔自主循环恢复时间缩短,心率和平均动脉压升高,NF-κB、TNF-α的表达水平降低;CPR成功率虽有一定的提高,但二者比较无差异,可能与实验动物数量有关。

表3 肝素组与0.9%氯化钠溶液组CPR后不同时间点心率和平均动脉压变化比较

注:A:正常对照组,B:肝素组,C:0.9%氯化钠溶液组
图1 家兔CPR后心肌NF-κB的免疫组织化学结果(DAB染色,×200)
Figure1 The immunohistochemical results of NF-κB in the rabbits′ myocardium after CPR

图2 家兔CPR后心肌NF-κB表达量与TNF-α含量的相关性
Figure2 The correlation between the expression of NF-κB and the level of TNF-α in the rabbits′ myocardium after CPR
研究发现,肝素除具有抗凝血、抗血栓、抗炎、免疫调节、调节多肽生长因子、抑制细胞增殖、抗肿瘤转移等多种生物学活性和药理作用之外[7],还具有阻抑白细胞黏附活化,抑制补体的激活,保护血管内皮细胞免受趋化因子、组胺、细菌内毒素及氧自由基等损伤以及维持内皮细胞完整性等作用,这可能与肝素分子中存在多种可与黏附分子、细胞因子、补体等炎性递质、内皮细胞等结合的活性或受体部位以及聚糖结构有关。Yao等[9]和Li等[10]在Wistar大鼠离体心脏缺血再灌注模型中发现肝素可以抑制TNF-α的合成及缺血期离体心脏TNF-α的释放,从而可以阻止由于缺血再灌注心肌损伤引起的左室功能低下。此外,近年来对心肌缺血再灌注损伤的研究表明,NF-κB转录产生的细胞因子TNF-α可激活血液及全身组织炎症细胞引起炎症的“瀑布效应”,并直接引起血管内皮细胞和心肌细胞的损伤[9],甚至引起多脏器功能衰竭。因此,改善CPR后血流动力学,同时抑制心肌NF-κB的活化、减少TNF-α的释放对改善CPR后患者的预后有着重要的意义。本研究发现肝素用于经皮电击致心室纤颤的家兔后,可以使家兔心肌NF-κB表达量降低、TNF-α含量减少,使家兔自主循环恢复时间缩短。其机制可能与肝素能较快改善家兔CPR后血流动力学,同时抑制心肌NF-κB的活化,使TNF-α的释放减少,减轻缺血再灌注心肌损伤有关。本研究存在一定的不足,没有设置不同浓度的肝素实验组;且实验动物数量不足,造模后各组动物只数不一致,使得量效关系和CPR成功率的分析上仍有欠缺。
本研究提示临床CPR中给予肝素治疗,将有可能提高CPR的成功率,同时改善患者预后,但同时还要注意肝素应用可能导致的出血等并发症。因此,其临床应用中还有待进一步研究。
1 Dorn C,Massinger S,Wuzik A,et al.Xanthohumol suppresses inflammatory response to warm ischemia-reperfusion induced liver injury[J].Exp Mol Pathol,2013,94(1):10-16.
2 Laca L,Olejnik J,Vician M,et al.The effects of occlusive techniques on the short-term prognosis after liver resections[J].Hepatogastroenterology,2006,53(70):576-579.
3 Bozok S,Ilhan G,Yilmaz Y,et al.Protective effects of hyperbaric oxygen and iloprost on ischemia/reperfusion-induced lung injury in a rabbit model[J].Eur J Med Res,2012,17:14.
4 Ye L,Luo CZ,McCluskey SA,et al.Propofol attenuates hepatic ischemia/reperfusion injury in an in vivo rabbit model[J].J Surg Res,2012,178(2):e65-70.
5 Relja B,Töttel E,Breig L,et al.Plant polyphenols attenuate hepatic injury after hemorrhage/resuscitation by inhibition of apoptosis,oxidative stress,and inflammation via NF-kappaB in rats[J].Eur J Nutr,2012,51(3):311-321.
6 Arai F,Kita T,Nakai T,et al.Histopathologic features of fat embolism in fulminant fat embolism syndrome[J].Anesthesiology,2007,107(3):509-511.
7 Xie X,Rivier AS,Zakrzewicz A,et al.Inhibition of selectin-mediated cell adhesion and prevention of acute inflammation by nonanticoagulant sulfated saccharides.Studies with carboxyl-reduced and sulfated heparin and with trestatin a sulfate[J].J Biol Chem,2000,275(44):34818-34825.
8 Chen MH,Xie L,Liu TW,et al.Epinephrine,but not vasopressin,improves survivalrates in an adult rabbit model of asphyxia cardiac arrest[J].Am J Emerg Med,2007,25(5):509-514.
9 Yao JR,Shi X,Hu S,et al.Effect of electroacupuncture on inflammatory injury induced by intestinal ischemia/reperfusion in rats[J].Zhongguo Zhen Jiu,2012,32(7):625-629.
10 Li SY,Fung FK,Fu ZJ,et al.Anti-inflammatory effects of lutein in retinal ischemic/hypoxic injury:in vivo and in vitro studies[J].Invest Ophthalmol Vis Sci,2012,53(10):5976-5984.
