糖尿病肾病血液透析患者发生肺炎及死亡相关危险因素分析
2013-09-06曾健英童俊容张建林罗正茂
曾健英,童俊容,张建林,罗正茂,张 虹
在血液透析 (hemodialysis,HD)患者中,感染是仅次于心血管疾病的主要死亡原因,而在全部感染导致的死亡病例中,约1/5是由肺炎引起的[1]。HD患者肺部感染的死亡率是普通人的14~16倍[2]。Slinin等[3]报道HD患者肺炎导致的5年累积住院率是36%。
糖尿病患者容易出现各种感染,主要包括肺炎、尿路感染及皮肤感染[4-5]。糖尿病患者发生肺炎的风险增加可能是由于高血糖、异物吸入的风险增加、免疫力下降、肺部微血管病变、肺功能受损及其他合并症[6]。而且,约40%的糖尿病患者出现糖尿病肾病 (diabetic nephropathy,DN),并成为终末期肾病 (end-stage renal diseases,ESRD)的主要病因,从而进一步削弱机体抵御肺部感染的能力,其原因包括高龄、尿毒症状态及合并症的出现[3,7-8]。然而,目前关于合并DN的HD患者肺炎发生率、死亡风险和预后的研究相对较少,本研究旨在探讨HD患者的临床特征及死亡相关危险因素,为临床诊治提供参考。
1 对象与方法
1.1 研究对象 选择2007年1月—2012年1月在广州军区广州总医院肾内科血液净化中心规律HD治疗≥3个月、年龄≥18岁的ESRD患者1 145例,其中男671例,女474例;平均年龄 (48.3±15.7)岁;平均随访时间为23.8个月。根据是否合并DN分为DN组190例和non-DN组955例。所有患者签署知情同意书且病情稳定,3个月内未接受外科手术,无严重肝功能受损。
1.2 方法
1.2.1 HD方案 所有患者接受规律HD,2~3次/周,4~5 h/次。透析中血流量200~300 ml/min,使用碳酸氢盐透析液,透析液流量500 ml/min,温度35.5~36.5℃,透析液钠离子138 mmol/L,钙离子1.25~1.50 mmol/L,钾离子2.0 mmol/L。根据凝血情况应用普通肝素或低分子肝素抗凝。
1.2.2 观察指标 收集入组时患者的人口学统计资料、血常规、肝功能、肾功能、血电解质、血压、C-反应蛋白 (C-reactive protein,CRP)及估计肾小球滤过率 (estimated glomerular filtration rate,eGFR)检查结果等。
1.3 统计学方法 计数资料以百分比表示,采用χ2检验;计量资料以 (±s)或中位数 (上四分位数,下四分位数)表示,采用t检验或非参数秩和检验。生存分析采用多因素Cox回归分析,选入变量为P≤0.05,剔除变量为P>0.01。采用寿命表计算两组的累积全因死亡率和肺炎相关的死亡率。两组间累积的全因死亡和肺炎相关死亡风险采用Kaplan-Meier曲线和Cox回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较 DN组患者的年龄,体质指数 (BMI),糖尿病、高血压、冠心病发生率,eGFR、CRP水平均较non-DN组高 (P<0.05);卒中发生率,舒张压 (DBP)、平均动脉压(MAP)、血清清蛋白水平均较non-DN组低,差异有统计学意义 (P<0.05);其他指标比较,差异均无统计学意义(P>0.05,见表1)。随访期间有25例患者失访,60例转腹膜透析,151例接受肾移植,35例转至其他中心,8例因为依从性差退出本研究。
2.2 肺炎发生率比较 DN组患者中肺炎发生率为12.6%(24例,62.3/1 000病人年),高于non-DN组的5.6%(54例,28.5/1 000病人年),且差异有统计学意义 (χ2=12.152,P<0.05)。
2.3 肺炎患者死亡危险因素的Cox回归分析 将年龄,BMI,高血压、冠心病、卒中发生率,DBP、MAP、eGFR、CRP、血清清蛋白代入单因素Cox回归分析,结果显示年龄增加和血清清蛋白降低是肺炎患者死亡的危险因素。将年龄和血清清蛋白代入多因素Cox回归分析,结果显示年龄增加是肺炎患者死亡的独立危险因素 (见表2)。
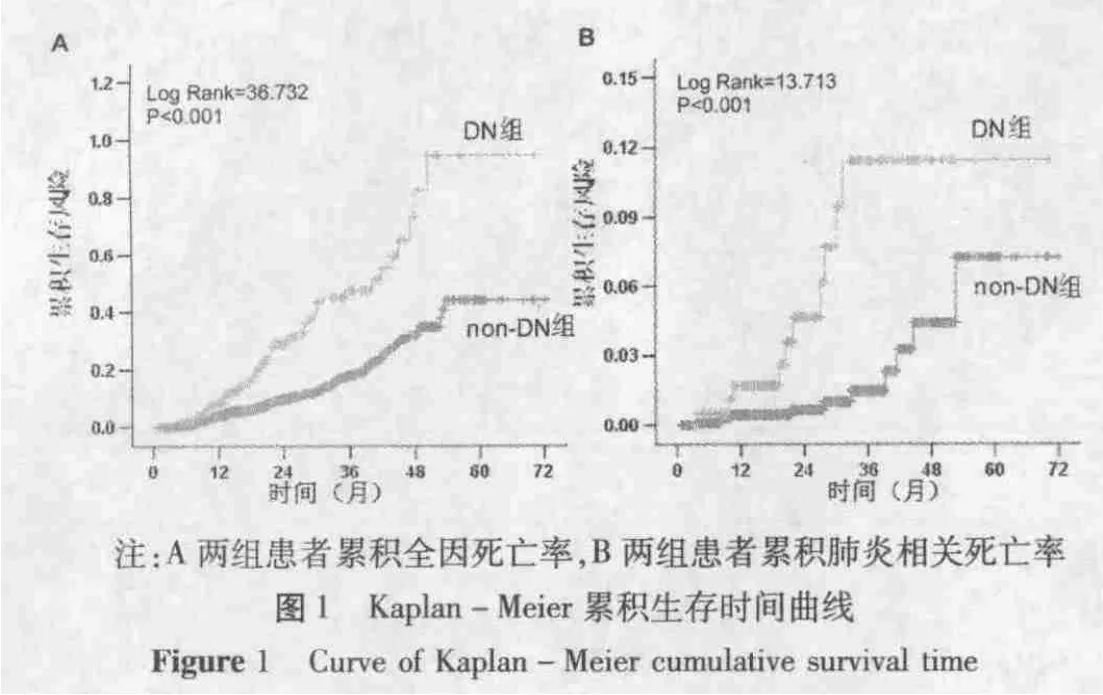
2.4 生存分析 Kaplan-Meier累积生存时间分析曲线显示,DN组患者中全因死亡为57例、non-DN组为107例,DN组1、3、5年累积全因死亡率均高于non-DN组〔分别是25%、50%、58%,9%、24%、33%,HR =2.608,95% CI(1.890,3.599),P<0.001,见图1A〕;DN组患者中肺炎相关死亡为10例、non-DN组为11例,DN组1、3、5年累积肺炎相关死亡率均高于 non-DN组〔分别是4%、10%、23%,1%、4%、6%,HR =4.424,95% CI(1.871,10.461),P <0.001,见图1B〕。
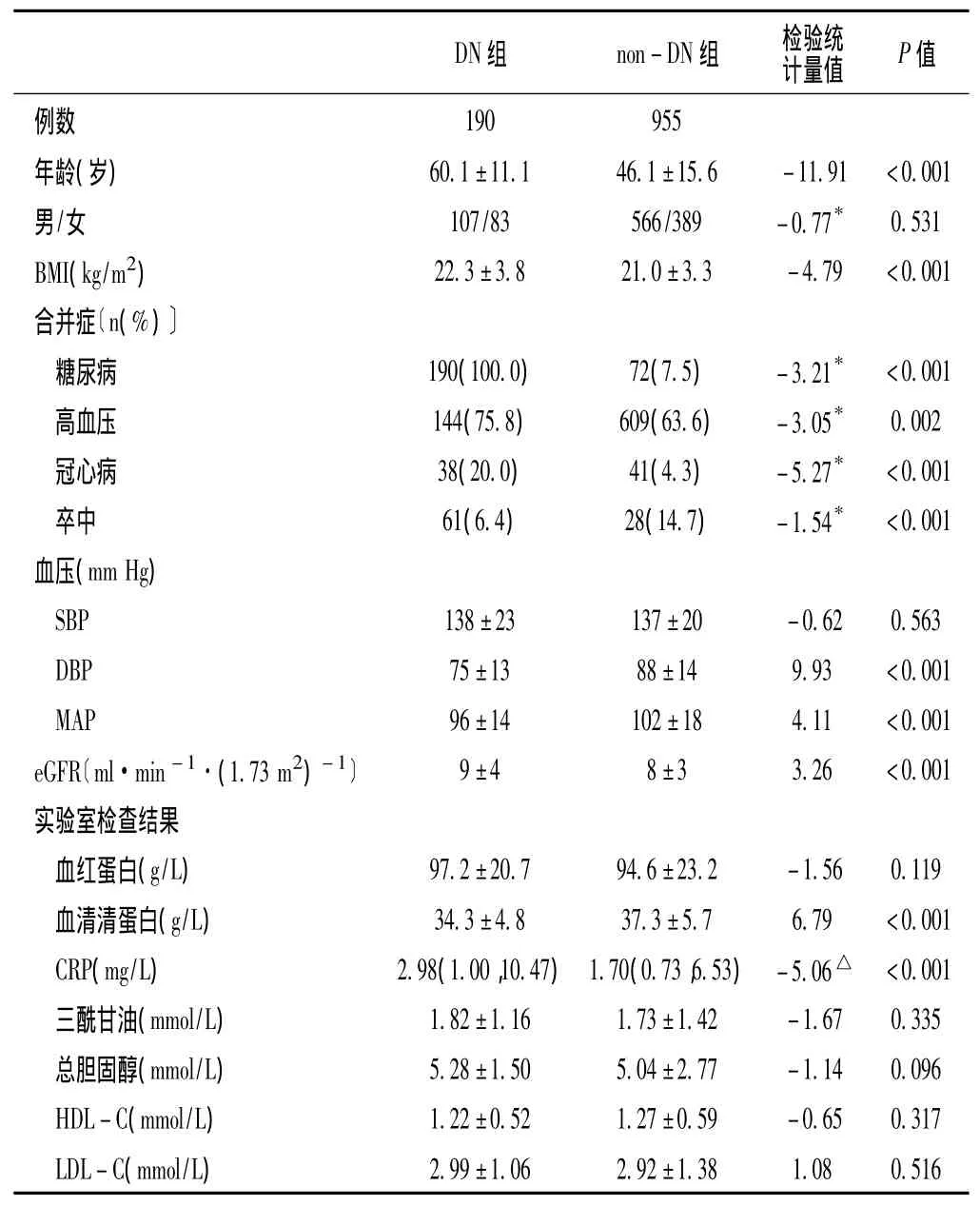
表1 两组患者一般资料比较Table 1 Comparison of the general data between the two groups

表2 肺炎患者发生死亡的危险因素分析Table 2 Analysis of risk factors for mortality in patients with pneumonia
3 讨论
本研究显示,HD患者中合并DN患者的肺炎发生率和全因死亡率、肺炎相关死亡率均明显高于未合并DN的患者,且高龄是发生肺炎的HD患者死亡的独立危险因素。
HD患者发生肺炎的临床流行病学情况一直很少受到关注,2006年美国肾脏病数据系统 (USRDS)调查发现,在普通透析患者中,由于肺炎导致的住院率约为115/1 000病人年[1]。D'Agata等[9]研究表明,住院的 HD 患者较非 HD 患者更容易院内感染肺炎。Guo等[10]报道,HD患者肺炎发生率为29.0/1 000病人年,高于腹膜透析患者肺炎作为第一诊断的住院率 (18.2/1 000病人年)。在本研究中,合并DN的HD患者肺炎发生率为62.3/1 000病人年,明显高于non-DN的HD患者的28.5/1 000病人年。本研究人群的肺炎发生率低于之前研究报道的肺炎发生率,可能原因是,一方面,本研究应用了统一的且相对严格的胸部X线诊断肺炎,可能会漏诊一些影像学并未发生改变的肺炎病例;另一方面,本研究的患者主要来自广东省,该地域气候宜人,肺炎发生率相对较低。重要的是,本研究发现合并DN的HD患者容易罹患肺炎。
糖尿病常出现多种并发症,如高血压、缺血性心脏病、左心室肥厚、心律失常、DN、动脉硬化性闭塞、糖尿病视网膜病变、高糖血症及脂质紊乱,而这些并发症通常在HD之前即可出现[11]。本研究中,合并DN的HD患者,年龄相对较大,有更多的合并症如高血压、冠心病。而且,本研究发现,高龄是HD肺炎患者发生死亡的独立危险因素,该结果与之前的相关研究结果一致[12-13]。
Sarnak等[2]报道,HD患者肺部感染的死亡率较普通人群高14~16倍。本研究中,合并DN的HD患者肺炎相关的死亡率为5.3%,是non-DN的HD患者的5倍。合并DN的HD患者的累积肺炎相关死亡的风险比为4.424。而且,合并DN的HD患者的累积全因死亡的风险比为2.608。即合并DN的HD患者的累积全因死亡和肺炎相关的死亡风险均高于non-DN的HD患者。
Vardakas等[14]认为糖尿病患者的免疫功能低下,因此更容易受到感染。ESRD被广泛理解为炎症状态、内皮功能和氧化还原功能障碍[15-17]。微炎症是心血管疾病的一个关键的发病机制[18]。
综上所述,合并DN的HD患者可能存在长期免疫抑制,且由于尿毒症的内部环境和共存的严重合并症,肺炎会导致微炎症的出现。合并DN的HD患者肺炎的发生率和随后的肺炎相关的死亡风险均增加,可能与肺炎导致的微炎症活动有关。
1 System UD.National institutes of health[Z].2006.
2 Sarnak MJ,Jaber BL.Pulmonary infectious mortality among patients with end-stage renal disease[J].Chest,2001,120(6):1883-1887.
3 Slinin Y,Foley RN,Collins AJ.Clinical epidemiology of pneumonia in hemodialysis patients:the USRDS waves 1,3,and 4 study[J].Kidney Int,2006,70(6):1135 -1141.
4 Benfield T,Jensen JS,Nordestgaard BG.Influence of diabetes and hyperglycaemia on infectious disease hospitalisation and outcome[J].Diabetologia,2007,50(3):549-554.
5 Shah BR,Hux JE.Quantifying the risk of infectious diseases for people with diabetes[J].Diabetes Care,2003,26(2):510 -513.
6 Kaparianos A,Argyropoulou E,Sampsonas F,et al.Pulmonary complications in diabetes mellitus[J].Chron Respir Dis,2008,5(2):101-108.
7 Remuzzi G,Macia M,Ruggenenti P.Prevention and treatment of diabetic renal disease in type 2 diabetes:the BENEDICT study[J].J Am Soc Nephrol,2006,7(4 Suppl 2):S90 -S97.
8 Xie Y,Epidemiology CX,outcomes M,et al.Prevention and management of chronic kidney disease in China[J].Am J Nephrol,2008(28):1-7.
9 D'Agata EM,Mount DB,Thayer V,et al.Hospital-acquired infections among chronic hemodialysis patients[J].Am J Kidney Dis,2000,35(6):1083-1088.
10 Guo H,Liu J,Collins AJ,et al.Pneumonia in incident dialysis patients——the United States Renal Data System[J].Nephrol Dial Transplant,2008,23(2):680 -686.
11 Kuriyama S.Peritoneal dialysis in patients with diabetes:are the benefits greater than the disadvantages?[J].Perit Dial Int,2007,27(Suppl 2):S190-S195.
12 Yende S,Angus DC,Ali IS,et al.Influence of comorbid conditions on long-term mortality after pneumonia in older People[J].J Am Geriatr Soc,2007,55(4):518-525.
13 O'Meara ES,White M,Siscovick DS,et al.Hospitalization for pneumonia in the Cardiovascular Health Study:incidence,mortality,and influence on longer-term survival[J].J Am Geriatr Soc,2005,53(7):1108-1116.
14 Vardakas KZ,Siempos II,Falagas ME.Diabetes mellitus as a risk factor for nosocomial pneumonia and associated mortality[J].Diabet Med,2007,24(10):1168-1171.
15 Stenvinkel P,Heimbürger O,Paultre F,et al.Strong association between malnutrition,inflammation,and atherosclerosis in chronic renal failure[J].Kidney Int,1999,55(5):1899 -1911.
16 Miyamoto T,Carrero JJ,Stenvinkel P.Inflammation as a risk factor and target for therapy in chronic kidney disease[J].Curr Opin Nephrol Hypertens,2011,20(6):662 -668.
17 Piroddi M,Depunzio I,Calabrese V,et al.Oxidatively - modified and glycated proteins as candidate pro-inflammatory toxins in uremia and dialysis patients[J].Amino Acids,2007,32(4):573 -592.
18 Navab KD,Elboudwarej O,Gharif M,et al.Chronic inflammatory disorders and accelerated atherosclerosis:chronic kidney disease[J].Curr Pharm Des,2011,17(1):17 -20.
