一例肺动脉肉瘤误诊为肺血栓栓塞症的病例思考
2013-04-19米玉红
梁 颖,米玉红,刘 双,陈 东,方 微
1 病例简介

X线(2011-08-09):双肺结节,右肺门增大。超声心电图(UCG):右心扩大、右房室瓣反流(轻度)、肺动脉高压(轻~中度)。腹部B超:肝血管瘤、胆囊多发息肉及胆固醇结晶、右下腹囊性结构,阑尾黏液囊肿。多层螺旋CT肺功能:通气功能、弥散功能、气道阻力、残气量等指标正常。支气管激发试验:(-)。多层螺旋CT肺动脉造影(CTPA)(2011-08-10):左右肺动脉干管腔内密度不均匀的充盈缺损,并向叶、段分支动脉延伸(见图2)。
初步诊断:肺栓塞、高血压、肝囊肿、胆囊息肉、胆囊结石。于2011-08-10给予重组人组织型纤溶酶原激活剂(rt-PA)50 mg溶栓治疗,之后给予低分子肝素0.6 U,1次/12 h,皮下注射以及华法林3 mg,1次/晚,抗凝。2011-08-12复查CTPA:溶栓治疗前后对比CTPA变化不大(见图3)。

双下肢深静脉彩色多普勒超声:(-)。UCG:肺动脉高压(中度)、右房室瓣反流(中度)、双房增大。住院后给予“肺动脉切开取栓术”。肉眼所见:左右肺动脉增宽,肺动脉压89 mm Hg,肉眼可见鱼肉样物质以及血栓混合物。切开肺动脉行清除术,左肺动脉彻底清除,右肺动脉大部分清除,并取病理送检。术后病理报告:肉眼所见:(肺动脉血栓)灰白破碎软组织,11 cm×8 cm×2 cm,部分组织灰白胶胨样。病理诊断:肺动脉组织学形态及免疫组化表型符合肺动脉肉瘤伴平滑肌及血管分化。免疫组化表型:波形蛋白(Vimentin)(少部分+),肌特异性肌动蛋白(muscle-specific actin,MSA)(+),平滑肌肌动蛋白 (SMA)(+),CD34(部分+),结蛋白(Desmin)(部分弱+),细胞角蛋白AE1/AE3(-),CD31(-),Ki-67(indes约50%),肌红蛋白(Myoglobin)(-)(见图5~6)。
最后确定诊断:肺动脉肉瘤(PAS)、肺栓塞、高血压、肝囊肿、胆囊息肉、胆囊结石。术后病情尚稳,于2011-09-13出院,出院后继续给予抗凝等治疗。
2011-11-10患者主因:“咳嗽、咳痰伴活动后喘憋、不能平卧20余日”再次住我院急诊重症监护病房治疗。此次住院主要症状:咳嗽、咳痰,咳黄色黏痰,伴有喘憋、胸闷,夜间不能平卧,声嘶,咯血。查体:左锁骨上淋巴结肿大,质硬,无触痛,双肺呼吸音粗,左肺可闻及湿性啰音。X线(2011-11-10)提示:开胸术后,上纵隔增宽,纵隔右移,气管向右偏曲,未见明显变窄。左肺中内带可见大片致密影,左下肺膨胀不全,右肺中野可见片状模糊影,主动脉迂曲,左心缘显示不清,两侧胸膜增厚,左膈抬高,左膈面消失,左肋膈角钝,右肋膈角可辨(见图7)。
UCG(2011-11-10)示:肺动脉段增宽,心包积液(少量)。B超(2011-11-11)示:左侧胸腔积液。双下肢静脉超声(2011-11-11)示:未见异常。胸部CT(2011-11-11)使:左肺内多发病变,性质待定、纵隔内多发淋巴结,左侧胸腔积液,左肺膨胀不全,右侧肺大泡,心包积液(见图8)。
CTPA(2011-11-16)示:肺动脉内膜剥脱术后,PAS,伴纵隔淋巴结转移,左肺膨胀不全,左侧胸腔积液。治疗方面:抽取胸腔积液(血性),抗感染、化痰、营养支持、华法林抗凝、对症等处理。
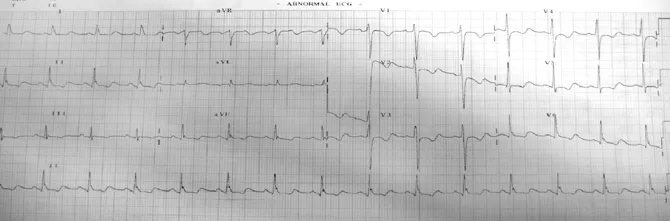
图1 患者入院时心电图提示窦性心率,非特异性ST-T改变
Figure1 The patient′s ECG on admission showed sinus rhythm,nonspecific ST-T changes

图2 患者溶栓前CTPA提示左、右肺动脉干管腔内密度不均匀的充盈缺损,并向叶、段分支动脉延伸
Figure2 The patient′s CTPA before thrombolysis showed uneven density filling defect within the lumen of the left and righ pulmonary trunk,extending to branch arteries of the lungs or lung segments

图3 患者溶栓后CTPA和溶栓前比较变化不大
Figure3 The patient′s CTPA showed little change before and after thrombolytic

图4 患者的肺灌注/通气显像提示双肺血流灌注及通气显像不匹配,多发肺段及亚肺段肺栓塞(累及13个肺段以及亚肺段),右肺上叶、中叶以及左肺上叶前段通气功能部分受损
Figure4 The patient′s pulmonary perfusion / ventilation imaging showed lung perfusion and ventilation imaging did n′t match,the multiple lung segments and subsegmental pulmonary embolism (involving 13 lung segments and subsegments),ventilatory function of the right upper lobe,middle lobes and the left upper lobe the preceding paragraph damaged partly

图5~6 患者PAS病理学改变提示肺动脉组织学形态及免疫组化表型符合PAS伴平滑肌及血管分化
Figure5~6 The patient′s changes in pathology of PAS showed the pulmonary histological morphology and immunohistochemical phenotype conform pulmonary artery sarcoma associated with smooth muscle and vascular differentiation

图7 患者住急诊重症监护病房时胸片提示上纵隔增宽,气管向右偏,左肺中内带可见大片致密影,左下肺膨胀不全,右肺中野可见片状模糊影,主动脉迂曲,左心缘显示不清,两侧胸膜增厚,左膈抬高,左膈面消失,左肋膈角钝,右肋膈角可辨
Figure7 The patient′s chest radiograph in emergency intensive care unit showed upper mediastinal widening,trachea to the right side,with the visible large tracts of dense shadow in left lung,lower left lung atelectatic,the visible flakes fuzzy shadow in the right lung Nakano,aortic tortuosity,left heart border is unclear,both sides of pleural thickening,left diaphragmatic elevation,the left diaphragmatic surface disappear,left costophrenic angle blunt,rihgt costophrenic angle legible
2 讨论
PAS是一种心血管系统的肿瘤,起源于肺动脉内膜的恶性疾病,临床极其罕见。极易误诊为肺血栓栓塞症(PTE)或其他疾病,从而影响患者的预后。1923年Mandel-stanmm在进行尸体解剖时首先发现并报道了这种疾病。国外文献累计报道近200例,国内1999年始有报道,手术病理证实大约10余例[1]。本病发病年龄13~81岁,诊断时平均49.3岁,性别分布大致相等[2]。本病的确切发生率不详,有报道为0.001%~0.030%。确诊时50%已有肺转移,16%已有远处转移。本病容易被误诊,常需要手术或尸检才能明确诊断,发病率常被低估[3]。
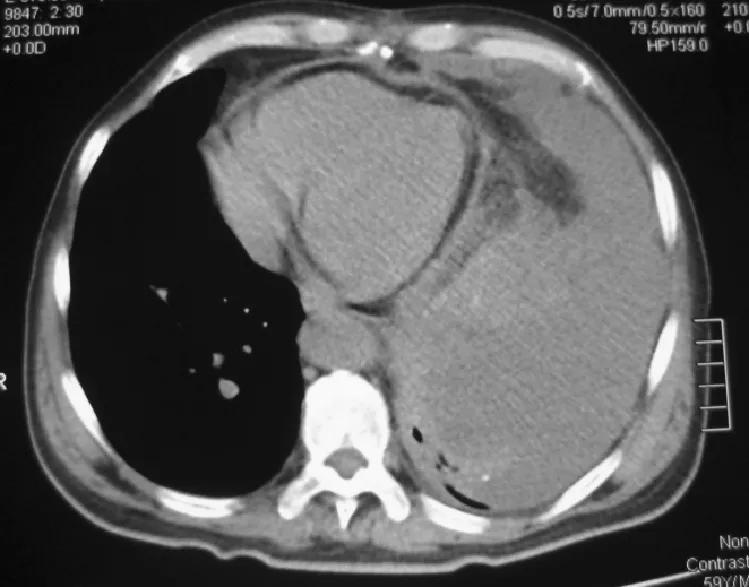
图8 患者胸部CT 提示左侧胸腔积液、左肺膨胀不全、心包积液
Figure8 The patient′s chest CT showed left pleural effusion,left lung atelectatic,pericardial effusion
PAS临床表现多样,缺乏特异性,多起病隐匿,主要包括与肺动脉高压及右心功能衰竭相关的表现:呼吸困难、胸痛、咳嗽和咯血等。由于病例罕见,PAS的流行病学尚不清楚,发病原因不明。PAS的起源尚不清楚,推测可能来自肺动脉干球状索的原始细胞,其免疫学标记多样,肿瘤细胞Vimentin和Desmin一般呈阳性反应[3]。本例患者肺动脉组织学形态及免疫组化表型提示PAS伴平滑肌及血管分化。
UCG可检测右心室内径、肺动脉收缩压、心包积液、右室流出道及主肺动脉内占位性病变,有助于PAS的诊断。血管超声可比较准确地判断下肢、下腔、盆腔静脉等部位有无血栓形成,从而在鉴别诊断上具有重要价值,可作为一项临床常规检查。有文献报道[4]:超声心动图对PAS诊断具有的重要的价值。其可以实时显示PAS与主肺动脉及左右肺动脉的关系,与肺动脉管壁的关系(较密切),肉瘤随心动周期的活动度。其次,二维灰阶成像可显示PAS的不均匀实质性回声,有助于肺动脉血栓的新鲜血栓的均匀性弱回声相区别。最后,频谱和彩色多普勒可动态显示狭窄处血流和附加回声的关系,并探及血流速度。超声心动图作为无创、动态、实时、快速的成像方法,为PAS的诊断和手术提供了重要、准确的信息。
PAS的影像学检查:X线显示肺门阴影扩大,肺动脉增宽,外周血管纹理稀疏,肺内结节影,心影扩大等。典型的肺门血管呈“三叶草”征。MRI检查费用昂贵,诊断效果不优于CT,不常规应用,只有对碘造影剂过敏者才可考虑应用。肺动脉造影是一种传统的肺血管病检查方法,近年来随着CTPA的普及和推广,临床上已很少应用。从影像学上如何区分PAS和PTE这两种疾病,需要影像学的鉴别,详见表1。

表1 PAS和PTE的影像学鉴别Table 1 The imaging difference of PAS and PTE
注:PAS=肺动脉肉瘤,PTE=肺血栓栓塞症
在治疗与预后方面:文献报道所有的PAS都是致命的,如无外科干预,诊断后平均寿命为1.5个月[5]。手术后平均存活时间为10个月。治疗的关键是早期诊断和外科手术切除,化疗和放疗益处不大。原发性PAS罕见,早期症状不典型,远期预后极差。
尽管PAS临床罕见,诊断困难,病情凶险,仍然有一些“蛛丝马迹”来鉴别PAS和PTE:(1)PAS起病隐匿,病情进展缓慢,缺乏PTE的突发性。(2)PAS患者多有发热、食欲减退和体质量下降等全身表现。本例患者住院前就有体质量下降的表现。(3)PAS患者一般缺乏引起PTE的栓子来源如下肢深静脉血栓形成等。本例患者住院后多次双下肢深静脉超声均无静脉血栓形成。(4)PAS患者影像学检查多表现为主肺动脉及左、右肺动脉甚至右心室流出道内较大肿块,导致主肺动脉或左、右肺动脉主干几乎闭塞,肿块边界不规则,可见分叶或分隔现象,而这些特征在单侧中心型PTE少见。(5)PAS经抗凝或溶栓治疗后效果不明显[6]。此患者溶栓前后CTPA变化不明显,治疗效果差。当患者出现与肺部体征不相符的呼吸困难时,应及时行相关检查,协助诊断[7]。影像学仍不能很好地区分这两种疾病时,诊断性溶栓治疗也是可以考虑的[8]。
综上,在临床上引起胸闷、气促的疾病很多,本例患者最初诊断为支气管炎,后来诊断为肺栓塞,经过溶栓治疗,效果差,后经手术治疗,病理结果确诊为PAS,大约2个月后,患者病情迅速恶化,出现纵隔淋巴结转移、胸腔积液以及心包积液。由于此病进展迅速,提示临床医生应加强对该病的认识,尽早诊断及治疗该病。对临床上疑似此病原诊为肺栓塞的患者,给予抗凝剂溶栓治疗无效或恶化者,应尽早活检,或手术切除肿物送病理以明确诊断,以延长此类患者的生存期。
1 高元明,刘双.原发性肺动脉肉瘤11例临床分析[J].临床肺科杂志,2010,15(5):671-673.
2 唐慕湘,王代忠,刘平,等.原发性肺动脉肉瘤1例[J].临床与实验病理学杂志,2011,27(8):908-909.
3 孟强,宋云虎,孙立忠,等.原发性肺动脉肉瘤3例并文献复习[J].北京医学,2006,28(11):656-658.
4 孙丹丹,任卫东,陈昕.超声心动图诊断原发性肺动脉肉瘤1例[J].中国医学影像技术,2008,24(12):1862.
5 陈光献,龚风球,罗红鹤,等.肺动脉肉瘤1例报告并文献复习[J].中国误诊学杂志,2009,9(30):7316-7318.
6 熊长明,程显声,柳志红,等.肺动脉肉瘤误诊为肺血栓栓塞症三例原因分析[J].中华结核和呼吸杂志,2004,27(11):737-739.
7 高铁铭.体位改变相关发憋咳嗽呼吸困难诊断为异位甲状腺一例[J].中国全科医学,2011,14(6):2094.
8 罗维贵,黄霞,韦中盛,等.急性肺血栓栓塞症患者溶栓前后影像改变特点的研究[J].实用心脑肺血管病杂志,2011,19(10):1735.
