姜黄素干预人视网膜色素上皮细胞钙离子信号的改变与整合素基因表达的探讨分析
2013-04-19杜颖华叶存喜马景学包永琴郝玉华
杜颖华,叶存喜,马景学,韩 瑶,张 斌,包永琴,郝玉华
增殖性玻璃体视网膜病变(PVR)是一种严重的致盲性眼病,有较高的复发率,治疗效果一直不理想[1]。视网膜色素上皮细胞(RPE)是PVR发生过程中最重要的细胞[2-3]。姜黄素是近年来国内外关注的一种天然药物,可以抗肿瘤、抗纤维化、抗炎、抗菌、抗氧化等,且毒性低[4-15]。细胞内传导中,胞内游离钙离子(Ca2+)作为重要的第二信使参与信息传递,其浓度的变化调节着细胞的代谢、基因表达。而整合素家族是介导细胞与细胞外基质以及细胞间黏附的重要黏附分子家族,它们能诱导细胞的活化、增生、运动和凋亡,在生物体的发育、器官形成、血管新生、炎症反应和创伤愈合等过程中发挥重要作用。安建斌等[16]用不同浓度的姜黄素处理传代培养的兔RPE,结果显示姜黄素可明显抑制其上皮细胞增殖。姜黄素是否可以抑制人RPE的增殖,对细胞内传导信号和细胞外基质有何影响,国内外少有报道。为此我科在体外培养人RPE细胞,姜黄素干预后,利用MTT筛选合适的浓度,激光扫描共聚焦显微镜(LSCM)观察早期细胞内钙离子的荧光强度,实时定量PCR检测整合素的相应变化,探讨相关性。
1 材料与方法
1.1 主要试剂与仪器 Ham′s F12培养液(英国Biochrom公司);胎牛血清(FBS)、小鼠抗人角蛋白AE1/AE3、小鼠抗人S-100抗体(武汉博士徳生物工程有限公司);L-谷氨酰胺、胰蛋白酶(上海实生生物技术有限公司);NaCl溶液(上海国药集团化学试剂有限公司);0.0625 g/L青霉素、100 g/L链霉素(石家庄华北制药有限公司);CO2细胞培养箱(日本SANYO公司);培养皿(美国Corning公司);二甲基亚砜(DMSO)、四氮唑化合物(MTT)(美国Sigma公司);倒置相差显微镜(日本Nikon公司);激光共聚焦显微镜(德国Zeiss公司);Trizol(美国Invitrogen公司);Realplex2荧光定量PCR仪(德国Eppendorf公司);姜黄素(美国ALEXIS公司,纯度≥98.5%);羊抗小鼠的IgG(美国 Cell Signal Technology公司)。
1.2 细胞培养 原代人RPE细胞购自武汉原生原代公司,捐献者无已知的眼部疾病。人RPE细胞的传代培养参照以前的文献[17]。培养液采用Dulbecco改良的Ham′s F12培养基,含10%的胎牛血清,4 mM谷氨酸,100 U/ml青霉素和100 mg/ml链霉素;当细胞贴壁增殖后,在37 ℃,采用含有0.125%胰蛋白酶的乙二胺四乙酸(EDTA)的混合溶液消化5 min。细胞用Ham′s F12液洗涤并以4×104个/ml密度接种培养。原代培养达到融合后,细胞用含胰蛋白酶的EDTA溶液消化,计数,稀释1∶2或1∶4后,再次接种做再次培养。RPE细胞通常每周传代,在37 ℃,体积分数为5%的CO2培养箱中培养。日常于倒置显微镜下观察RPE的生长状态,并照相。取接种于6孔板半融合状态的第二代细胞做鉴定。经4%多聚甲醛固定20 min,做角蛋白和S-100的免疫荧光鉴定。一抗为小鼠抗人角蛋白AE1/AE3、对应使用的二抗为FITC(绿色荧光)标记的羊抗小鼠的IgG;还有小鼠抗人S-100的一抗、对应使用的二抗为TRITC(红色荧光)标记的羊抗小鼠的IgG。第2代至第4代的传代细胞用于实验。
1.3 MTT比色法检测不同浓度的姜黄素作用下对RPE细胞增殖的抑制作用 选取对数生长期的RPE细胞以1×105个/孔密度接种于96孔板内,培养12 h后弃去培养液,加入含有不同浓度姜黄素的细胞培养液100 μl。浓度分组为:空白对照组、0.9375、1.8750、3.7500、7.5000、15.0000 mg/L姜黄素组。每组设12个复孔。分别培养48 h后,离心5 min,每孔加20 μl MTT(5 mg/ml),37 ℃温箱中孵育4 h,倒置显微镜下可见活细胞内生成大量颗粒、针状formazan结晶。弃去培养液,每孔加入10%DMSO 150 μl,置摇床上低速震荡10 min,观察到formazan结晶完全溶解后,用酶标仪检测490 nm处各孔吸光度〔A,旧称光密度(OD)〕值,以仅加有100 μl DMSO的同板孔做空白对照。细胞增生抑制率=(1-实验组A值/对照组A值)×100%,实验共重复3次。
1.4 LSCM观察不同浓度的姜黄素作用下对RPE细胞内早期钙离子的变化 取传至第4代呈对数生长的RPE细胞以1×105个/ml密度接种于35 mm玻底培养皿(载玻片的厚度为20 mm),培养至亚融合状态,用D-hanks′液洗2次后用含终浓度为5 μmol/L fluo-3AM的D-hanks′液在37 ℃、5%CO2培养箱中负载30 min,荧光染色后,每只培养皿再用D-hanks′液洗去未负载的探针,姜黄素分别以0.9375、1.8750、3.7500、7.5000、15.0000 mg/L浓度干预人RPE细胞,立即上机检测,观察RPE细胞内荧光强度和细胞内游离Ca2+浓度变化。荧光显微镜采集荧光图像(各参数均调为手动,设置统一曝光值、光圈大小、对比度、白平衡)用于定量RPE细胞内钙离子的荧光强度。用Photoshop cs 5软件打开待分析图像,针对阳性信号区域进行手动框取,记录灰度值。
1.5 实时定量(Real-Time)PCR测定整合素基因的表达 取传至第6代呈对数生长的RPE细胞以1×106个/ml密度接种于培养瓶内,培养至亚融合状态,加3.75 mg/L姜黄素干预组为实验组,不加药组为空白对照组,分别孵育48 h后收集。采用Trizol一步法提取总RNA;DNaseⅠ消化RNA样品,去除其中可能含有的基因组DNA,无RNA酶的水将经过DNaseⅠ消化的RNA样品纯化稀释后,进行RNA质量检测,采用紫外吸收分光光度计测定260、280 nm处吸光度值,以A260/A280比值评价其纯度并推算RNA浓度,比值范围1.8~2.1;变性琼脂糖凝胶电泳法测定RNA的完整性;冰上操作反转录合成cDNA;冰上配制荧光定量RT-PCR反应混合液(2× SuperArray PCR master mix 550 μl,已稀释的cDNA 102 μl,ddH2O 448 μl),上PCR仪进行聚合酶激活/变性95 ℃,10 min,扩增40个循环95 ℃,15 s,60 ℃,1 min,收集荧光。每组的每个基因重复检测3次。经内参照β-肌动蛋白(β-actin)基因均一化处理后,采用2-ΔΔCt法计算目的基因相对表达量。
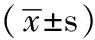
2 结果
2.1 RPE细胞培养及鉴定 原代培养的细胞经过2 d适应期后,在镜下可见到活性的RPE细胞贴壁,开始伸出伪足,呈扁平不规则多角形,胞浆内富含黑色素颗粒,可见清晰透明的圆形单核或双核细胞。细胞贴壁后便开始分裂繁殖,呈镶嵌式排列,5~7 d后细胞基本融合成单层。RPE细胞表达S-100抗原和角蛋白AE1/AE3,葡萄膜的色素细胞只表达S-100抗原但不表达角蛋白,而成纤维细胞两者都不表达[18],以此可以鉴别。
2.2 不同浓度姜黄素对RPE细胞增殖的抑制作用 空白对照组和0.9375、1.8750、3.7500、7.5000、15.0000 mg/L各个浓度的姜黄素组作用于RPE细胞48 h后,MTT法测得的姜黄素对RPE细胞的抑制率分别为〔0、(-0.07±0.10)、(-0.03±0.06)、(0.78±0.02)、(0.80±0.10)、(0.83±0.06)〕(F=10556.53,P<0.05)。0.9375和1.8750 mg/L组与空白对照组相比,差异无统计学意义(F=1.045,1.028;P>0.05)。而3.75、7.5和15 mg/L姜黄素组与空白对照组相比,对RPE细胞增殖的均有抑制作用(q=21.899,24.086,27.102;P<0.05)。与空白对照组相比,MTT法分析姜黄素作用RPE细胞48 h的IC50为4.436 mg/L(见图1A~1F)。
2.3 LSCM测得姜黄素干预早期RPE细胞内钙离子荧光强度变化 采用Photoshop cs 5软件分析空白对照组和0.9375、1.8750、3.7500、7.5000、15.0000 mg/L各个浓度的姜黄素组作用于RPE细胞后,早期细胞内钙离子荧光表达量的变化。空白对照组,0.9375、1.8750、3.7500、7.5000、15.0000 mg/L姜黄素组中钙离子荧光强度的表达经统计学分析后显示,RPE细胞经不同浓度姜黄素干预后早期,钙离子的荧光强度与姜黄素干预的浓度呈正相关(r=0.922,P<0.05,见图2A-2F,图3)。
2.4 实时定量PCR测得整合素基因的表达 实时定量PCR反应检测的目的基因分别为整合素α1、整合素α2、整合素α3、整合素α4、整合素α5、整合素α6、整合素α7、整合素α8、整合素αL、整合素αM、整合素υ、整合素β1、整合素β2、整合素β3、整合素β4和整合素β5共16个基因,与空白对照组比较,有统计学差异的整合素α3、整合素α4、整合素α5和整合素β5,P值分别为0.0165、0.0062、0.0226和0.004 (t值分别为-2.164、-3.135、-1.056、-4.296),较对照组基因表达量呈正效应的是整合素α4和整合素β5,负效应的是整合素α3和整合素α5。

图3 不同浓度姜黄素刺激RPE细胞后,早期Ca2+的荧光灰度值与姜黄素的浓度呈正相关(0=空白对照组;1=0.9375 mg/L姜黄素组;2=1.8750 mg/L姜黄素组;3=3.7500 mg/L姜黄素组;4=7.5000 mg/L姜黄素组;5=15.0000 mg/L姜黄素组)
Figure3 After treatment of various concentration curcumin groups,there were positive relationship and dose-dependent between the fluorescence frequency of calcium ion and the different concentration curcumin groups(0,1,2,3,4 and 5 represented respectively=blank control group,0.9375,1.8750,3.7500,7.5000,15.0000 mg/L curcumin groups)

图1A~1F 依次为空白对照组48 h RPE细胞,0.9375、1.8750、3.7500、7.5000、15.0000 mg/L姜黄素作用RPE细胞48 h倒置显微镜照片
Figure1A~1FIn turn:the blank control group 48 h RPE cell,0.9375,1.8750,3.7500,7.5000,15.000 mg/L the effect of curcumin on RPE cells of 48 h inverted microscope photos

图2A~2F 依次为空白对照组负载钙离子探针的RPE细胞,0.9375、1.8750、3.7500、7.5000、15.0000 mg/L姜黄素作用负载钙离子探针的RPE细胞荧光显微镜照片
Figure2A~2FIn turn:blank control group load of calcium ion probe RPE cells,0.9375,1.8750,3.7500,7.5000,15.000 mg/L the effect of curcumin on load of calcium ion probe RPE cell fluorescence microscope
3 讨论
Ca2+作为胞内重要的第二信使,是生存与死亡的信号,几乎所有的生理活动都受到Ca2+的调控。在静息状态下,一般细胞外Ca2+浓度为1.8 mmol/L,胞内游离钙离子浓度〔(Ca2+)i〕维持很低的水平,仅为0.1 μmol/L,而当细胞受到外界信号刺激时,(Ca2+)i能迅速增加100倍以上,以介导各种生物学效应。但若胞内(Ca2+)i持续过高,则对细胞有毒性作用[19]。有研究表明,钙与细胞凋亡关系密切,主要表现为细胞内钙超载可以诱发凋亡,而阻止细胞内钙离子浓度升高可以抑制凋亡。这一现象最早在胸腺细胞中被揭示,随后在淋巴细胞、骨髓细胞、心肌细胞及神经细胞中也得到证实[20-21]。McConkey[22-24]认为胞浆Ca2+升高通过两条途径诱导细胞凋亡,一是胞外Ca2+内流促使胞浆Ca2+持续升高,作为凋亡信号启动细胞凋亡;二是Ca2+的释放打破了细胞内结构的稳定,使得细胞凋亡效应系统的关键成分与其细胞外基质异常的交互作用,从而触发细胞凋亡。目前,对细胞内钙超载通过激活下游钙依赖的凋亡相关激酶(如钙蛋白酶、钙调磷酸酶及核酸内切酶-1)诱发凋亡和通过改变线粒体膜的通透性来实现的机制已经有了较明确的阐述。但是对于细胞外基质的机制近年来越来越受到关注。整合素家族是介导细胞与细胞外基质以及细胞间黏附的重要黏附分子家族,它们能诱导细胞的活化、增殖、运动和凋亡,在免疫调节、肿瘤浸润、损伤修复中等过程中发挥重要作用。大量的实验表明当整合素与细胞外基质结合后,可激活多条细胞内的信号转导途径。其中包括:启动细胞内Ca2+的转移,使细胞内Ca2+浓度增高。已证明整合素所致的Ca2+转移为白细胞的迁移所必需,整合素的活性也受来自细胞内信号的调节。整合素胞外部分是纤维连接蛋白(FN)、玻璃黏连蛋白(VN)、层黏连蛋白(LN)、骨桥蛋白(OPN)、纤维蛋白原(Fibrinogen)、胶原蛋白(collagen)等细胞外基质受体,参与增殖、分化、生存、凋亡、形态维持和动力等相关的细胞信号;整合素细胞内结构通过和细胞骨架连接蛋白,如:激动蛋白(α-actin)、细丝蛋白(filamin)、踝蛋白(talin)、张力蛋白(tensin)、桩蛋白(paxillin)、纽蛋白(vinculin);信号激活蛋白,如:Ser/Thr蛋白激酶、整合素连接激酶(ILK),非受体酪氨酸激酶;黏着斑激酶(FAK)、Syk,Ca2+离子结合蛋白(calreticulin)等信号通路蛋白相互作用,形成蛋白复合体黏附点结构。细胞外刺激、细胞内结构和功能变化通过整合素有机整合,构成信息由内向外和由外向内双向传递的渠道[25-26]。
MTT法分析姜黄素作用RPE细胞48 h的IC50为4.436 mg/L。形态学上显示3.7500 mg/L浓度以上的姜黄素作用RPE细胞48 h后,对RPE细胞的抑制作用明显。LSCM观察到0.9375、1.8750、3.7500、7.5000、15.0000 mg/L姜黄素作用RPE细胞后,早期均可呈现细胞内钙离子的荧光增强,且与浓度呈正相关。实时定量PCR反应检测了3.7500 mg/L姜黄素作用RPE细胞48 h后的整合素家族的基因表达,整合素α3和整合素α5基因的表达呈负调节,呈正调节的是整合素α4和整合素β5。
整合素α3形成的配体α3β1能与层黏连蛋白、Ⅰ型胶原、纤维连接蛋白结合,有抑制细胞迁移的作用。整合素α5形成的配体α5β1只能与纤维连接蛋白结合,但在细胞黏附中起到重要作用。整合素α4形成的配体可能与纤维连接蛋白结合,整合素β5是玻璃体连接蛋白受体,这两种整合素的具体作用尚未阐明[27-29]。姜黄素作用后的RPE细胞中,整合素α3和整合素α5基因的表达量显著下调,可能会减弱RPE细胞与其细胞外基质的黏附。
在各种生理反应中都离不开细胞与细胞间的信息传递和相互作用。这些细胞间相互作用和通讯的一种方式是通过由特异性的细胞黏附分子介导的细胞与细胞之间的直接接触和作用。在正常细胞中,黏附分子的表达及活性都受到严格的调控。细胞黏附分子决定细胞游走和定位时细胞间的相互识别;促进细胞的增殖和分化:已知多种类型的正常细胞的生长具有停泊依赖性,当这种黏附被阻断时,细胞便停止生长,甚至发生凋亡。体外培养的实验也显示,传代后贴壁生长的细胞必须贴壁后才能生长,表明由黏附分子介导的细胞黏附作用是细胞对生长刺激因子反应的必要条件。大多数体细胞需要黏附于细胞外基质方能生长,称为锚着依赖性细胞,在这类细胞中,整合素的角色格外重要,因为这些细胞十分依赖由细胞外基质所提供的生存讯号,所以当整合素的活性被抑制无法传递生存讯号给细胞时,就会引发细胞凋亡,称之为失巢效应(Anokis)[30]。同大多数体细胞一样,RPE细胞也是锚着依赖性细胞,它的存活同样需要依附于基质蛋白.在RPE细胞表面也分布着多种整合素受体。整合素通过与细胞外基质蛋白结合,对RPE细胞生长、增生、分化、迁移等活动产生重要影响[31-32]。此外,有学者Nishihara研究了胎鼠的肠上皮细胞,提出了胞内钙超载能阻止整合素受体极性分布的改变,而导致细胞凋亡[33-34]。
综上,姜黄素作为一种天然药物,作用于人RPE细胞后,早期引起细胞内钙离子浓度的增强,通过细胞内信号的传导,继而抑制整合素的活性,整合素α3和整合素α5基因的表达量显著下调,进而破坏细胞和细胞外基质的交互作用,减弱了RPE细胞与其细胞外基质的黏附;或者藉由抑制整合素的活性,影响了细胞运动,破坏细胞刚开始爬行所需的细胞极性的形成,细胞无法立即地决定其要往哪去,如此一来,RPE细胞便不能正常接受从细胞外基质所传来的生存讯号,整合素所参与相关的生存路径也因此被抑制,最后造成RPE细胞发生失巢凋亡。因此姜黄素有望成为一种有效抑制PVR的天然药物。
1 Asaria RH,Charteris DG.Proliferative vitreoretinopathy:developments in pathogenesis and treatment[J].Compr Ophthalmol Update,2006,7(4):179-185.
2 Esser P,Heimann K,Bartz-schmidt KU,et al.Apoptosis in proliferative vitreoretinal disorders:possible involvement of TGF-beta-induced RPE cell apoptosis[J].Exp Eye Res,1997,65(3):365-378.
3 Campochiaro PA.Pathogenic mechanisms in proliferative vitreoretinopathy[J].Arch Ophthalmol,1997,115(2):237-241.
4 毕庶德.姜黄素的研究进展以及在眼科中的应用[J].中国健康月刊,2010,3(1):31-35.
5 Kawamori Lubet R,Steele VE,et al.Chemopreventive effect of curcumin,a naturally occurring anti- inflammatory agent,during the promotion/progression stages of colon cancer[J].Cancer Res,1999,59(3):597.
6 Chen H,Zhang ZS,Zhang YL,et al.Curcumin inhibits cell proliferation by interfering with the cell cycle and inducing apoptosis in colon carcinoma cells[J].Anticancer Res,1999,19(5A):3675.
7 Goel A,Boland CR,Chauhan DE.Specific inhibition of cyclooxygenase-2(COX-2)expression by dietary cumumin in HT.29 human colon cancer cells[J].Cancer Lett,2001,172(2):111.
8 Onoda M,Inano H.Effect of curcumin on the production of nitric oxide by cultured rat mammary gland[J].Nitric Oxide,2000,4(5):505.
9 Chen HW,Yu SL,Chen JJ,et al.Anti-invasive gene expression profile of curcumin in lung adenocarcinoma based on a high throughput microarray analysis[J].Mol Pharmacol,2004,65(1):995.
10 Gukovsky I,Reyes CN,Vaquero EC,et al.Curcumin ameliorates ethanoland nonethanol experimental pancreatitis[J].Am J Physiol Gastrointest Liver Physiol,2003,284(1):85295.
11 Natarajan C.Bright JJ.Curcumin inhibits experimental allergic encephalo-myelitis by blocking IL-12 signaling through Janus kinase-STAT pathway in T lymphocytes[J].J Immunol,2002,168(12):6506-6513.
12 胡艳红,祁明信,黄秀榕.姜黄素对晶状体上皮细胞增殖的抑制作用[J].眼科研究,2006,24(2):122-124.
13 黄秀榕,祁明信,康可人.姜黄素诱导牛晶状体上皮细胞凋亡的机制[J].中华眼科杂志,2006,42(7):649-653.
14 Kang HC,Nan JX,Park PH,et al.Curcumin inhibits collagen synthesis and hepatic stellate cell activation in-vivo and in-vitro[J].J Pharm Pharmaco,2002,54(1):119226.
15 厉红元,车艺,汤为学.姜黄素对人肝癌增殖和凋亡的影响[J].中华肝脏病杂志,2002,10(6):449251.
16 安建斌,马景学,高彦军,等.姜黄素对兔视网膜色素上皮细胞的抑制作用[J].中华眼底病杂志,2009,25(1):38-42.
17 Hu DN,Steven A.Studies of human uveal melanocytes in vitro:isolation,purification and cultivation of human uveal melanocytes[J].Invest Ophthalmol Vis Sci,1993,34(7):2210-2219.
18 Chang YC,Kao YH,Hu DN,et al.All-trans retinoic acid remodels extracellular matrix and suppresses laminin-enhanced contractility of cultured human retinal pigment epithelial cells[J].Exp Eye Res,2009,88(5):900-909.
19 Niki I,Yokokura H,Sudo T,et al.Ca2+signaling and intracellular Ca2+binding proteins[J].J Biochem,1996,120(4):685-698.
20 Manion MK,Su Z,Villain M,et al.A new type of Ca2+channel blocker that targets Ca2+sensors and prevents Ca2+mediated apoptosis[J].FASEB J,2000,14(10):1297-1306.
21 Chen SJ,Bradley ME,Lee TC.Chemical hypoxia triggers apoptosis of cultured neonatal rat cardiac myocytes:modulation by calcium-regulated proteases and protein kinases[J].Mol Cell Biochem,1998,178(1-2):141-149.
22 McConkey DJ,Nutt LK.Calcium flux measurements in apoptosis[J].Methods Mol Biol,2001,66:229-246.
23 Szalai G,Krishnamurthy R,Hajnoczky G.Apoptosis driven by IP3-linked mitochondrial calcium signals[J].EMBO J,1999,18(22):6349-6354.
24 McConkey DJ.20S ways to apoptosis[J].Nat Chem Biol,2008,4(9):528-529.
25 Hynes RO.Integrins:bidirectional,allosteric signaling machines[J].Cell,2002,110(6):673-687.
26 Campbell S,Otis M,Cote M,et al.Connection between integrins and cell activation in rat adrenal glomerulosa cells:a role for Arg-Gly-Asp peptide in the activation of the p42/p44mapk pathway and intracellular calcium[J].Endocrinology,2002,144(4):1486-1495.
27 Zhao MW,Jin ML,He S,et al.A distinct integrin-mediated phagocytic pathway for extracellular matrix remodeling by RPE cells[J].Invest Ophthalmol Vis Sci,1999,40(11):2713-2723.
28 何世坤,赵明威,陈有信.视网膜色素上皮基础与临床[M].北京:科学出版社,2005:49-52.
29 Finnemann SC,Rodriguez-Boulan E.Macrophage and retinal pigment epithelium phagocytosis:apoptotic cells and photoreceptors compete for alphavbeta 3 and alphavbeta 5 integrins,and protein kinase C regulates alphavbeta 5 binding and cytoskeletal linkage[J].J Exp Med,1999,190(6):861-874.
30 Frisch SM,Francis H.Disruption of epithelial cell-matrix interactions induces apoptosis[J].J Cell Biol,1994,124(4):619-626.
31 Grossmann J,Walther K,Artinger M,et al.Apoptotic signaling during initiation of detachment induced apoptosis(Anoikis)of primary human intestinal epithelial cells[J].Cell Growth Differ,2001,12(3):147-155.
32 Frisch SM.Evidence for a function of death-receptor related death-domain contain proteins in anoikis[J].Curr Biol,1999,9(18):1047-1049.
33 Nishihara H,Kizaka-kondoh S,Insel PA,et al.Inhibition of apoptosis in normal and transformed intestinal epithelial cells by cAMP through induction of inhibitor of apoptosis protein fIAP-2[J].Proc Natf Acad Sci,2003,100(15):8921-8926.
34 Kumar CC.Signaling by integrin receptors[J].Oncogene,1998,17(11):1365-1373.
