氯化锂对肝癌细胞BEL-7402增殖、周期的影响及其作用机制
2013-04-18徐杰伟蒋桂星曹利平
徐杰伟 蒋桂星 曹利平
氯化锂对肝癌细胞BEL-7402增殖、周期的影响及其作用机制
徐杰伟 蒋桂星 曹利平
目的 探讨氯化锂对人肝癌细胞BEL-7402增殖、周期的影响及其作用机制。 方法 应用MTT法及DNA PREP细胞周期法检测BEL-7402经氯化锂作用后的增殖及周期改变情况,Western blot检测糖原合成激酶-3(GSK-3)、失活pGSK-3及其下游分子CyclinD1的表达情况。 结果 氯化锂可显著抑制BEL-7402的增殖,并呈时间、剂量依赖性(P<0.05);氯化锂可使BEL-7402的G0/G1期比例明显降低、G2/M期比例显著升高(P<0.05);氯化锂作用后GSK-3、失活pGSK-3及CyclinD1蛋白的表达水平均明显升高(P<0.05)。 结论 氯化锂可抑制肝癌细胞增殖,其机制可能是通过抑制GSK-3活性并上调CyclinD1表达使肝癌细胞阻滞于G2/M期。
肝癌 糖原合成激酶-3 氯化锂 CyclinD1
糖原合成激酶-3(glycogen synthase kinase-3,GSK-3)是普遍存在于真核细胞生物中的一种丝氨酸苏氨酸蛋白激酶,可参与多种细胞生理过程,包括细胞增殖、分化及存活[1]。近年的研究发现,GSK-3异常表达可致肿瘤的发生。氯化锂是GSK-3的高度选择性抑制剂,具有抑制肿瘤细胞增殖、影响癌基因表达及诱导凋亡的作用[2]。本研究旨在探讨氯化锂对肝癌细胞增殖、周期影响及其对GSK3、CyclinD1表达的影响。
1 材料和方法
1.1 材料 人肝细胞癌株BEL-7402由中国科学院典型培养物保藏委员会细胞库提供,氯化锂、四甲基偶氮唑蓝(MTT)购自Sigma公司;鼠抗人GSK-3α/β单克隆抗体(克隆号:sc-7291)、兔多抗磷酸化GSK-3(pGSK-3)βser9(克隆号:sc-11757)、pGSK-3αser21(克隆号:sc-16308)均购自Santa Cruz公司,兔抗人CyclinD1多克隆抗体(克隆号:2261-1)购自EPITMICS公司,βactin一抗为Santa Cruz公司产品。羊抗兔IgG-HRP标记二抗及羊抗鼠IgG-HRP标记二抗购自联科生物技术有限公司,ECL为美国Pierce公司产品,PVDF膜由Millipore公司生产。蛋白酶抑制剂购自Sigma公司,DNA PREP细胞周期检测试剂盒购自Beckman Coulter公司。
1.2 方法
1.2.1 细胞培养及细胞生长抑制率测定 BEL-7402细胞用含10%FBS(青霉素、链霉素100U/ml)的RPMI 1640培养液,置于37℃、5%CO2培养箱中培养。取对数生长期BEL-7402细胞,按5×103个/孔接种于96孔培养板,培养24h待细胞贴壁后加入浓度梯度(0、5、10、20、40、80mmol/L)PBS溶解的氯化锂,对照组加等量PBS,每个实验组做3个复孔。分别培养24、48、72h后每孔加入MTT溶液(5mg/ml)20μl,37℃继续培养2.5~4h,吸弃孔内培养上清液。每孔加入150μl DMSO,振荡10min。用酶联免疫检测仪测定490nm处吸光度(OD)值。每组取3次实验平均值,计算各组细胞生长抑制率。生长抑制率=(1-药物组OD值/对照组OD值)×100%。
1.2.2 细胞周期分析 取10、20nmol/L氯化锂分别处理BEL-7402细胞24h及48h,对照组加等量PBS,收获细胞按DNA PREP细胞周期检测试剂盒说明书进行操作,加50μl DNA PREP LPR打孔10min,加500μl DNA PREP Stain室温避光30min,上流式细胞分析仪检测DNA含量,应用Multicycle for Windows软件分析细胞周期分布。
1.2.3 Western blotting检测 取10、20mmol/L氯化锂处理BEL-7402细胞后48h收集细胞,加入细胞裂解液,提取细胞总蛋白,用BCA试剂盒检测蛋白质浓度,制备10%SDS-PAGE凝胶,每孔上样30μl,经电泳、转膜、封闭,依次加入β-actin、GSK-3α/β、pGSK-3βser9、pGSK-3αser21、CyclinD1抗体(1∶1 000)4℃过夜,洗膜后,二抗室温孵育1h,再洗膜后用适量ECL孵育3min,用 ImageQuant LAS4000mini机器自动显影,使用Quantity One软件分析条带像素值。蛋白相对表达量=各个蛋白的净像素值/actin的净像素值,实验重复3次。
1.3 统计学处理 采用SPSS16.0统计软件,所得数据以表示,组间比较采用单因素方差分析。
2 结果
2.1 氯化锂作用后BEL-7402细胞生长抑制率的变化 不同浓度的氯化锂对BEL-7402细胞增殖均有明显的抑制作用,随着药物浓度梯度升高,OD值明显降低,细胞生长抑制率明显增加,差异有统计学意义(P<0.05);且随着作用时间的延长,细胞生长抑制率也明显增加,各浓度氯化锂作用72h细胞生长抑制率均最大,差异有统计学意义(P<0.05),见图1。

图1 不同浓度、不同时间氯化锂作用于肝癌细胞后增殖变化
2.2 氯化锂作用于BEL-7402细胞后其细胞周期变化见图2。
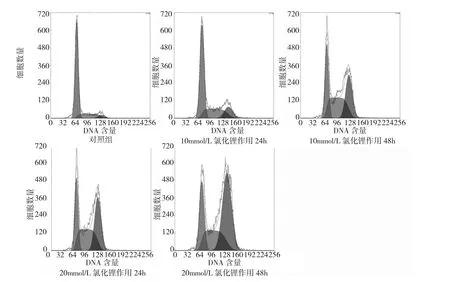
图2 不同浓度及不同时间氯化锂作用后BEL-7402细胞周期的变化
由图2可见,加入10、20mmol/L的氯化锂分别培养24、48h后,G0/G1期比例低于对照组,而G2/M期比例显著高于对照组(P<0.05)。
2.3 氯化锂作用后GSK-3、pGSK-3βser9、pGSK-3αser21、CyclinD1蛋白的表达情况 以β-actin为内参照,对照组、氯化锂10mmol/L及20mmol/L作用48h组总GSK-3蛋白相对表达量分别为:1.193±0.068、1.361± 0.081、1.822±0.059;pGSK-3βser9蛋白相对表达量分别为 1.011±0.057、1.354±0.089、1.828±0.078;pGSK-3αser21蛋白相对表达量分别为0.706±0.042、0.930±0.065、1.239±0.084;CyclinD1蛋白相对表达量分别为0.907± 0.014、1.389±0.036、2.644±0.044。与对照组比较,氯化锂10mmol/L及20mmol/L作用48h后使总GSK-3、失活GSK-3及CyclinD1均上调,差异有统计学意义(均P<0.05),见图3。

图3 氯化锂作用后相关蛋白表达情况
3 讨论
早期的研究发现,氯化锂可用于治疗痛风。1949年,澳大利亚学者Cade首先采用碳酸锂治疗精神性兴奋,证明它是预防或治疗躁狂或躁狂忧郁性躁狂期的有效药物[3]。此后大量研究表明,锂离子可有效抑制肿瘤细胞生长,如在前列腺癌细胞、胰腺癌细胞等癌细胞中,氯化锂能使细胞阻滞于G2/M期或通过诱导细胞凋亡进而抑制细胞生长[4-5]。进一步的研究发现,氯化锂主要通过影响GSK-3的活性调节肿瘤细胞生长。1996年,Klein等[6]首次报道了锂离子可选择性抑制GSK-3。研究表明,GSK-3在多种肿瘤的发生、发展过程中其重要调节作用,可见氯化锂发挥抑制肿瘤细胞生长的作用可能主要通过抑制GSK-3活性实现。
GSK-3是存在于真核细胞生物中的一种多功能丝/苏氨酸蛋白激酶,其在哺乳动物中有两种亚型,包括GSK-3α和GSK-3β,两者生物学功能相似。若GSK-3α第21位的丝氨酸和 GSK-3β第9位的丝氨酸被磷酸化,则GSK-3的活性下降。相反,GSK-3α第279位的酪氨酸和 GSK-3β第216位的酪氨酸被磷酸化,则GSK-3的活性增强[7]。GSK-3最初的生物学作用主要是作为糖代谢调节酶参与调节糖代谢的功能,近年来发现GSK-3异常激活与肿瘤发生、发展关系密切。活性GSK-3能促进卵巢癌细胞增殖,应用氯化锂抑制GSK-3活性后可抑制卵巢癌细胞增殖及存活[8];此外,抑制GSK-3β活性还可通过下调存活蛋白survivin的表达诱导白血病细胞凋亡,抑制白血病细胞生长[9]。这些研究提示GSK-3是多种肿瘤细胞增殖和生存的促进因子。
目前,GSK-3参与肿瘤发生、发展的具体机制尚不明确。由于参与调节的底物及信号通路众多,其调节肿瘤发生、发展的机制非常复杂。研究发现,GSK-3可通过相关信号蛋白、结构蛋白和转录因子等影响肿瘤恶性转化及发展。如GSK-3是转录因子NF-κB活化的关键激酶[10]。NF-κB的异常激活可通过上调抗凋亡基因Bcl-2、IAP等的表达促进细胞增殖、抑制凋亡。此外,GSK-3还可调节与细胞增殖密切相关的CyclinD1蛋白及转录因子β-catenin等。因此,作为GSK-3的特异性抑制剂,氯化锂可作为一种非常有用的研究工具用于对GSK-3β广泛的生物学功能研究。
本研究结果显示,氯化锂可显著抑制肝癌细胞增殖,并呈剂量及时间依赖性,氯化锂作用后可使肝癌细胞被阻滞在G2/M期;另外还发现,氯化锂作用后总GSK-3、失活GSK-3(pGSK-3βser9、pGSK-3αser21)及Cyclin D1表达显著上调。笔者推测氯化锂可能通过抑制GSK-3活性进而上调Cyclin D1的表达使肝癌细胞生长受到抑制。而既往研究表明,Cyclin D1是细胞周期的正向调控蛋白,在细胞周期关键限速点G1-S转换中起重要作用,它能够促使细胞由G1期进入S期,加速细胞增殖。但本文结果显示,氯化锂作用后肝癌细胞周期停滞于G2/M期,因此笔者认为,氯化锂抑制GSK-3活性后,虽然上调Cyclin D1的表达,促进肝癌细胞从G1期进入S期,但之后可能使更多的癌细胞阻滞于G2/M期,因此G0/G1期比例显著下降,而G2/M比例升高。但GSK-3如何使肝癌细胞进一步阻滞于G2/M期的具体机制仍需更深入的研究。
[1] Grimes C A,Jope R S.The multifaceted roles of glycogen synthase kinase 3beta in cellular signaling[J].Neurobiol,2001,65: 391-426.
[2] Zhang F,Phiel C J,Spece L,et al.Inhibitory phosphorylation ofglycogen synthase kinase-3(GSK-3)in response to lithium.Evidence for autoregulation of GSK-3[J].J BiolChem,2003,278(35): 33067-33077.
[3] CADE J F.Lithium salts in the treatment ofpsychotic excitement[J]. Practitioner,1949,163(976):337-344.
[4] Liao X,Zhang L,Thrasher J B,et al.Glycogen synthase kinase-3beta suppression eliminates tumor necrosis factor-related apoptosis-inducing ligand resistance in prostate cancer[J].Mol Cancer Ther,2003,2:1215-1222.
[5] Mamaghani S,Patel S,Hedley D W.Glycogen synthase kinase-3 inhibition disrupts nuclear factor-kappaB activity in pancreatic cancer,but fails to sensitize to gemcitabine chemotherapy[J]. BMC Cancer,2009,30(9):132.
[6] Klein P S,Melton D A.Amolecular mechanism for the effect of lithium on development[J].Proc Natl Acad Sci USA,1996,93(16): 8455-8459.
[7] Jope R S,Johnson G V.The glamour and gloom of glycogen synthase kinase-3[J].Trends Biochem Sci,2004,29:95-102.
[8] Cao Q,Feng YJ.Glycogen synthase kinase-3beta(GSK-3beta) promotes proliferation of ovarian cancer cells in vitro[J].Zhonghua Zhong Liu Za Zhi,2006,28:804-809.
[9] Holmes T,O'Brien T A,Knight R,et al.Glycogen synthase kinase-3beta inhibition preserves hematopoietic stemcell activity and inhibits leukemic cell growth [J].Stem Cells,2008,26: 1288-1297.
[10] Hoeflich K P,Luo J,Rubie E A,et al.Requirement for glycogen synthase kinase-3beta in cell survival and NF-kappaB activation[J].Nature,2000,406:86-90.
Effect of lithium chloride on proliferation and cell cycle of human hepatoma cells
XU Jiewei,JIANG Guixing,CAO Liping.
Department of Surgery,the Second Affiliated Hospital,Zhejiang University School of Medicine,Hangzhou 310009,China
Objective To investigate the effect of lithium chloride (LiCl)on cell proliferation,cell cycle of human hepatoma cells and its mechanism. Methods Cultured human hepatoma BEL-7402 cells were treated with different concentrations of LiCl. Cell proliferation was measured by MTT assay and cell cycle was examined by DNA PREP cell cycle assay.The expressions of GSK-3,inactivated GSK-3 and CyclinD1 were determined by Western blot. Results LiCl inhibited BEL-7402 cell proliferation in a concentration-and time-dependent manner.After LiCl treatment the percentage of G0/G1 phase was significantly reduced,the G2/M phase was significantly increased,and the expression levels of GSK-3,inactivated GSK-3 and CyclinD1 were up-regulated. Conclusion LiCl can inhibit the proliferation of BEL-7402 cells,in which inactivation of GSK-3 and up-regulation of CyclinD1 may be involved leading to cell cycle arrest in G2/M phase.
Liver cancer Glycogen synthase kinase 3 Lithium chloride CyclinD1
2013-01-14)
(本文编辑:欧阳卿)
310009 杭州,浙江大学医学院附属第二医院肝胆外科
曹利平,E-mail:cao@zju.edu.cn
