西洋参茎叶总皂苷减轻大鼠心肌细胞缺氧/复氧损伤机制的研究*
2013-04-13王晓礽宋丹丹刘秀华史大卓
王 琛, 刘 蜜, 王晓礽, 宋丹丹, 刘秀华△, 史大卓△
(解放军总医院 1中医科, 3病理生理研究室, 北京 100853; 2中国中医科学院西苑医院,北京100091)
西洋参茎叶总皂苷(Panaxquinquefoliumsaponins, PQS) 是西洋参茎叶中主要的活性成分。以往实验研究表明,PQS具有减轻缺血/再灌注(ische-mia/reperfusion, I/R)诱导的心肌细胞凋亡、心律失常和改善梗死后心室重构等作用[1-3],其机制可能与增强抗氧化酶活性、维持细胞内Ca2+稳态等有关[4]。
研究表明钙超载是I/R发生的关键环节,钙调神经磷酸酶(calcineurin,CaN)是唯一依赖于Ca2+及钙调素(calmodulin,CaM)调控的蛋白丝氨酸/苏氨酸磷酸酶,参与多种细胞功能的调节[5]。PQS又具有维持细胞内钙稳态的作用[4]。我们研究证实PQS可以减轻离体培养乳鼠心肌细胞缺氧/复氧损伤[6-7]。那么,PQS减轻心肌细胞H/R损伤的机制是否与CaN有关尚缺少研究,本部分工作利用乳鼠心肌细胞缺氧/复氧 (hypoxia/reoxygenation, H/R) 模型通过转染pCDB-CaN质粒或CaN特异性抑制剂FK506干扰CaN表达,以探讨PQS减轻心肌细胞H/R损伤的机制。
材 料 和 方 法
1动物与试剂
清洁级24 h内新生SD乳鼠,购自北京市军事医学科学院实验动物中心;PQS粉剂由吉林省集安益盛药业股份有限公司提供;细胞CaN活性比色法定量检测试剂盒购自GenMed;低糖DMEM干粉、购自Gibco;新生牛血清(new-born calf serum, NCS)购自PAA;胰蛋白酶购自Amresco;蛋白酶抑制剂(protease inhibitor cocktail)、苯甲基磺酰氟(phenylmethyl sulfonylfluoride,PMSF)、四甲基乙二胺(tetramethyl ethylene diamine,TEMED)、Tris碱、Tris-HCl、十二烷基硫酸钠(sodium dodecyl sulphate,SDS)、考马斯亮蓝G250、过硫酸铵、甘氨酸、亮肽酶素和Triton X-100购自Sigma;牛血清白蛋白(bovine serum albumin, BSA)、β-巯基乙醇购自Merck;蛋白电泳分子量(7~175 kD)为Bio-Rad产品;兔抗人GAPDH单克隆抗体、兔抗人Bax、 Bcl-2和CaN多克隆抗体购自Cell Signal;辣根过氧化酶标记山羊抗兔IgG购自Santa Cruz;增强化学发光(enhanced chemiluminescence, ECL)试剂盒购自Millipore;脂质体Lipofectamine 2000及Opti-MEM购自Invitrogen;pCDB-CaN质粒由北京大学人类疾病基因研究中心构建;CaN抑制剂FK506购自Sigma。
2乳鼠心肌细胞培养
参照Simpson等[8]法加以改进,无菌操作取出生后24 h内SD新生乳鼠心尖部组织,剪碎成1 mm×1 mm×1 mm大小,加入适量0.15% 胰蛋白酶,37℃水浴下轻柔搅动、反复消化,制备心肌细胞悬液,差速贴壁。用含15% 新生牛血清的DMEM 培养液,调整细胞浓度为每瓶3×106个细胞,接种于底面积为75 cm2的培养瓶,置CO2孵箱进行原代培养。
3实验分组
取原代培养心肌细胞,置于CO2孵箱常规培养24 h,换无新生牛血清的DMEM培养液同步化24 h后,随机分组如下(进行4次原代培养,分别接种,n=4):(1)正常对照(control)组:细胞置CO2孵箱37℃,常规培养至实验结束;(2)H/R组:按本室报道的方法[3]将细胞置于缺氧仓内,通入95% N2-5% CO2混合气4 h,更换37 ℃ 95%空气-5%CO2预平衡的10% NCS DMEM,37 ℃、5% CO2孵箱常氧继续培养12 h结束实验;(3)药物预处理(PQS+H/R)组:以PBS缓冲液稀释PQS原粉,配成浓度为160 g/L的储存液,过滤除菌,4 ℃保存,应用时将储存液1 000倍稀释加入心肌细胞培养液中,培养24 h,进行H/R操作;(4)CaN过表达+药物预处理(CaN+PQS+H/R)组:pCDB-CaN质粒转染6 h后,按照(3)组程序操作;(5)空载pCDB质粒+药物预处理 (pCDB+ PQS+H/R)组:空载pCDB质粒转染6 h后,按照(3)组程序进行操作;(6)CaN抑制剂+药物预处理 (FK506+PQS+H/R)组:培养基中加入FK506 (5 mg/L),37 ℃预孵育10 min 后,按照(4)组操作。
4CaN过表达
以转染试剂Lipofectamin 2000转染pCDB-CaN质粒至乳大鼠心肌细胞,转染方法如下:(1)转染前1 d以104/cm2的密度接种,传代培养心肌细胞;(2)转染1 h前将细胞培养液换为Opti-MEM;(3)分别配制DNA-Mix和Lipo-Mix:将质粒或Lipofectamine 2000加入Opti-MEM,小心混合后于室温下静置6 min,而后将DNA-Mix与Lipo-Mix均匀混合,室温下静置20 min后小心滴加入细胞;(4)细胞继续培养5~6 h后换为正常的DMEM完全培养液继续培养至实验结束。
5心肌细胞凋亡率测定
实验结束时,收集各组细胞培养液,用0.25%胰蛋白酶+0.02% EDTA消化液制备单细胞悬液,按照测试盒方法分别加入染料Annexin V和propidium iodide (PI),室温下孵育5~15 min,以流式细胞仪 (BD FACSCalibur, Becton-Dickinson) 检测细胞凋亡情况。
6心肌细胞CaN活性检测
细胞以每瓶3×105个细胞的浓度接种于25 cm2规格培养瓶,胰酶消化法收集细胞并加入3 mL预冷的GENMED清理液(Reagent A),混匀细胞, 3 000×g4 ℃ 离心5 min,弃上清,加入500 μL GENMED裂解液(Reagent B),充分混匀,转移至预冷的1.5 mL EP管中,强力涡旋振荡15 s后置于冰槽里孵育30 min,13 000 r/min 4 ℃ 离心5 min,收集上清液,移取10 μL进行蛋白定量,余样本即可放进-80 ℃冰箱保存或置于冰槽里参照试剂盒操作说明进行CaN活性测定。
7Westernblotting分析
按本室报道方法[9]提取心肌细胞总蛋白,Bradford法蛋白定量后分装,-80 ℃保存。取上述细胞蛋白提取液上清 (含蛋白80 μg) 进行聚丙烯酰胺凝胶电泳 (SDS-PAGE,12%分离胶),将电泳分离后的蛋白质电转移至硝酸纤维素膜上,用5%BSA封闭40 min后分别加入Bcl-2、Bax、CaN多克隆抗体(均为1∶500) 4 ℃过夜孵育,用1×TBS-T洗膜后,以相应的II抗孵育1.5 h,并以GAPDH (1∶500) 单克隆抗体重复上述实验过程,作为上样对照。化学发光ECL显示,采用Image-Pro Plus软件分析蛋白条带的积分吸光度值 (integratedAvalue,IA, 平均吸光度值×面积),以靶蛋白/GAPDHIA比值反映靶蛋白水平。
8统计学处理
采用SAS 8.2统计软件分析,数据用均数±标准差(mean±SD) 表示,采用单因素方差分析 (One-way ANOVA) 进行多组间比较,采用q检验进行多组间两两比较,两变量相关性采用Pearson相关分析,以P<0.05为差异有统计学意义。
结 果
1CaN表达对PQS心肌细胞保护作用的影响
1.1心肌细胞凋亡率正常对照组细胞生长状态良好,凋亡率为2.0%;CaN过表达组心肌细胞凋亡率为6.6% (P<0.05);以160 mg/L浓度的PQS预先培养24 h,细胞凋亡率为3.1%,与PQS+H/R组比较,CaN过表达组细胞凋亡率升高3.5% (P<0.05);FK506对于PQS改善H/R后心肌细胞凋亡率无明显影响,与PQS+H/R组相比差异无统计学意义(P>0.05)。见图1。

Figure 1. Flow cytometry analysis of the effect of CaN on cardiomyocyte apoptosis. Mean±SD.n=4.*P<0.05vscontrol;#P<0.05vsH/R;&P<0.05vsPQS+H/R.
图1流式细胞术分析CaN对心肌细胞凋亡的影响
1.2凋亡相关因子蛋白表达采用Western blotting检测凋亡蛋白Bcl-2和Bax的表达变化,结果显示:转染CaN质粒后,与PQS+H/R组相比,Bcl-2蛋白表达降低50.0%,而Bax蛋白表达为PQS+H/R组的2.0倍 (P<0.05);FK506对于PQS改善H/R后心肌细胞凋亡相关因子蛋白表达无明显影响,Bcl-2和Bax蛋白表达与PQS+H/R组比较无显著差异(P>0.05),见图2。
2PQS对心肌细胞CaN活性及蛋白表达的影响
2.1心肌细胞CaN活性测定采用比色法测定CaN活性,结果显示,H/R诱导CaN活性明显增加,为对照组的10.0倍 (P<0.05)。PQS明显抑制H/R引起的CaN活性升高,较H/R 组降低70.6%(P<0.05);转染CaN质粒后,与PQS+H/R组比较,CaN活性升高3.0倍 (P<0.05);FK506对于PQS改善H/R后心肌细胞CaN活性无明显影响,与PQS+H/R组比较无显著差异 (P>0.05),见图3。
2.2心肌细胞CaN蛋白表达采用Western blotting检测CaN蛋白表达变化,结果显示, H/R诱导CaN蛋白表达明显升高,为对照组的3.0倍 (P<0.05)。
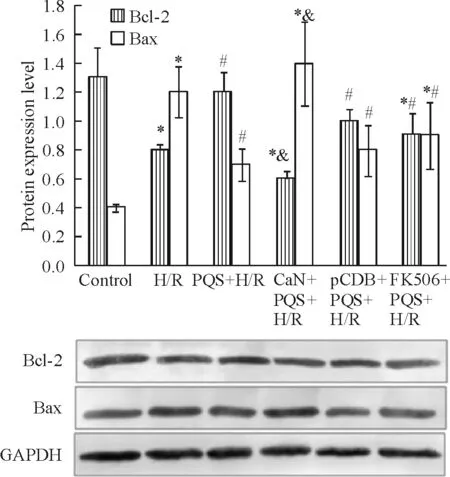
Figure 2. Effects of calcineurin on the expression of Bcl-2 and Bax in H/R-treated cardiomyocytes.Mean±SD.n=4.*P<0.05vscontrol;#P<0.05vsH/R;&P<0.05vsPQS+H/R.
图2CaN对心肌细胞Bcl-2和Bax蛋白表达的影响
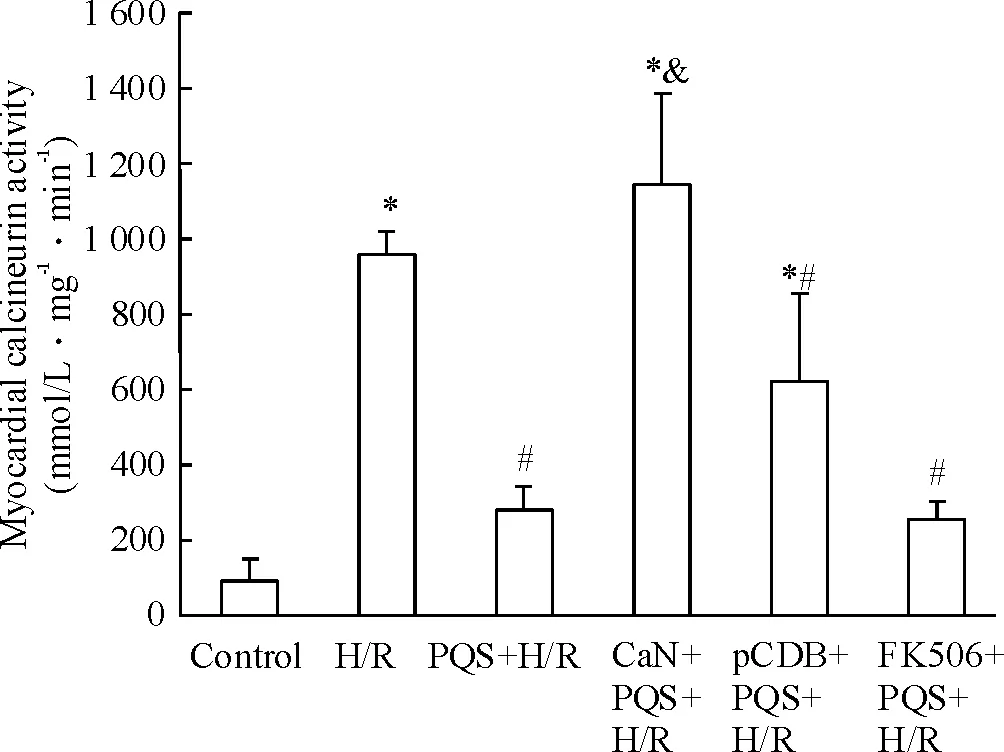
Figure 3. Effect of PQS on CaN activity in cardiomyocytes. Mean±SD.n=4.*P<0.05vscontrol;#P<0.05vsH/R;&P<0.05vsPQS+H/R.
图3PQS对心肌细胞CaN活性的影响
PQS明显抑制H/R引起的CaN蛋白表达升高,较H/R 组降低60.9% (P<0.05);转染CaN质粒后,与PQS+H/R组比较,CaN蛋白表达升高2.3倍(P<0.05);FK506对于PQS改善H/R后心肌细胞CaN蛋白表达无明显影响,与PQS+H/R组比较无显著差异(P>0.05),见图4。
讨 论
近年来随着临床冠脉内溶栓术、经皮冠脉腔内血管成形术及冠脉搭桥术等治疗方法的广泛应用,心肌再灌注损伤愈来愈引起人们的重视。I/R损伤指缺血一定时间的心肌恢复灌流后,组织损伤反而进行性加重,心肌细胞从可逆损伤转变为不可逆损伤的现象。I/R发生的主要环节是氧自由基产生和钙超载,其机制尚未完全阐明,CaN是唯一依赖于Ca2+调控的蛋白丝氨酸/苏氨酸磷酸酶。CaN在细胞增殖、分化、凋亡及其它病理过程中起着重要作用,参与心肌肥大、心肌凋亡、血管平滑肌细胞增殖等过程的调节。心肌细胞坏死和凋亡是心肌I/R损伤的特征之一[10]。Musat-Marcu等[11]在离体灌流大鼠心脏上发现,再灌注早期即可发生心肌细胞凋亡。其中抗凋亡基因bcl-2与促凋亡基因bax参与了心肌I/R损伤中细胞凋亡的调控[12]。研究证明I/R时胞浆内Ca2+浓度升高,引起CaN活化,通过Bad(Bcl-2家族促凋亡因子)去磷酸化拮抗Bcl-2的抗凋亡功能,促进细胞凋亡[13]。Bueno等[14]发现CaNAβ基因打靶小鼠易致急性缺血诱发的心肌凋亡,从而推测CaN信号途径可介导心肌细胞凋亡;Singh等[15]发现I/R时,肾素-血管紧张素系统被激活,释放大量儿茶酚胺,可通过β1受体介导细胞凋亡;李文霞等[16]发现CaN过表达可以增加I/R损伤心肌细胞凋亡率。Ikeda等[17]与Nathan等[18]研究证实,心肌与脑I/R损伤均可导致CaN活性增强,促进细胞凋亡,导致心肌损伤,以CaN抑制剂CsA抑制其活性及表达可对I/R产生保护作用。
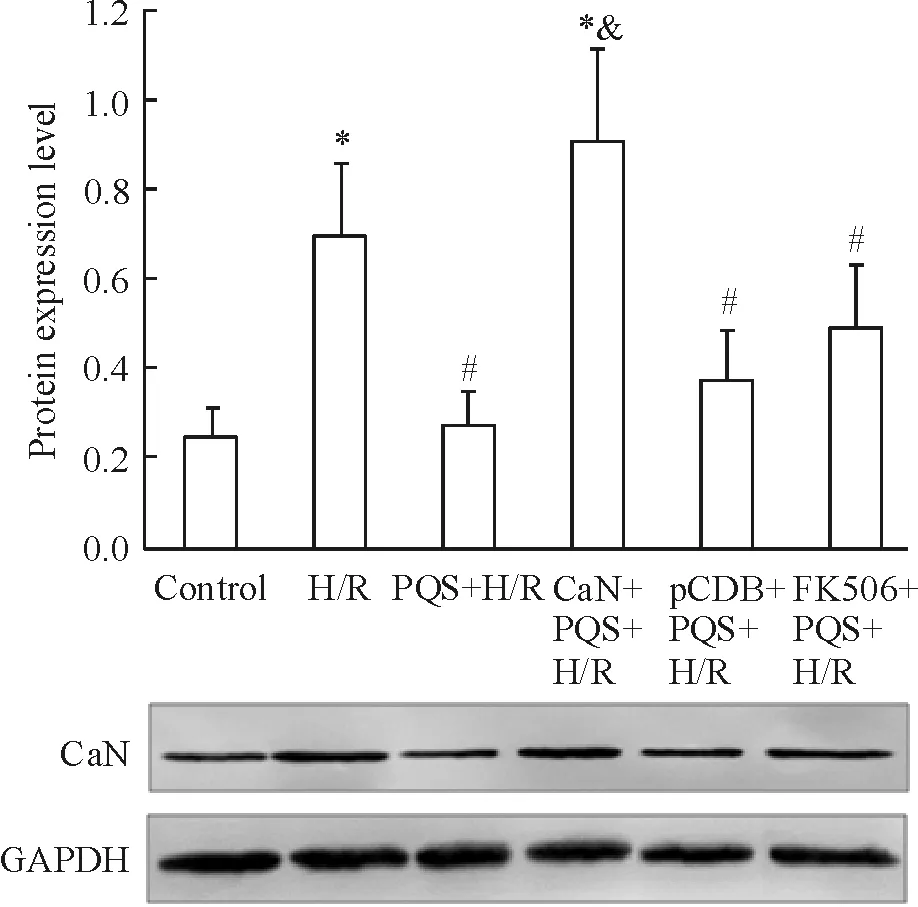
Figure 4. Effect of PQS on CaN protein expression in cardiomyocytes. Mean±SD.n=4.*P<0.05vscontrol;#P<0.05vsH/R;&P<0.05vsPQS+H/R.
图4PQS对心肌细胞CaN蛋白表达的影响
本研究利用乳鼠心肌细胞H/R模型,采用流式细胞术以及Western blotting方法,证实外源性CaN过表达后能明显增加心肌细胞凋亡率,升高促凋亡蛋白Bax表达及降低抗凋亡蛋白Bcl-2表达,提示CaN具有促心肌细胞凋亡作用,与文献报道一致[19-20],课题组前期实验证实PQS能明显减轻H/R诱导的心肌细胞损伤和凋亡,本研究表明联合给予CaN抑制剂组与单纯PQS预处理组一样均能降低心肌细胞凋亡率,但2组相比无明显差异,提示CaN活性抑制可以减少心肌细胞凋亡,但并未加强PQS对H/R心肌细胞的保护作用。 本研究按CaN测试盒步骤测定心肌细胞CaN活性,以Western blotting方法,检测心肌细胞CaN表达,发现H/R诱导CaN活性及蛋白表达明显增加,PQS明显抑制H/R引起的CaN活性升高及蛋白表达,单纯PQS预处理组与联合给予CaN抑制剂组均能降低心肌细胞CaN活性及蛋白表达,但2组相比无明显差异,提示CaN活性抑制对于PQS改善H/R后心肌细胞CaN活性及蛋白表达无明显影响。
综上所述,心肌细胞H/R损伤可以导致CaN活性及蛋白表达增加,增加心肌细胞凋亡,FK506抑制CaN活性可以减轻心肌细胞H/R损伤,CaN活性抑制对心肌细胞的保护作用不比单独应用PQS强,提示PQS减轻心肌细胞H/R损伤的机制可能与CaN途径无关。
[参考文献]
[1]曹霞,谷欣权,陈燕萍,等.西洋参茎叶三醇组皂甙对缺血再灌注损伤心肌的保护作用[J]. 中国老年学杂志,2004,7(24):654-655.
[2]殷惠军,张颖,蒋跃绒,等.西洋参叶总皂甙对急性心肌梗死大鼠心肌细胞凋亡及凋亡相关基因表达的影响[J]. 中国中西医结合杂志,2005,25(3):232-235.
[3]关利新,衣欣,杨世杰,等.西洋参茎叶皂甙对大鼠心肌细胞Ca2+内流的影响[J].中国药理与临床,2004,20(6):8-9.
[4]鞠传静,张志国,赵学忠,等.西洋参叶二醇组皂甙对大鼠实验性心室重构的保护作用[J].中国老年学杂志,2007,27(22) :2173-2175.
[5]Li J,Wang J,Russel FD,et al.Activation of calcineurin in human failing heart ventricle by endothelin-1,angiotensin II and urotensin II[J].Br J Phamacol,2005,145(4):432-440.
[6]Wang C, Li YZ, Wang XR, et al. Panax quinquefolium saponins reduce myocardial hypoxia/reoxygenation injury by inhibiting excessive endoplasmic reticulum stress [J]. Shock, 2012, 37(2): 228-233.
[7]王琛,李玉珍,王晓礽,等.西洋参茎叶总皂苷通过抑制过度内质网应激减轻大鼠心肌细胞缺氧/复氧损伤[J].中国病理生理杂志,2012,28(1):22-28.
[8]Simpson P, Savion S. Differentiation of rat myocytes in single cell cultures with and without proliferating nonmyocardial cells. Cross-striations, ultrastructure, and chronotropic response to isoproterenol [J].Circ Res, 1982, 50(1): 101-116.
[9]Liu XH, Wu XD, Han Y, et al. Signal pathway of cardioprotection induced by monophosphoryl lipid A in rabbit myocardium [J]. Pathophysiology, 2002,8(3): 193-196.
[10] Fliss H, Gattinger D. Apoptosis in ischemic and reperfused rat myocardium [J]. Circ Res, 1996, 79(5): 949-956.
[11] Musat-Marcu S, Gunter HE, Jugdutt BI, et al. Inhibition of apoptosis after ischemia-reperfusion in rat myocardium by cycloheximide [J]. J Mol Cell Cardiol, 1999, 31(5): 1073-1082.
[12] Borutaite V, Brown GC. Mitochondria in apoptosis of ischemic heart [J]. FEBS Lett, 2003, 541(1-3): 1-5.
[13] Agostinho P, Lopes JP, Velez Z, et al. Overactivation of calcineurin induced by amyloid-beta and prion proteins [J]. Neurochem Int, 2008, 52(6): 1226-1233.
[14] Bueno OF, Lips DJ, Kaiser RA, et al. Calcineurin Aβ gene targeting predispose the myocardium to acute ische-mia-induced apoptosis and dysfunction [J]. Circ Res, 2004, 94(1): 91-99.
[15] Singh K, Commnal C, Sawyer DB, et al. Adrenergic regulation of myocardial apoptosis [J]. Cardiovasc Res, 2000, 45(3): 713-719.
[16] 李文霞,沈小梅,陈侠,等.钙调神经磷酸酶在老龄大鼠心肌缺血再灌注损伤所致细胞凋亡中的作用[J].中西医结合心脑血管病杂志,2009,7(9):1067-1069.
[17] Ikeda Y,Miura T,Sakamoto J,et al.Activation of ERK and suppression of calcineurin are interacting mechanisms of cardioprotection afforded by delta-opioid receptor activation [J]. Basic Res Cardiol, 2006, 101(5): 418-426.
[18] Nathan M, Friehs I, Choi YH, et al. Involvement of nuclear factor of activated T-cells (NFATc) in calcineurin-mediated ischemic brain damageinvivo[J]. Yao Xue Xue Bao, 2005, 40(4): 299-305.
[19] 沈小梅, 张巨艳, 成蓓,等. 钙调磷酸酶Aα基因过表达在缺血/再灌注和肾上腺素能受体介导的心肌凋亡中的作用[J]. 南方医科大学学报, 2006, 26(11): 1633-1636.
[20] Mano A, Tatsumi T, Shiraishi J, et al. Aldosterone directly induces myocyte apoptosis through calcineurin-dependent pathways[J]. Circulation, 2004, 110(3): 317- 323.
