吡格列酮对大鼠缺血/再灌注心肌转化生长因子β1表达的影响*
2013-03-30李宗斌
王 浩,叶 平,李 泱,李宗斌,王 琳
(1.解放军总医院南楼心血管二科,2.解放军总医院老年心血管病研究所,北京100853)
缺血/再灌注损伤是指组织缺血后恢复血供而引起的更为严重的组织损伤。在再灌注时细胞凋亡是导致细胞再灌注损伤的重要因素,因此再灌注过程中,针对抗凋亡机制的细胞保护可能提供减轻再灌注损伤的新方法。既往我们研究发现临床用于治疗2型糖尿病的噻唑烷二酮类药物具有抗心肌缺血/再灌注损伤的作用,主要机制是减轻再灌注时心肌细胞的凋亡[1-3]。转化生长因子β1(transforming growth factorβ1,TGFβ1)是调节细胞凋亡的重要信号分子,对缺血/再灌注损伤心肌具有保护作用[4],但吡格列酮对TGFβ1在缺血/再灌注时的影响报道较少。本研究在原有研究基础上,观察作为过氧化物酶体增殖物激活受体-γ(peroxisome proliferator-activated receptorγ,PPARγ)激活剂的吡格列酮对缺血/再灌注损伤大鼠心肌组织 TGFβ1表达的影响,以进一步探讨吡格列酮抗缺血/再灌注损伤的分子机制。
1 材料与方法
1.1 主要药品和试剂
吡格列酮由北京太阳药业提供;TRIzol试剂、RT-PCR试剂盒、DNA Marker DL2000购自晶美公司;兔抗大鼠TGFβ1抗体及山羊抗兔二抗购自北京中衫金桥生物技术有限公司;PPARγ特异性阻断剂GW9662购自Sigma公司;引物合成,北京诺赛基因组研究中心有限公司。
1.2 动物及分组
健康雄性 SD大鼠30只,体重200~350 g,军事医学科学院动物中心提供。实验动物随机分为5组(n=6):(1)缺血/再灌注组;(2)吡格列酮 5 mg/(kg·d)组;建立缺血/再灌注模型前吡格列酮灌胃,5 mg/(kg·d)×7 d;(3)吡格列酮 10 mg/(kg·d)组:建立模型前吡格列酮灌胃,10 mg/(kg·d)×7 d;(4)吡格列酮20 mg/(kg·d)组:建立模型前吡格列酮灌胃,20 mg/(kg·d)×7 d;(5)吡格列酮 20 mg/(kg·d)+GW9662组:吡格列酮灌胃,20 mg/(kg·d)×7 d,建立模型前静脉注射 GW9662 0.3 mg/kg。
1.3 模型建立
以10%乌拉坦腹腔注射麻醉大鼠(0.1 ml/kg),监测心电图。气管切开插管,通气频率70 b/min,吸呼比1.25∶1。开胸,以带6/0线的眼科针在冠状动脉根部下1~2 mm、肺动脉窦和左心耳之间穿过,中间垫一塑料管,止血钳夹紧,观察心电图及左室前壁心肌颜色变化。心电图ST段抬高,同时心肌组织颜色变暗判断为结扎成功。30 min后拔出塑料管,使冠状动脉血流再通120 min,再灌注时局部组织充血。再灌注结束后迅速剪下心脏,在心室前壁相同位置留取心肌组织液氮冷冻,分别准备检测心肌细胞凋亡、提取蛋白及组织RNA。
1.4 脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL法)检测心肌细胞凋亡
(1)方法:石蜡切片常规脱蜡至水,新配制的3%H2O2溶液室温放置 10 min,以封闭内源性过氧化物酶 (peroxisomase,POD);蛋白酶 K(25μg/ml)37℃消化 30 min;加 TUNEL混合液,湿盒 37℃,60 min,加 ulcon-POD,37℃,30 min,DAB显色,苏木精复染,中性树胶封片。标记前用DNA酶处理切片做阳性对照,用标记液代替TUNEL反应液做阴性对照。(2)检测内容:阳性细胞核和(或)细胞碎片呈深浅不一的棕黄色,每张切片随机选取10个视野(×400),记数凋亡阳性细胞,以凋亡指数(apoptosis index,AI)反映各组心肌凋亡的情况,AI=(视野内凋亡细胞个数/视野内所有心肌细胞个数)×100%。
1.5 定量逆转录-多聚酶链反应(RT-PCR)测定TGFβ1 mRNA表达
应用TRIzol提取组织总RNA,应用紫外线分光光度仪测定 RNA浓度,取4μg RNA在逆转录酶MMLV催化下合成cDNA,以适量cDNA为模板进行PCR反应。TGFβ1引物序列:上游引物:GGACTACTACGCCAAAGAAG,下游引物:TCAAAAGACAGCCACTCAGG,产物为294 bp。扩增反应条件:94℃预变性5 min,94℃变性45 s,退火温度64℃,退火时间45 s,72℃延伸45 s,26个循环。PCR反应采用Gene Amp PCR system 2400(美国)。PCR产物用2%琼脂糖凝胶电泳进行分离。将凝胶结果进行扫描,以平均光密度比值进行相对定量。
1.6 免疫杂交 (Western blot)测定 TGFβ1蛋白表达变化
组织匀浆,BCA法蛋白定量,蛋白制样,配制SDS-PAGE凝胶,上样量 40μg/lane,采用 BIO-RAD电泳系统(美国)80 V 45 min浓缩,120 V 80 min进行电泳分离。转膜、封闭、加TGFβ1一抗,稀释浓度1∶1 000,加二抗杂交、化学发光显色,以相对比值进行相对定量,即各蛋白目的条带光密度相对强度=各蛋白目的条带灰度值/假手术组蛋白目的条带灰度值。
1.7 统计学处理
实验数据以均数±标准差(¯x±s)表示,用奇思统计软件(2004版)进行统计学处理,多组间数据比较采用ANOVA检验,两组间比较用 t检验。
2 结果
2.1 吡格列酮对心肌细胞凋亡的影响
TUNEL检测结果,缺血/再灌注组心肌细胞A I为40.1% ±12.3%,吡格列酮 5、10、20 mg/(kg·d)组分别为 21.4% ±8.8%、17.3%±8.7%、14% ±9.6%,与缺血/再灌注组比较差异均有统计学意义(P<0.05)。吡格列酮 20 mg/(kg·d)+GW9662组AI为35%±11.3%,与各吡格列酮组比较差异均有统计学意义(P<0.05,图 1)。
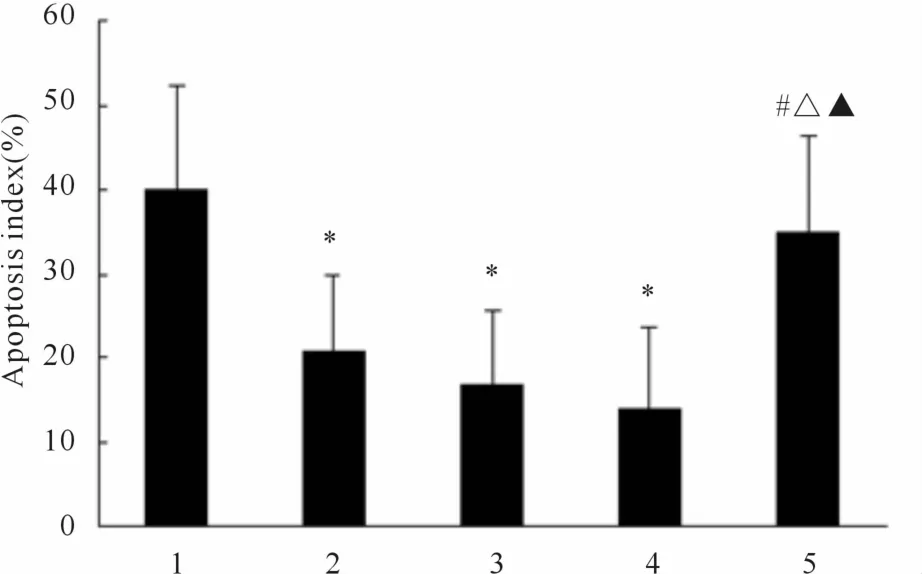
Fig.1 Effects of pioglitazone on myocardial apoptosis in the ischemia/reperfusion model of rat hearts 1:Ischemia/reperfusion group;2:PIO 5 mg/(kg·d)group;3:PIO 10 mg/(kg·d)group;4:PIO 20 mg/(kg·d)group;5:PIO 20 mg/(kg·d)+GW9662 group;PIO:Pioglitazone*P<0.05 vs 1 group;#P<0.05 vs 2 group;△P<0.05 vs 3 group;▲P<0.05 vs 4 group
2.2 吡格列酮对TGFβ1 mRNA表达的影响
与缺血/再灌注组比较,吡格列酮 5、10、20 mg/(kg·d)组 TGFβ1 mRNA在缺血/再灌注后表达上调(P<0.05),吡格列酮各组之间无统计学差异(P>0.05)。与吡格列酮各组比较,吡格列酮 20 mg/(kg·d)+GW9662组 TGFβ1 mRNA表达下调(P<0.05,图 2)。

Fig.2 Effects of pioglitazone on TGFβ1 mRNA expression A:TGFβ1 mRNA expression;B:Densitometric analysis of TGFβ1 mRNA signals;1:Ischemia/reperfusion group;2:PIO 5 mg/(kg·d)group;3:PIO 10 mg/(kg·d);4:PIO 20 mg/(kg·d);5:PIO 20 mg/(kg·d)+GW9662 group;PIO:Pioglitazone;TGFβ1:Transforming growth factorβ1*P<0.05 vs 1 group;#P<0.05 vs 2 group;△P<0.05 vs 3 group;▲P<0.05 vs 4 group
2.3 吡格列酮对TGFβ1蛋白表达的影响。
与缺血-再灌注组比较,吡格列酮 5、10、20 mg/(kg·d)组TGFβ1蛋白在缺血/再灌注后表达上调(P<0.05),吡格列酮各组之间无统计学差异(P>0.05)。与吡格列酮各组比较,吡格列酮 20 mg/(kg·d)+GW9662组 TGFβ1蛋白表达下调(P<0.05,图3)。
3 讨论
心肌缺血后实行再灌注过程在挽救存活细胞的同时,也会带来细胞的损伤。再灌注损伤成为阻碍缺血心肌从再灌注疗法中获得最佳疗效的主要难题。再灌注损伤与细胞内钙超载、氧自由基及炎症介质有关,如何防治缺血/再灌注损伤已成为目前研究的热点问题[5]。近年针对缺血/再灌注损伤保护的研究涉及缺血预适应、药物预适应等,可用于预适应的药物包括阿片受体拮抗剂等[5]。钙离子拮抗剂Adalat可抑制缺血/再灌注后心肌细胞凋亡,缩小梗死面积[6]。同时缺血/再灌注所涉及的细胞信号转导机制复杂,包括细胞外信号分子、细胞膜上信号接收器、细胞内信号转导通路及其效应器等多方面的变化,并在多层次和诸多环节存在交互作用。深入认识再灌注损伤的细胞信号转导途径,有助于阐明其细胞分子机制,为临床防治提供新的思路[7]。

Fig.3 Effects of pioglitazone on TGFβ1 protein expression A:Immunoblot of TGFβ1 expression;B:Densitometric analysis of TGFβ1 protein signals;1:Ischemia/reperfusion group;2:PIO 5mg/(kg·d)group;3:PIO 10mg/(kg·d)group;4:PIO 20mg/(kg·d)group;5:PIO 20mg/(kg·d)group+GW9662 group;PIO:Pioglitazone;TGFβ1:Transforming growth factorβ1*P<0.05 vs 1 group;#P<0.05 vs 2 group;△P<0.05 vs 3 group;▲P<0.05 vs 4 group
临床用于治疗2型糖尿病的噻唑烷二酮类药物是PPARγ激活剂,本实验室既往研究证实,吡格列酮可以通过剂量依赖性方式抑制凋亡相关蛋白Bax的表达,增加Bcl-2的表达,减少心肌细胞凋亡,缩小缺血/再灌注后梗死面积,保护心肌。本研究发现,与缺血/再灌注组比较,三种剂量吡格列酮组的TGFβ1表达明显增加,提示吡格列酮可能通过上调TGFβ1表达发挥抗凋亡的保护作用。TGFβ1参与许多重要的发育决定,调节细胞的生长、分化、凋亡、细胞黏附等。与心肌缺血/再灌注损伤关系密切。研究提示TGFβ1有助于减轻心肌缺血/再灌注损伤,保护心肌[8]。借助病毒载体将TGFβ1导入体内进行基因治疗是一条希望之路[4]。Dandapat A等人利用将TGFβ1注射入大鼠心脏,在证实TGFβ1在整个心脏过表达之后予以缺血/再灌注,与对照组相比,TGFβ1注射组的心肌梗死面积明显缩小,这种作用与NADPH氧化酶和NF-kappaB的激活减少及心肌组织丙二醛水平降低相关,提示TGFβ1过表达对心肌的保护作用是通过抗氧化实现的[9]。Chen H等发现将大鼠应用重组TGFβ1预处理,再予以缺血/再灌注时可以明显减轻心肌坏死和心脏功能异常,并下调缺血/再灌注诱发的高表达的基质金属蛋白酶-1(matrix metalloproteinase-1,MMP-1),提示保护作用与下调 MMP-1有关[10]。
本研究中还发现,PPARγ特异性阻断剂GW9662逆转了吡格列酮对凋亡细胞的抑制作用,抑制吡格列酮促进TGFβ1表达上调的作用,提示吡格列酮对心肌细胞凋亡的抑制作用及上调TGFβ1表达的作用上调可能是由PPARγ介导的。
总之,本实验结果发现吡格列酮抑制缺血/再灌注诱导的心肌细胞凋亡,能在mRNA及蛋白水平上调TGFβ1,提示 TGFβ1信号通路可能是吡格列酮发挥保护作用的信号途径之一,这种作用可能是由PPARγ介导的。但是,在缺血/再灌注损伤的保护作用中,TGFβ1的下游靶分子或靶细胞器尚需要进一步的研究来明确其具体信号传导机制。
[1] Cao Z L,Ye P,Long C L,et al.Effect of pioglitazone,a peroxisome proliferator-activated receptor gamma agonist,on ischemia-reperfusion injury in rats[J].Pharmacol,2007,79(3):184-192.
[2] 曹泽玲,叶 平,龙超良,等.吡格列酮对缺血再灌注心肌细胞凋亡影响的实验研究[J].中华心血管病杂志,2005,31(7):648-652.
[3] 曹泽玲,叶 平,龙超良,等.吡格列酮对大鼠心脏缺血再灌注损伤的保护研究[J].中国临床药理学与治疗学,2005,10(10):1112-1117.
[4] Hermonat PL,Li D,Yang B,et al.Mechanism of action and delivery possibilities for TGFbeta1 in the treatment of myocardial ischemia[J].Cardiovasc Res,2007,74(2):235-243.
[5] 昝香怡,李培杰,张正义,等.阿片受体拮抗剂对大鼠心肌缺血/再灌注损伤的保护效应[J].中国危重病急救医学,2007,19(11):693-694.
[6] 冯全洲,李天德,王兆霞,等.钙离子拮抗剂对大鼠心肌梗死后心肌细胞凋亡的影响[J].中国危重病急救医学,2004,16(3):133-136.
[7] 韩 笑,刘建勋.心肌缺血再灌注损伤的细胞信号转导机制[J].中国药理学通报,2004,20(1):4-7.
[8] Flanders K C,Burmester JK.Medical applications of transforming growth factor-beta[J].Clin Med Res,2003,1(1):13-20.
[9] Dandapat A,Hu CP,Li D,et al.Overexpression of TGF-beta1 by adeno-associated virus type-2 vector protects myocardium from ischemia-reperfusion injury[J].Gene Ther,2008,15(6):415-423.
[10] Chen H,Li D,Saldeen T,et al.TGF-beta 1 attenuates myocardial ischemia-reperfusion injury via inhibition of upregulation of MMP-1[J].Am J Physiol Heart Circ Physiol,2003,284(5):H1612-1617.
