HMGB1/SREBP-1参与IFN-γ介导的小鼠肾小球系膜细胞内的脂质沉积*
2013-03-30张玉军陈砚凝郑书深刘青娟杨保卫刘淑霞
张玉军,陈砚凝,郑书深,刘青娟,郝 军,韩 嫣,杨保卫,刘淑霞△
(1.河北医科大学病理教研室,石家庄050017;2.河北医科大学第四医院病理科,石家庄050012;3.石家庄人民医学高等专科学校,石家庄050091;4.河北医科大学,石家庄050017;5.解放军总参三部保定干休所卫生所,河北保定071000)
狼疮性肾炎(lupus nephritis,LN)是系统性红斑狼疮(systemic lupus erythematosus,SLE)重要的并发症,也是患者死亡的重要原因之一。目前研究发现,SLE患者常伴有脂代谢的异常,低密度脂蛋白升高和高密度脂蛋白降低是其重要的特点,同时脂代谢异常的水平与患者的疾病活动度有关[1-3]。另有研究显示,脂代谢异常与患者的肾脏损害密切相关。
我们的前期试验结果显示,SLE患者伴有血脂水平的升高,且升高与LN的发生密切相关;同时动物实验显示,在狼疮性肾炎小鼠肾组织中系膜区油红O染色阳性,提示在狼疮性肾炎肾组织中有脂滴沉积,同时伴有小鼠血脂升高,推断在狼疮性肾炎发病过程中伴有脂代谢的异常,但脂质沉积的机制如何,有待于进一步证实。
高迁移率族蛋白1(high mobility group protein 1,HMGB1)作为一种晚期炎症介质参与了多种疾病的发生和发展,且于狼疮性肾炎患者及小鼠血清和肾组织中均表达上调[4],但其表达与肾小球系膜细胞的脂质沉积是否有关及可能机制,目前尚不清楚。
因此,本研究以小鼠系膜细胞为研究对象,观察γ-干扰素是否引起其脂质沉积,并通过观察HMGB1、SREBP-1及脂肪酸合成酶(fatty acid synthetase,FAS)的表达变化,探讨其可能机制。
1 材料与方法
1.1 材料
油红O、IFN-γ和重组HMGB1购自Sigma公司。Trizol和 Lipofectamine 2000购自 Invitrogen公司。兔抗固醇调节元件结合蛋白-1(sterol regulatory element binding protein-1,SREBP-1)、鼠抗 FAS单克隆抗体购自Santa Cruz公司,兔抗HMGB1抗体购自Abcam公司,小鼠抗β-actin抗体和辣根酶标记羊抗兔或羊抗小鼠二抗均购自北京中杉金桥公司。电化学发光(electrochemilu-minescence,ECL)试剂购自美国 Santa Cruz公司。
1.2 细胞培养及分组
1.2.1 细胞 小鼠系膜细胞(MMC:ATCC No.CRL-1927)为本实验室冻存,以含5%胎牛血清的DMEM/F12(DMEM∶F12=3∶1)培养基,于 37℃,5%CO2孵箱中培养。
1.2.2 细胞分组 (1)为了检测 IFN-γ对 MMC中HMGB1、SREBP-1、FAS表达的影响,将常规培养的MMC细胞无血清培养24 h后随机分成2组:对照组(N)和 IFN-γ(500 IU/ml)刺激组(IFN-γ组),分别于0,2,4、6、8,12 h收集不同时间点细胞;(2)为了进一步确定HMGB1在IFN-γ诱导的MMC细胞脂质沉积中的作用,将常规培养的MMC细胞随机分为四组:正常对照组(control);IFN-γ(500 IU/ml)刺激组(IFN-γ组);IFN-γ+sh-HMGB1组和 IFN-γ+空质粒组,于IFN-γ刺激8 h时收集细胞;(3)为了确定HMGB1是否通过上调SREBP-1表达诱导MMC细胞的脂质沉积,将常规培养的MMC细胞随机分为四组:正常对照组(control);HMGB1(0.1 mg/L)刺激组(HMGB1组);HMGB1+sh-SREBP-1组和 HMGB1+空质粒组,于HMGB1刺激8 h时收集细胞。
1.3 细胞转染
采用脂质体2000进行细胞转染(具体步骤按照说明书进行)。将常规培养的 MMC细胞(融合80%)时分为正常对照组、单纯刺激组、刺激+空质粒组和刺激+质粒转染组(2.0μg DNA+4μl Lipofectamine 2000/2 ml无血清培养基),转染12 h后单纯刺激组、刺激+空质粒组和刺激+质粒转染组中分别加入 IFN-γ(500 IU/ml)或 HMGB1(0.1 mg/L),于刺激8 h时收集细胞进行相关指标的检测。
1.4 油红O染色检测MMC细胞中脂质沉积
将4%多聚甲醛固定的细胞取出后浸泡入PBS中5 min,油红O染色15 min,异丙醇分化液中分化数秒,蒸馏水冲净,淡苏木素染色5 min,冲净后甘油明胶封片。
1.5 蛋白印记(Western blot)检测 MMC细胞中HMGB1、SREBP-1和FAS蛋白的表达
收集不同时间点细胞,低温下加入约5倍体积的裂解缓冲液,冰上裂解 30 min,低温高速离心(4℃、12 000 r/min、20 min),上清液即为所提取的蛋白溶液。采用考马斯亮蓝试剂法进行蛋白定量。等量蛋白(50μg)进行SDS-PAGE电泳,转膜,以5%脱脂奶粉 37℃封闭 2 h,加入兔抗 HMGB1(1∶1 000)、SREBP-1(1∶400)、鼠抗 FAS(1∶500)和β-actin(1∶1 000)抗体,4℃孵育过夜,TBST洗膜后以HPR标记的 IgG二抗(1∶5 000)37℃封闭 2 h,TBST洗膜,ECL化学发光成像。底片透扫后以LabWorks 4.5软件对条带进行定量分析,目的蛋白表达以目的条带和βactin条带积分光密度值的比值(IOD值)代表目的蛋白的相对表达量。
1.6 RT-PCR检测细胞中 HMGB1、SREBP-1和FASmRNA表达
Trizol法提取细胞总RNA,紫外分光光度计定量。取等量RNA,以M-MLV反转录为cDNA,TaqDNA聚合酶催下进行PCR扩增,引物序列见表1。将PCR产物在1%琼脂糖凝胶中进行电泳,然后进入凝胶图像分析系统(美国UVP公司)进行吸光度扫描,以管家基因β-actin作为内参照校正,用目的基因的吸光度和β-actin吸光度的比值作为目的基因的相对表达含量。
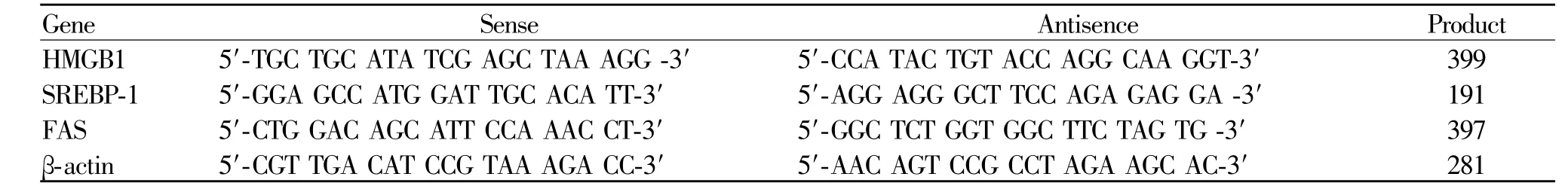
Tab.1 Primers and product for HMGB1,SREBP-1,FASandβ-actin
1.7 统计学处理
所有计量资料均用均数±标准差(±s)表示,采用SPSS 11.0统计软件进行统计分析,两组间比较采用多重比较的方差分析。
2 结果
2.1 IFN-γ能够诱导MMC细胞内脂质增多
油红O染色显示正常组MMC细胞内未出现明显脂滴,而IFN-γ刺激组8 h时MMC细胞即可以出现红染脂滴颗粒,刺激12 h红染的脂滴颗粒与8 h相比没有明显的变化(图1)。
2.2 IFN-γ 能够上调 MMC细胞中 HMGB1、SREBP-1和FASmRNA及蛋白表达
RT-PCR结果显示,IFN-γ刺激能够上调HMGB1、SREBP-1和FASmRAN的表达,并呈时间依赖性(图2A)。Western blot结果显示,与0 h相比,IFN-γ组 HMGB1、SREBP-1和 FAS蛋白表达明显升高,呈时间依赖性,12 h时 HMGB1、SREBP-1和 FAS蛋白的 IOD值分别为(1.79±0.04);(1.15±0.02)和(0.96±0.09)明显高于 0 h,2 h,4 h和 8 h(图2B,P<0.05)。
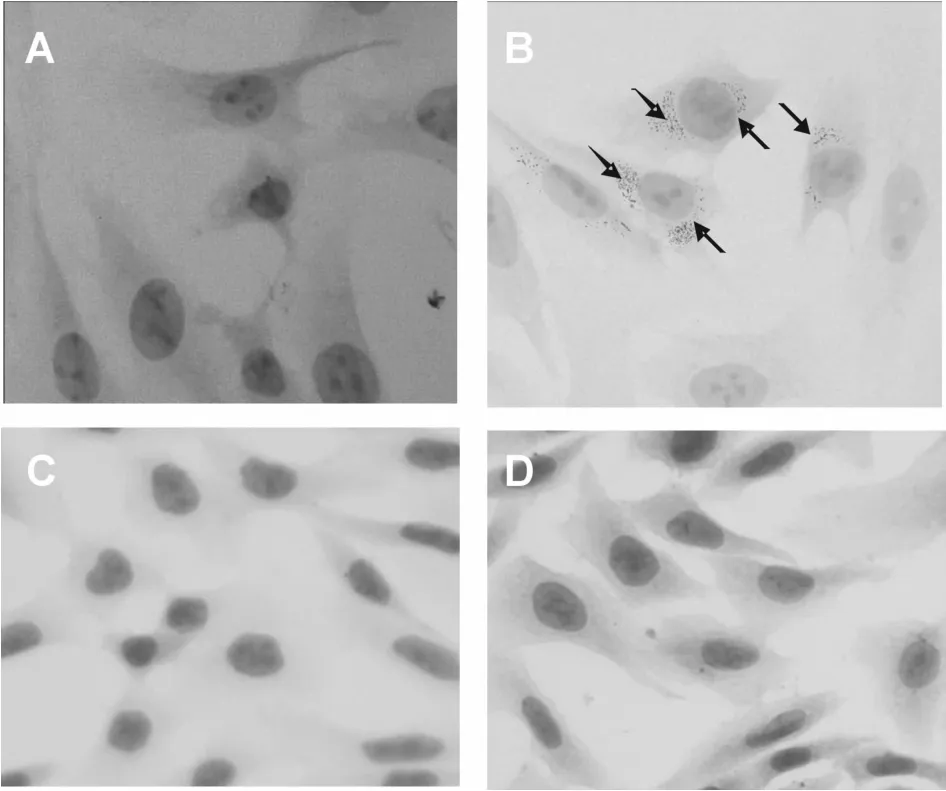
Fig.1 Lipid droplets formation in MMCcells induced by IFN-γin MMC cells at 8 h(Oil Red O staining×400)A:Control group;B:IFN-γ group;C:IFN-γ+sh-HMGB1 group;D:HMGB1+sh-SREBP-1 group;MMC: Mouse mesangial cells;IFN-γ:Interferon-γ;HMGB1:High mobility group protein 1;SREBP-1:Sterol regulatory element binding protein-1
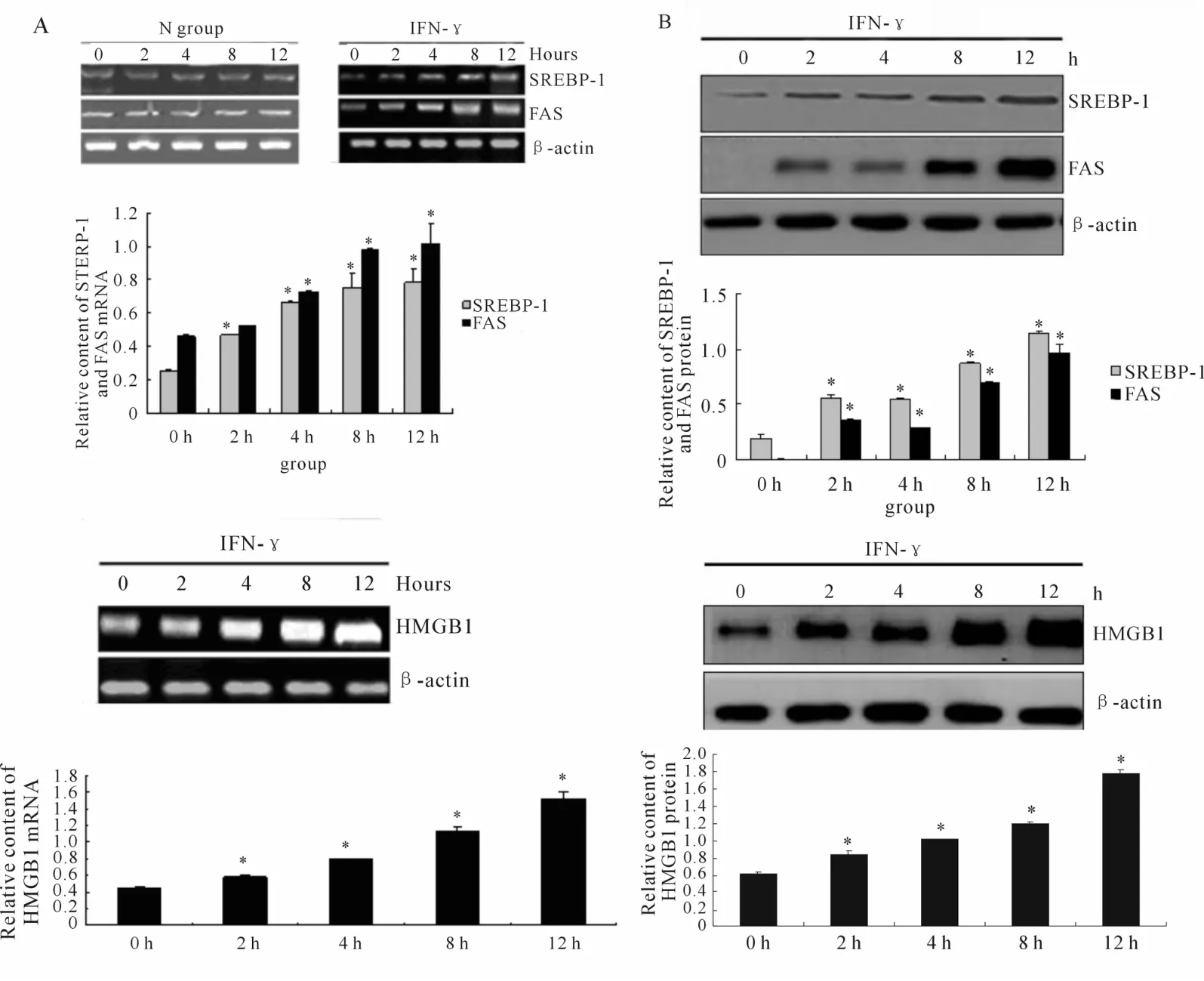
Fig.2 Expression of SREBP-1,FAS,HMGB1 mRNA and protein in MMCcells detected by RT-PCR and Western blotA:RT-PCR;B:Western Blot;SREBP-1:Sterol regulatory element binding protein-1;FAS:Fatty acid synthetase;HMGB1:High mobility group protein-1**P<0.05 vs 0 h group
2.3 sh-HMGB1能够降低 IFN-γ诱导的 MMC细胞中SREBP-1、FAS蛋白表达,并且降低细胞内脂质沉积
与正常对照组相比,IFN-γ能够上调 SREBP-1和 FAS蛋白的表达;而 IFN-γ+sh-HMGB1组中SREBP-1和FAS蛋白表达均明显降低,差异具有统计学意义(图 3,P<0.05)。油红 O染色显示,在IFN-γ刺激组MMC细胞的胞浆中可见明显的红染的脂滴颗粒,但在IFN-γ+sh-HMGB1组中未见明显的红染脂滴颗粒(图1)。

Fig.3 Expression of SREBP-1 and FASprotein in MMCcells detected by Western blot A:Western blot;B:Densitometric scanning;1:Control;2:IFN-γ;3:IFN-γ+sh-HMGB-1;4:IFN-γ+sh-Scramble*P<0.05 vs control; #P<0.05 vs IFN-γ
2.4 沉默SREBP-1表达能够降低HMGB诱导的MMC细胞中SREBP-1蛋白表达和脂质沉积
与对照组相比,HMGB刺激能够上调MMC细胞SREBP-1和FAS蛋白表达,刺激8 h时达高峰,12 h稍有下降,并伴有细胞内脂质沉积(图 4);采用siRNA技术沉默MMC细胞中SREBP-1表达能够减少HMGB诱导的FAS蛋白表达和细胞内脂质沉积(图1)。
3 讨论
狼疮性肾炎是系统性红斑狼疮重要的并发症,其伴有多种临床表现如高血脂、糖代谢异常、高血压等。目前国内外学者研究发现,狼疮性肾炎患者和实验动物肾组织中可见脂质沉积并且伴有血脂升高;我们的前期实验也显示,狼疮性肾炎患者和BXSB鼠(狼疮鼠模型)16周时均可出现血脂升高,油红O染色发现在肾组织中可见红染的脂滴颗粒,因此我们推断,狼疮性肾炎发病过程中伴有肾组织的脂质沉积,但其机制如何,目前尚不清楚。
目前大多观点认为,狼疮性肾炎的发生与免疫系统功能异常、各种细胞因子分泌及表达紊乱有关。多种细胞因子共同作用参与了肾炎的发生。γ-干扰素是狼疮性肾炎发病过程中重要的细胞因子,且在疾病早期就可以出现[5],具有多种生物学功能。为了阐明狼疮性肾炎发病过程中脂质沉积的可能机制,本研究以 IFN-γ为刺激物,油红 O染色观察MMC细胞中脂质沉积的情况,结果显示,IFN-γ刺激组MMC细胞的胞浆中可见明显的红染的脂滴颗粒,提示IFN-γ能够诱导MMC细胞出现脂质沉积。
HMGB1参与了多种免疫性疾病的发生过程。HMGB1作为一种核蛋白被首次发现。同时其作为炎性因子和免疫佐剂的作用受到了更多的重视。HMGB1可由单核巨噬细胞释放,同时可在LPS、TNF-α等炎性因子刺激下由受损细胞或坏死细胞释放,并反过来作用于受损细胞,促使更多炎性因子释放并发挥作用,从而放大了炎症反应。目前研究显示,胞外的HMGB1是一种重要的晚期炎症介质,参与多种疾病的发生和发展[8,9]。我们的前期实验显示,HMGB1是狼疮性肾炎发病过程中重要的细胞因子[10],但其是否参与 IFN-γ介导的 MMC细胞中的脂质沉积国内外未见报道。SREBPs属于螺旋-环-螺旋-亮氨酸锌指(bHLH-Zip)转录因子家族,其包括SREBP-1和 SREBP-2,SREBP-1基因位于17号染色体,有19个外显子和18个内含子,其mRNA长度约为4 154 bp,翻译的成熟片段分子量为 68 kD,SREBP-1可调控脂肪酸和甘油三酯的合成[6]。我们的前期研究显示,SREBP-1参与高脂饮食引起的肾脏小管细胞脂质沉积[7]。但其是否参与HMGB1诱导的MMC细胞脂质沉积目前尚不清楚。
本实验再次证实,IFN-γ能够提高体外培养的MMC细胞HMGB1mRNA及蛋白表达,同时SREBP-1及其下游基因FASmRNA及蛋白表达均明显升高,沉默HMGB1后能够显著降低IFN-γ诱导的SREBP-1和FAS蛋白的表达,同时降低细胞内脂质沉积。
本研究还发现:重组HMGB1能够上调细胞内SREBP-1和 FAS蛋白表达;采用 siRNA技术沉默SREBP-1表达后,FAS蛋白表达降低,且细胞中红染的脂滴颗粒明显减少。
因此,综上所述,我们认为上调HMGB1/SREBP/FAS表达是IFN-γ介导小鼠系膜细胞脂质沉积的可能机制之一。
[1] Ilowite N T,Samuel P,Ginzler E,et al.Dyslipoproteinemia in pediatric systemic lupus erythematosus[J].Arthritis Rheum,1988,31(7):859-863.
[2] BorbáE F,Bonfa E.Dyslipoproteinemias in systemic lupus erythematosus:influence of disease,activity,and anticardiolipin antibodies[J].Lupus,1997,6(6):533-539.
[3] Svenungsson E,Gunnarsson I,Guo Z F,et al.Elevated triglycerides and low levels of high-density lipoprotein as markers of disease activity in association with up-regulation of the tumor necrosis factor alpha/tumor necrosis factor receptor system in systemic lupus erythematosus[J].Arthritis Rheum,2003,48(9):2533-2540.
[4] 封晓娟,刘淑霞,张玉军,等.NF-KB途径在小鼠狼疮性肾炎发病中的可能作用[J].中国免疫学杂志,2010,26(2):169-173,177.
[5] Segal R,Dayan M,Globerson A,et al.Effect of aging on cytokine production in normal and experimental systemiclupus erythematosus afflicted mice[J].Mech Ageing Dev,1997,96(1-3):47-58.
[6] Choi W I,Jeon B N,Park H,et al.Proto-oncogene FBI-1(Pokemon)and SREBP-1 synergistically activate transcriptio of fatty-acid synthase gene(FASN)[J].J Biol Chem,2008,283(43):29341-29354.
[7] Hao J,Liu S X,Zhao S,et al.High-fat diet causes increased serum insulin and glucose which synergistically lead to renal tubular lipid deposition and extracellular matrix accumulation[J].Br J Nutr,2012,107(1):74-85.
[8] Pisetsky D S,Erlandsson-Harris H,Andersson U.High-mobility group box protein 1(HMGB1):an alarmin mediating the pathogenesis of rheumatic disease[J].Arthritis Res Ther,2008,10(3):209.
[9] Yoshizaki A,Komura K,Iwata Y,et al.Clinical significance of serum HMGB-1 and sRAGE levels in systemic sclerosis:association with disease severity[J].J Clin Immunol,2009,29(2):180-189.
[10] Feng X J,Hao J,Liu QJ,et al.HMGB1 mediates IFN-γinduced cell proliferation in MMC cells through regulation of cyclin D1/CDK4/p16 pathway[J].J Cell Biochem,2012,133(6):2009-2019.
