昆明鼠胚胎干细胞系建立中原代克隆生长及其传代方法的研究
2013-03-25王磊光董云玲王洪岩吴爱华
李 娟 王磊光 魏 斌 董云玲 盖 凌 王洪岩 吴爱华 邱 毅
山东省计划生育科学技术研究所,山东省优生重点实验室(济南,250002)
胚胎干细胞(ES细胞)是囊胚内细胞团(ICM)经体外培养获得的、能无限进行对称分裂并保持未分化状态的多能性细胞系。1981年由Evans等[1]建立了第一个小鼠ES细胞系,目前已经建立的小鼠胚胎干细胞系多来源于129品系、C57BL/6J和BALB/C品系的小鼠。昆明小鼠是一种国产远交系小鼠,其基因型与人类相似,是我国应用最多的实验小鼠。有效建立昆明小鼠的ES细胞系,有利于以其为实验材料的各项试验的顺利高效进行。但昆明小鼠ES细胞建系的成功率很低,在小鼠ES细胞分离培养中遇到的困难是成功获得ES细胞集落的比率低和不能稳定传代。本研究针对不同囊胚内ICM分离方法、原代干细胞克隆分离时机及干细胞传代方法对昆小鼠ES细胞建系效率的影响进行探讨。
1 材料与方法
1.1 主要试剂与仪器
1.1.1 试剂 孕马血清(宁波第二激素厂),人绒毛膜促性腺激素(hCG,广州丽珠制药厂),丝裂霉素-C、L-谷氨酰胺(Sigma公司,美国),胎牛血清(杭州四季青),DMEM培养基、胰酶、非必需氨基酸、二巯基乙醇、链酶蛋白酶、(Gibco公司,美国),白血病抑制因子(LIF,Chemicon公司,美国),碱性磷酸酶(江苏碧云天生物技术研究所)、Oct-4试剂盒(北京博奥森生物技术有限公司)。
1.1.2 仪器 解剖显微镜、倒置显微镜、荧光显微镜(Nikon,日本),二氧化碳培养箱(Galaxy,英国)。
1.2 方法
1.2.1 昆明鼠囊胚的获取 昆明鼠由山东大学实验动物中心提供。选取7~8周龄阴道口呈粉红色的雌鼠,于16:00腹腔注射孕马血清10U,47~48 h后腹腔注射hCG 10U,并与正常雄鼠合笼(雄雌比为1∶2),合笼第2天上午8:00观察雌鼠有无阴道栓形成见栓日为妊娠第0.5天;3 d后将见阴栓的孕鼠颈椎脱臼处死,打开腹腔,取出子宫,在解剖镜下用1ml注射器从宫角端缓慢注入冲胚液(含5% 胎牛血清的PBS)冲洗子宫,将胚胎冲出。用凹皿收集冲胚液,解剖镜下收集形态饱满,发育良好的囊胚的用于干细胞培养。
1.2.2 昆明鼠成纤维细胞(MEF)的制备 取孕13.5d雌鼠的胚胎,去除头、四肢及内脏,躯干部分用眼科剪剪成约1mm3组织块,用0.25%的胰蛋白酶室温消化3~5min。用2倍于酶液鼠胚成纤维细胞的培养液终止消化,轻轻吹打混匀,收集细胞接种在培养瓶中,放入37℃、5%CO2培养箱中培养。当大部分细胞贴壁后更换新鲜培养液,以后隔天换液,逐天观察,当细胞80%铺满皿底部时,即可进行传代。2~3代的MEF用来制备饲养层。MEF中加入含10μg/ml丝裂霉素C的培养基,培养2~3h,常规胰酶消化,单细胞悬液按密度5×104/ml种植到预先用明胶处理过的培养皿中,细胞贴壁伸展后,饲养层细胞制备完毕,用于ES细胞培养。
1.2.3 实验分组 将每只鼠获得的囊胚随机分成2组。①全胚培养组:囊胚直接移入制备好的MEF饲养层上培养,移入前1~3h换成胚胎干细胞培养液;培养1~2天后大部分囊胚开始孵出并贴壁生长,培养4~6天ICM隆起致密,呈柱状垂直生长。②免疫外科组:链蛋白酶去除囊胚透明带,将无透明带的囊胚置于兔抗鼠血清,培养箱培养30min,PBS清洗后,加豚鼠补体血清培养30min,待滋养层细胞肿胀、松散后,PBS洗3次,用毛细管轻轻吹打,去除外层已肿胀的滋养层细胞,得到ICM。获得的ICM接种到新鲜MEF饲养层细胞上培养,移入ICM前1~3h换成胚胎干细胞培养液。
1.2.4 干细胞培养 当ICM呈明显的柱状生长时,用玻璃针挑出ICM,机械分割为4~8块,每块约含干细胞50~100个,接种于含新饲养层细胞的培养皿中培养。离散的ICM培养1d细胞开始贴壁,2d后可见有岛丘状或鸟巢状ES细胞样集落出现,此时半量换液。继续培养3~4d后,可见集落体积增大,折光性增强。挑取形态典型、周围没有分化迹象,生长旺盛的ES集落,机械分割成小块,重新接种传代,1~5代胚胎干细胞用机械法传代,5代后可用0.25%胰酶+0.02%EDTA消化传代。
1.2.5 昆明鼠ES细胞的鉴定 ①生物学特性观察,倒置显微镜下观察胚胎生长和ES细胞集落的形态特征及生长状态;②碱性磷酸酶(AKP)组织化学染色鉴定,按碱性磷酸酶试剂盒说明操作,镜下观察AKP染色紫蓝色为阳性,AKP染色呈淡黄色或无色为阴性;③Oct-4免疫荧光染色;④染色体检查。
1.2.6 ES细胞体外诱导分化 选取传10代以上生长旺盛、形态典型的胚胎干细胞集落,用胰酶消化成小团,毛细玻璃管吸取并放在预先制备好的培养皿盖上,滴加不含LIF的ES细胞培养液,翻转皿盖使液滴悬挂在盖子上,置37℃、5%CO2培养箱中悬浮培养,定时观察,隔天半量换液。
2 结果
2.1 免疫外科法分离ICM
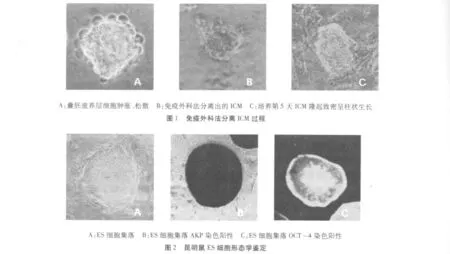
肿胀、松散的滋养层细胞见图1-A,分离出其中的ICM见图1-B,图1-C为培养4~5 d ICM隆起致密,呈柱状生长。
2.2 昆明鼠ES细胞形态学鉴定
分离得到的ES细胞集落呈典型鸟巢状,圆形或椭圆形,表面光滑,结构致密,与周围的滋养层细胞有明显的界限,细胞体积小、核大,集落内细胞界限不清,符合干细胞的形态特征。稳定传20代以上有7个,对传至5代以后的干细胞每批部分冷冻保存,其余继续传代,最长传26代未见形态上的分化现象,全部冷冻保存,见图2A。镜下观察干细胞集落AKP染色紫蓝色,呈阳性,见图2B。成纤维细胞AKP染色成淡黄色或无色,呈阴性。Oct-4免疫荧光染色鉴定呈阳性,见图2C。
2.3 不同胚胎内细胞团分离方法对ES细胞分离克隆的影响
本试验收集孕鼠3.5 d囊胚62个,其中全胚培养组30个,内细胞团种植并呈柱状生长11个,传5代的4个,传10代以上3个;免疫外科法分离组32个,获内细胞团15个,内细胞团种植并呈柱状生长形成原代克隆9个,传至5代的5个,传至10代以上4个。
2.4 染色体检查
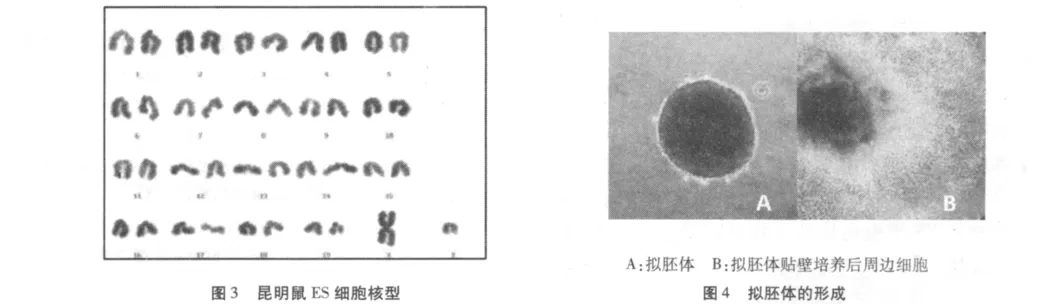
将传至第10代以上的胚胎干细胞胰酶消化形成细胞悬液,通过多次贴壁去除滋养层细胞,采用常规G显带法分析细胞染色体核型。全胚培养法稳定传10代以上有3个,染色体检查雌鼠ES细胞系1个核型为40XX,雄鼠 ES细胞系2个核型为40XY;免疫外科法稳定传10代以上有4个,染色体检查雌鼠ES细胞系2个核型为40XX,雄鼠ES细胞系2个核型为40XY。见图3。
2.5 ES细胞体外分化能力的鉴定
ES 细胞经过4天的悬浮培养,形成拟胚体(EBs),贴壁培养后发现EBs外向性生长,周围分化的细胞形态呈多样性,见图4。培养17天后形成心肌样细胞,有自发搏动。
3 讨论
成功建立小鼠ES细胞系的关键条件是要一方面是能促进ES细胞分裂增殖,另一方面是能抑制其分化。真正意义上的ES细胞应具有自我更新能力、多向分化潜能和参与形成种系嵌合体3个特性[2]。本研究分离到的 ES细胞集落呈典型鸟巢状,细胞体积小、核大,符合干细胞的形态特征;干细胞集落AKP染色和Oct-4免疫荧光染色鉴定均呈阳性;ES细胞体外悬浮培养,ES细胞集落能够形成拟胚体,贴壁培养后发现EBs外向性生长,周围分化的细胞形态呈多样性,培养17天后形成心肌样细胞,有自发心肌搏动,因此符合小鼠胚胎干细胞的大部分基本特征。本研究针对昆明鼠ES分离培养中的几个关键环节进行以下探讨。
3.1 ICM分离方法的影响
常见的ICM主要分离方法包括全胚培养法与免疫外科法。全胚法培养操作简便易行,并且对细胞的损伤较小,更符合生理状态,但有些胚胎不能孵出,胚胎不能种植,能够孵出的胚胎几乎都能贴壁;缺点是全胚法获得的ES细胞混杂有其他细胞,例如包裹在外的滋养层细胞贴壁后很容易分化成内皮样或上皮样细胞,因此需要经过传代筛选才能获得较纯的ES细胞株。另外,由于受滋养层细胞的干扰易导致ICM分化。本研究30个昆明鼠囊胚,种植并保持未分化状态形成原代干细胞的11个,最终形成干细胞系的3个。免疫外科法是1975年由Solter等[3]创建的,其原理首先是将抗体与滋养层细胞结合,然后加补体,使滋养外胚层细胞在免疫介导的补体细胞毒作用下被溶解。由于滋养层细胞之间存在紧密连接和桥粒,在特定的时间内抗体和补体只与滋养层细胞的表面抗原作用,抗体不能穿透囊胚腔结合于ICM,因此不破坏ICM[4,5]。免疫外科法分离得到ICM后很快贴壁生长增殖,分离效率高于全胚法,能得到较纯的ICM,培养时没有滋养层细胞的干扰。缺点是操作过程复杂,增加污染和胚胎丢失机会,抗体和补体处理时间把握不好容易损伤ICM,对ES细胞后期生长也有一定影响。本研究32个囊胚只得到15个ICM,可能是抗体和补体作用时间控制不好损伤了ICM造成胚胎丢失,而15个ICM种植并保持未分化状态形成原代干细胞9个,最终形成干细胞系4个,免疫外科法种植和分离效率高于全胚培养法。
3.2 原代ES细胞离散的时机
保证ICM增殖且保持未分化状态,才能有效地分离和克隆ES细胞,关键是把握ICM离散的时机。传代时间太早,ICM细胞数量少,形成ES细胞数目少,容易分化;时间太晚,ICM分化成大而多层的卵圆状结构,ICM集落逐渐变小,此时细胞不具有多能性,无法获得ES细胞。本研究在胚胎种植后增殖培养4~6 d时密切观察,ICM隆起致密,呈柱状生长,出现典型的克隆集落时挑取ICM易获得ES细胞,其结果与文献报道一致[6,7]。
3.3 传代方法对昆白小鼠ES细胞分离克隆的影响
昆明小鼠分离克隆胚胎干细胞的效率低,形成的胚胎干细胞集落很不稳定、极易分化[8~10]。研究认为昆明鼠ES传代时不能将集落离散的太小,小集落很难生长和形成新的ES细胞集落,但也不能离散的过大,这样ES细胞会相互诱导,易于分化。传5代前的细胞集落大多数形态上类似于原代集落,呈岛丘状,集落结构紧密,细胞集落边界明显,颜色较深。因5代前ES集落结构紧密细胞数较少,且此时对胰酶极为敏感,因此本研究采取机械分离将ES细胞集落离散成4~6个细胞的小细胞团,原代克隆分离时每个细胞团含50~100个细胞较为适宜,有利于ES传代。随着不断传代培养ES集落逐渐由岛丘状变为典型的鸟巢状,呈扁平状在培养皿中生长,ES集落数量快速增加,机械分离已不能满足工作需要,因此必须寻找合适的酶浓度和作用时间以保证既能将ES集落消化为合适大小的细胞团,又不致造成大多数细胞分化及损伤。小鼠ES细胞对消化液很敏感,常用的消化酶是胰蛋白酶,传代时消化液作用时间过长、浓度过大都会损伤细胞,使ES细胞细胞受伤致死或核型不稳定;而消化时间过短、消化液浓度过低,ES细胞难以离散,大的细胞团块接种后集落中已分化细胞会诱发ES细胞分化,严重影响了胚胎干细胞的扩增。本研究ES细胞集落传5代后采用0.25胰酶+0.02 EDTA在37℃条件下处理集落2~3 min,效果较好。研究表明采用机械化与胰酶消化相结合的方式化对干细胞集落进行消化传代效果好于用单一的胰酶消化传代[11,12]。有研究认为酶在胚胎干细胞传代时可能会影响了ES细胞的体外自我更新的信号通路,进而导致其分化[13]。但胰酶究竟是如何影响ES细胞的体外自我更新,其机制还有待于进一步探讨。
1 Evans MJ,Kaufman MH.Establishment in culture of pluripotential cells from mouse embryos[J].Nature,1981,292(5819):154-156.
2 Silva J,Smith A.Capturing pluripotency[J].Cell,2008,132(4):532-536.
3 Solter D,Knowles B.Immunosurgery of mouse blastocyte[J].Proc Nat Acad Sci USA,l975,72(12):5099-5102.
4 Fleming TP,Javed Q,Hay M.Epithelial differentiation and intercellular junction formation in the mouse early embryo[J].Development,1992,Supp:105-112.
5 Bongso A,Fong CY,NgSY,et al.Isolation and culture of inner cell mass cells from human blastoeysts[J].Hum Reprod,1994,9(11):2110-2117.
6 盂国良,汤富酬,尚克刚,等.5个品系小鼠胚胎干细胞建立的方法学比较[J].遗传学报,2003,30(10):933-942.
7 戢开丽,仇恒滨,严为巧,等.昆明小鼠胚胎干细胞建系的初步研究[J].广西农业生物科学,2008,27(4);329-334.
8 白莹敏,李跃民,邱小燕,等.昆明系小鼠胚胎干细胞分离培养的优化[J].中国兽医学报,2010,30(3):375-378.
9 田海清,蔡霞,腊晓琳,等.昆明小鼠胚胎干细胞最佳分离方法及培养液选择[J].中国组织工程研究与临床康复,2010,14(49):9230-9234.
10 陈明玉.昆明种小鼠胚胎干细胞的分离、培养与鉴定[J].临床和实验医学杂志,2010,9(7):486-489.
11 崔雯,熊浩,王杏龙.ICR小鼠胚胎干细胞的分离与培养[J].黑龙江畜牧兽医(科技版),2011,2:1-4.
12 周光斌,孟庆勇,丁方荣,等.ICR小鼠胚胎干细胞建系初步研究[J]. 繁殖生理,2012,48(7):19-22.
13 Hirai H,Karian P,Kikyo N.Regulation of embryonic stem cellself-renewal and pluripotency by leukaemia inhibitory factor[J].Biochem J,2011,438(1):11-23.
