响应面分析水酶法提取茶叶籽油工艺优化研究
2013-03-19王晓琴
王晓琴
(华侨大学,厦门 361021)
茶(Camellia sinensisO.Ktze)是山茶属(Camellia)植物,其同属近缘种油茶、山茶花均为油料作物。茶叶籽含油率18%~30%,另含有约10%的茶皂素、丰富的淀粉、蛋白质和可溶性糖,同时含有茶多酚、生育酚(VE)等成分[1-3],我国卫生部 2009年发布第18号公告批准茶叶籽油等7种物品为新资源食品。然而在茶业生产中茶叶籽作为生产废料并未广泛开发,大量资源被焚烧或废弃。我国作为茶叶大国,茶叶籽资源开发经济效益和应用前景不可估量[4]。
水酶法是一种较为先进的油脂提取技术,具有“安全、高效、绿色”等特点,满足食用油生产要求,在菜籽、橄榄、葡萄籽、玉米胚芽、油茶等油料作物上均见开展研究[5-9],尤其在花生、核桃油脂及蛋白综合提取表现出独特的技术优势[10-11]。在油脂提取过程中中性蛋白酶具有减轻乳化程度及避免调节pH影响油脂品质等优势,本试验采用中性蛋白酶对茶叶籽油提取工艺进行探索,并探索废弃液中副产物茶皂素得率,旨在为茶叶籽综合开发提供基础资料及理论依据。
1 材料与方法
1.1 材料与仪器
铁观音茶叶籽:安溪茶叶科学研究所。
中性蛋白酶:北京索莱宝科技有限公司;无水乙醚、硫酸:国际集团化学试剂有限公司;香兰素、香草醛:阿拉丁公司。
DF-Ⅰ集热式磁力搅拌器:江苏省荣华仪器制造有限公司;RE52CS旋蒸蒸发器:上海亚荣生化仪器厂;SHZ-D(Ⅲ)循环水式真空泵:上海贺德实验设备有限公司;Ⅴ-1200型可见分光光度计:上海美谱达仪器有限公司。
1.2 试验方法
1.2.1 提取工艺流程
茶叶籽→干燥→去壳→脱衣→粉碎→称量→灭酶→冷却→酶解→二次灭酶→离心→分液

1.2.2 单因素试验
在料液比为1∶4(g∶mL)、酶解温度为 45℃条件下酶解2.5 h,考察1、4、7、10、13 mL酶溶液(0.4%)对出油率的影响,同时对提取工艺副产物茶皂素得率进行测定;
在酶用量7 mL、酶解温度为45℃条件下酶解2.5 h,考察料液比(g∶mL)1∶2、1∶3、1∶4、1∶5及 1∶6对出油率的影响,同时对提取工艺副产物茶皂素进行测定;
在酶用量7 mL、料液比为1:4酶解2.5 h条件下,考察酶解温度 30、37.5、45、52.5、60℃(因仪器条件限制,试验设计中温度涉及小数均在操作过程中依据四舍五入原则取整处理)对出油率的影响,同时对提取工艺副产物茶皂素进行测定。
在酶用量7 mL、料液比为1∶4、酶解温度为45℃条件下,考察酶解时间 0.5、1.5、2.5、3.5、4.5 h对出油率的影响,同时对提取工艺副产物茶皂素进行测定。
1.2.3 中心组合试验
根据Box-Behnken中心组合试验设计原理,在单因素试验基础上,确定中心组合试验因素与水平,见表1。
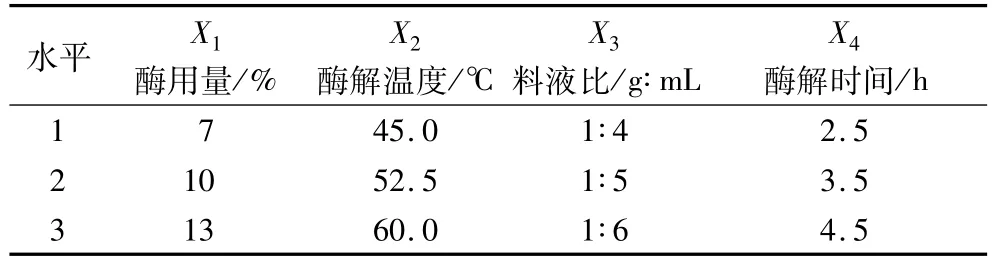
表1 试验因素水平及编码
1.2.4 测定方法

茶皂素测定采用香草醛一硫酸法[12]。
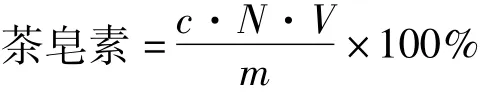
式中:c为通过标准曲线由吸光度计算出此时茶皂素的浓度/mol/L;V为测定时吸取的体积数;N为稀释倍数;m为被测样品质量/g。
1.2.5 数据分析
采用软件Excel 2007和Design Expert 7.0。
2 结果与讨论
2.1 酶用量对茶叶籽油及其茶皂素得率的影响
中性蛋白酶可降解脂蛋白,从而将油脂从复合体中释放出来[8]。图1表明随着酶用量的增加,油得率也随之增加。添加10 mL酶溶液时油得率达到最大值为21.6%,此时油脂提取率达到70.57%,继续增大酶使用量出油率略微减小;对于茶皂素的浸出,添加1~10 mL酶溶液茶皂素浸出量随酶量增加而增加,当酶量为底物的10 mL时达到峰值5.7%,但在整个范围里茶皂素的浸出量变化不大。可见添加10 mL酶溶液是中性蛋白酶提取油脂最适酶用量。
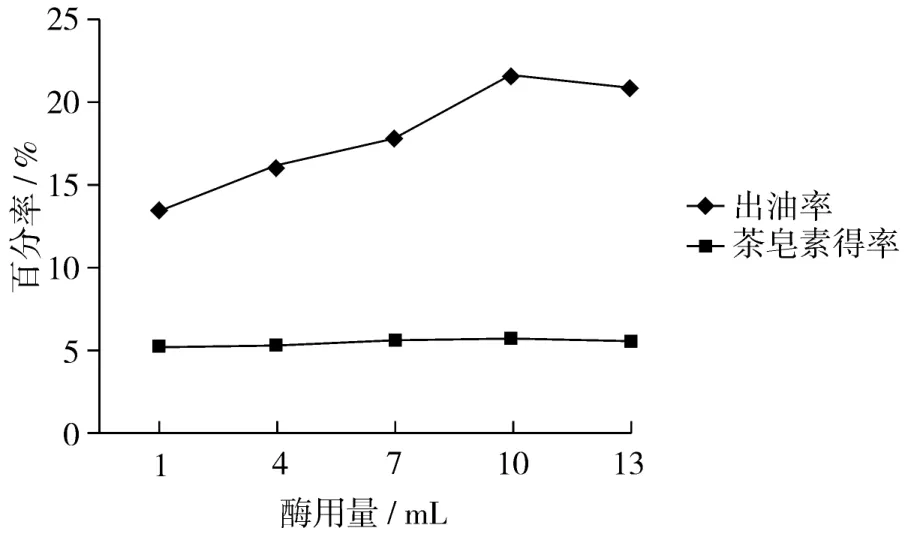
图1 酶用量对出油率和茶皂素浸出量的影响
2.2 酶解温度对茶叶籽油及茶皂素得率的影响
温度是影响酶促反应速率的主要因素,在一定温度范围内随着温度升高物质活化能增大,酶促反应加快;温度过高可能导致酶活性下降甚至失活[13]。由图2可知:在30℃至52.5℃的范围里,随着温度升高油得率增大,反应温度为52.5℃时茶叶籽油得率达到峰值,此时油得率达到了22.6%,之后随着反应温度进一步加大油得率下降;而对于茶皂素在此研究条件下,随着温度升高浸出量不断增大,温度对其溶解度的正向影响可能是原因之一。由此可得,水酶法提取茶叶籽油最适温度是52.5℃;对于茶皂素的浸出研究,此试验没有峰值,在此试验研究条件下茶皂素的浸出量随着温度的增大而增大。
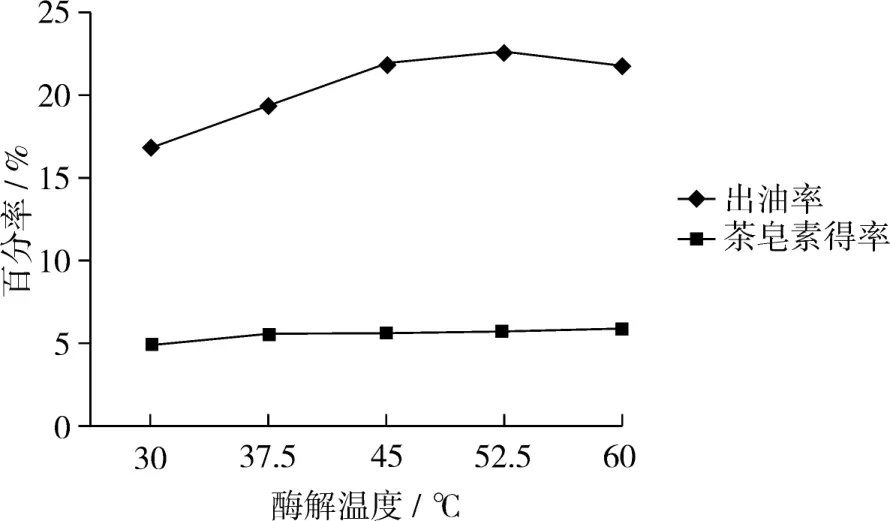
图2 酶解温度对出油率和茶皂素浸出量的影响
2.3 料液比对茶叶籽油及茶皂素得率的影响
料液比通过影响酶与底物接触机会来调节反应速度[13],对出油率和茶皂素得率影响见图3。随着料液比增大油得率逐渐增大,当料液比达到1∶5油得率最高,此时出油率达到22.0%,之后随着料液比进一步加大,油得率下降;在1∶2至1∶6范围内,随着料液比增大可能促进溶解度增大,茶皂素得率从而一直保持增大趋势。可见,茶叶籽油提取最适料液比为1∶5;对于茶皂素的浸出研究,若要得到更大的浸出量,则应该考虑进一步加大料液比。
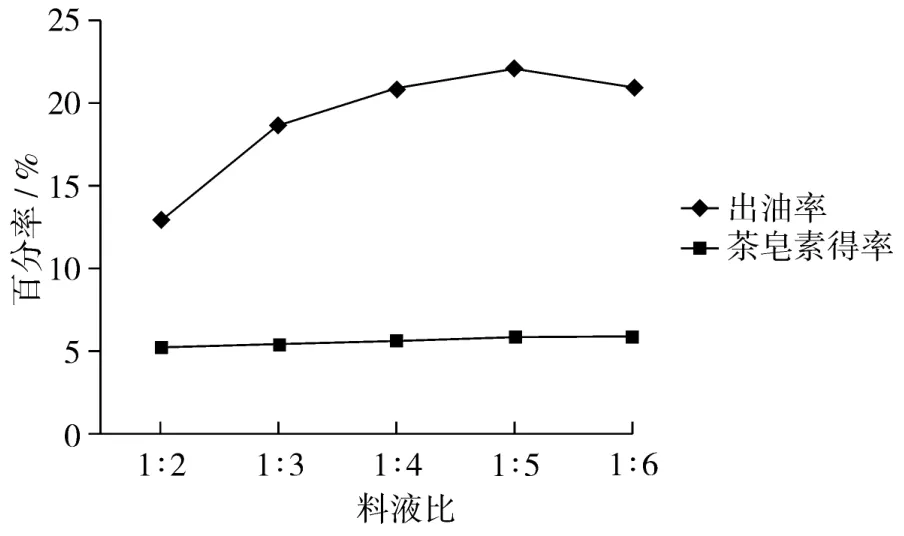
图3 料液比对油得率和茶皂素得率的影响
2.4 酶解时间对茶叶籽油及茶皂素得率的影响
从图4可见,酶解时间0.5~3.5 h内,随着时间延长酶促反应较为充分,油得率逐渐增加;在3.5 h时出油率最高,出油率达到21.5%;3.5 h后继续延长反应时间油得率逐渐降低,而茶皂素得率随着时间延长增加。因此,提取茶叶籽油最适反应时间为3.5 h,对于茶皂素提取研究此试验没有峰值,所以还需进一步延长时间才能达到较大的茶皂素浸出量。
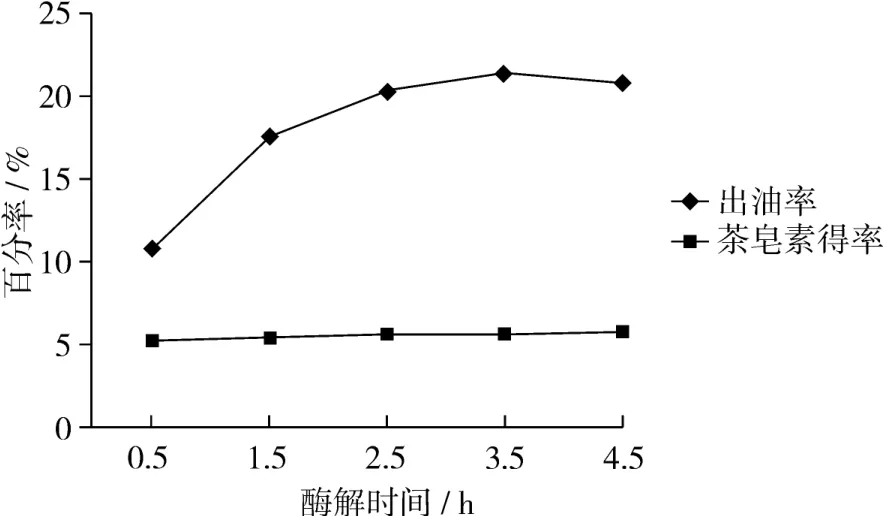
图4 时间对出油率和茶皂素浸出量的影响
2.5 响应面分析方案及结果
利用Design Expert软件对表2中试验数据进行回归分析,得二次多元回归模型方程:Y=-65.950+3.011X1+1.522X2+10.167X3+5.685X4+0.167X1X3-0.108X1X4+0.043 3X2X4-0.300X3X4-0.166X12-0.0157X22-1.059X32-0.797X42,模拟的可靠性可通过方差分析及相关系数来考察,见表3。
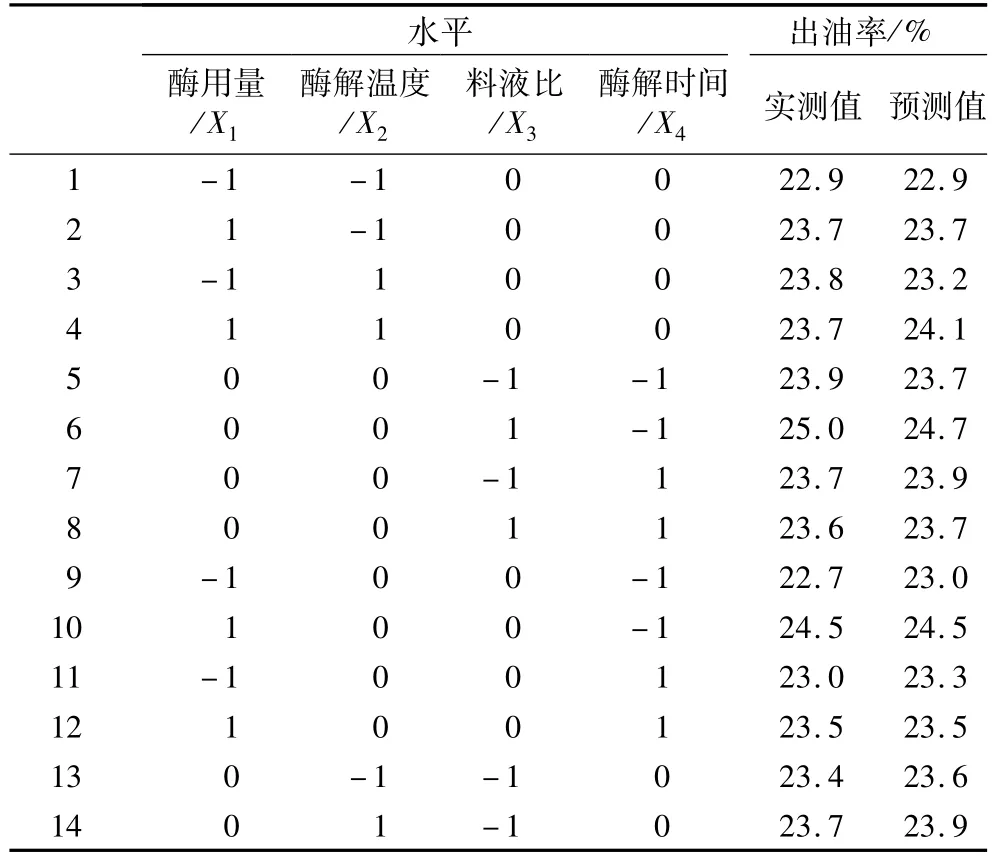
表2 水酶法提取茶叶籽油响应面分析方案及结果
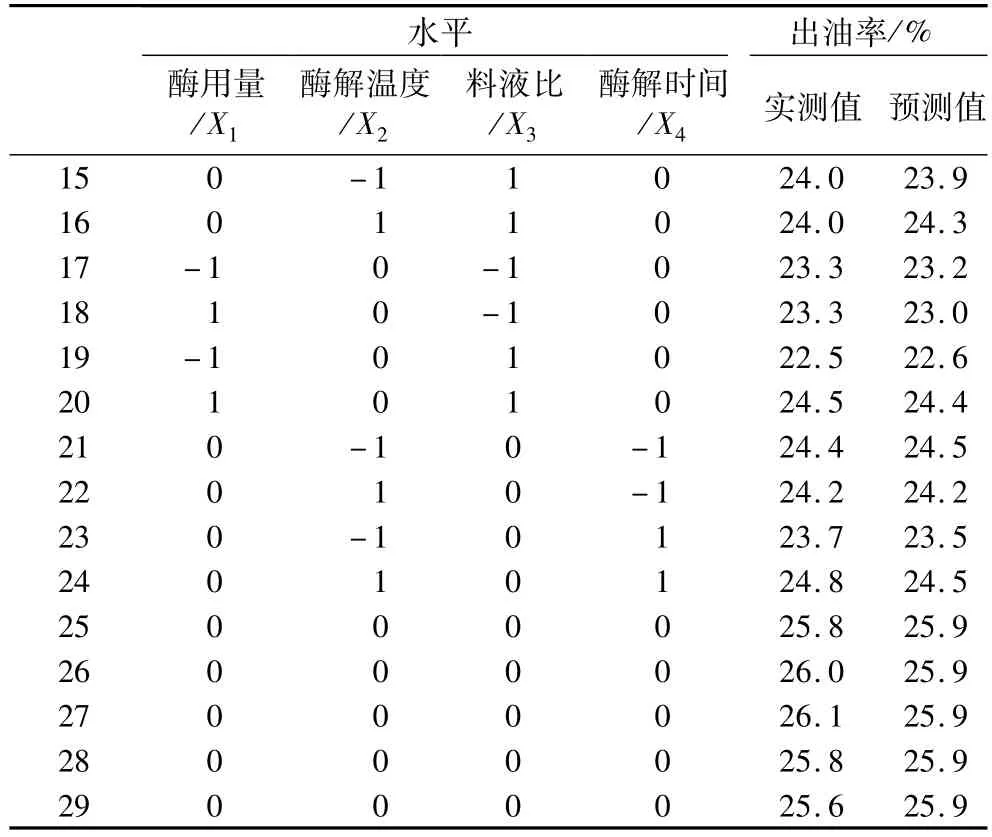
续表
表3为回归分析结果,当“P>F”值小于0.05时,即表示该项指标显著。从结果可以看出:F回归=25.46,P<0.000 1,表明二次多元回归模型极其显著;F失拟=2.71,失拟项P=0.174 1>0.05,表明模拟失拟度不显著;并且该模型的调整确定系数R2=0.950 2,说明该模型能解释95.02%响应值的变化,因而该模型拟合程度比较好,试验误差小。因此,可以用此模型对茶叶籽油提取工艺进行分析和预测。一次项X1、交叉项X1X3、及二次项对茶籽油提取率的曲面效应极为显著,X1X4、X2X4显著,说明它们对响应值影响极大,且所考察因素对响应值影响不是简单的一次线性关系。

表3 回归系数取值及分析结果
为了进一步验证最佳点的取值,对回归方程取一阶偏导等于零数并整理得:
0=3.011+0.167X3-0.108X4-0.332X1
0=1.522+0.043 3X4-0.031X2
0=10.167+0.167X-0.300X-2.118X2143
0=5.685-0.108X1+0.043X2-0.300X3-1.593X4
求解方程得到最佳优化提取条件:酶量10.83 mL,温度52.96℃,料液比1∶5.19,反应时间3.30 h,由回归方程预测在此条件下茶籽油得率的理论值为25.926%。结合试验条件采用酶量10.83 mL、温度53℃、料液比1∶5.19、反应时间 3.30 h开展验证试验,茶叶籽油得率分别为 26.075%、26.094%、25.990%,平均值为26.053%,与理论预测值接近且相对误差仅为0.5%,表明此模型对茶叶籽油提取条件参数优化可行。单因素试验表明油脂提取废弃液可用于开发茶皂素,但由于二者最优工艺不一致,中心复合试验仅考察出油率。
3 讨论与结论
本研究采用中性蛋白酶开展茶叶籽油提取研究,建立了油得率与工艺条件参数间的数学模型:Y=-65.950+3.011X1+1.522X2+10.167X3+5.685X4+0.167X1X3-0.108X1X4+0.043 3X2X4-0.300X3X4-0.166X12-0.0157X22-1.059X32-0.797X42,优化工艺条件结果为酶量10.83 mL、温度53℃、料液比1∶5.19、反应时间 3.30 h,出油率可达26.083%,为科学开展复合酶后续研究奠定了基础。另外,本文揭示油脂提取废液可用于开发副产物茶皂素,为茶叶籽综合开发提供了新思路。
中性蛋白酶通过降解肽键将油脂从蛋白质束缚中解放出来,实现油脂提取效果。茶籽中蛋白质具有乳化作用,在油脂提取过程中阻碍了油水两相分离,降低了油脂提取率。中性蛋白酶降解蛋白质,具有一定破乳效果,与果胶酶等水解酶相比,油脂提取过程中乳化现象得到缓解,另外具有成本较低、免调pH等优势,在水酶法提取油脂中具有较大的应用潜力。
志谢:在本试验工作中,刘庆伟、林克利同学付出了大量的努力,在此一并致谢!
[1]王晓琴.水酶法提取茶叶籽油及副产物茶皂素工艺研究[J].中国粮油学报,2011,26(11):78-82
[2]张伟敏,魏静,钟耕茶.茶叶籽与其他油料作物油脂理化与功能性质的比较[J].中国食品添加剂,2007,30(2):145-149
[3]Guo H,Zhou JP,Luo JW.Determination of the composition of fatty acids from tea seed oil[J].Journal of Zhejiang University(Agric.&Life Sci.),2010,36(2):212-220
[4]曾益坤.茶叶籽制油及综合开发利用[J].中国油脂,2006,31(1):69-71
[5]章绍兵,王璋.水酶法提取菜籽乳化油的工艺研究[J].农业工程学报,2006,22(11):250-253
[6]王素梅.玉米胚芽酶法提油工艺及其机理研究[D].江苏无锡:江南大学,2003
[7]Aliakbarian B,Faveri DD.Optimisation of olive oil extraction by means of enzyme processing aids using response surface methodology[J].Biochemical Engineering Journal,2008,41(2):34-40
[8]Szydlowska-Czerniak A.Effect of enzymatic and hydrothermal treatments of rapeseeds on quality of the pressed rapeseed oils:partⅡ.Oil yield and oxidative stability[J].Process Biochemistry 2010,45(2):247-258
[9]王超,方柔,仲山民,等.水酶法提取山茶油的工艺研究[J].食品工业科技,2006,22(11):267-270
[10]史双枝,刘忆冬,李疆,等.水酶法同时提取核桃仁油脂及水解蛋白的工艺研究.中国食品添加剂,2010,25(1)131-135
[11]江利华,华娣,王璋,等.水酶法从花生中提取油与水解蛋白的中试研究.食品与发酵工业,2009,35(9):147-150
[12]傅春玲,洪奇华,阮辉,等.茶皂素定蕈测定方法的研究[J].杭州大学学报,1997,24(3):239-241
[13]郑穗平,郭勇,潘力.酶学[M].北京:科学出版社.2009:144-145.
