山茶油中茶皂素的分离及其性能分析
2017-12-11李欣蓉王承明华中农业大学食品科技学院武汉430070
张 瑶,李欣蓉,王承明(华中农业大学 食品科技学院,武汉 430070)
综合利用
山茶油中茶皂素的分离及其性能分析
张 瑶,李欣蓉,王承明
(华中农业大学 食品科技学院,武汉 430070)
从山茶油中分离出茶皂素,采用单因素实验和响应面实验对提取工艺进行优化,同时对提取的茶皂素性能进行分析,并与粕中茶皂素进行对比。结果表明,茶皂素最优提取工艺条件为:以无水乙醇为提取剂,液料比11∶1,提取时间1.25 h,提取温度60℃。在最优条件下,茶皂素的提取率为(82.50±0.03)%。经红外光谱分析,油中茶皂素结构与粕中茶皂素结构存在一些差异,且油中茶皂素的起泡性、泡沫稳定性和表面活性均强于粕中茶皂素。
山茶油;茶籽粕;茶皂素;分离;性能
茶皂素是一类齐墩果烷型五环三萜类皂苷的混合物[1],具有良好的表面活性和生物活性[2-5],在日化、医药、食品、建材和农药等行业具有广泛的应用[6-7]。茶皂素主要存在于山茶科山茶属植物的种子中[8],本实验室前期发现,茶皂素不仅可从茶籽粕中分离,而且在山茶油中也有检出。由于茶籽粕的水溶性更好,而山茶油的脂溶性更好[9],故推测油中和粕中茶皂素的结构和性质可能不同。目前从茶籽粕中分离茶皂素已有大量研究[10-13],而从山茶油中分离茶皂素的研究鲜有报道。
本文旨在从山茶油中分离茶皂素,利用响应面法获得最优提取条件,并通过傅里叶红外光谱进行定性,同时评价其起泡性、泡沫稳定性和表面活性,为油中茶皂素的进一步应用提供理论基础。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
茶皂素标准品(纯度96%),上海紫一试剂有限公司;山茶油(成品)、茶籽粕,德兴市源森红花茶油有限公司;香草醛、甲醇、正丙醇、乙二醇、无水乙醇、α-萘酚、醋酐、溴化钾、浓硫酸、氢氧化钠,均为分析纯。
1.1.2 仪器与设备
722型可见分光光度计;HH.S11-2型数显电热恒温水浴锅;DF-101S集热式恒温加热磁力搅拌器;AL204电子分析天平;DHG-9070A型电热恒温干燥箱;SHB-Ⅲ型循环水式真空泵;FJ200-SH数显高速分散均质机;Nicolet Nexus FT-IR傅里叶变换红外光谱仪,美国Thermo;320-S pH计;K100表面界面张力仪,德国KRUSS;204F1差示扫描量热仪,德国耐驰仪器制造有限公司。
1.2 实验方法
1.2.1 茶皂素含量的测定
参照文献[14]采用香草醛-硫酸比色法测定茶皂素的含量。绘制的线性回归方程为:y=0.858 9x-0.003 2,R2=0.997 9。
1.2.2 茶皂素的提取
茶籽粕中茶皂素的提取工艺:按陈莹[13]方法提取。
油中茶皂素的提取:取适量山茶油于锥形瓶中,加入一定量的提取剂,并在一定温度下磁力搅拌一定时间,离心后收集上清液,浓缩,采用香草醛-硫酸比色法进行定量分析。提取率(Y)的计算公式如下:
Y=m1/m2×100%
式中:m1为提取溶液中茶皂素的质量;m2为山茶油中茶皂素的质量,测得山茶油中茶皂素的含量为3.2%。
1.2.3 提取方法的优化
采用单因素实验考察了溶剂体积分数、液料比、提取时间和提取温度对茶皂素提取率的影响,确定各因素的最优参数。恒定参数设置为:溶剂体积分数100%,液料比10∶1,提取时间1 h,提取温度50℃。在此基础上,采用响应面实验设计进行参数优化。
1.2.4 茶皂素的纯化
参照文献[15]采用化学沉淀-释放法纯化茶皂素。
1.2.5 茶皂素的初步定性
采用差示扫描量热仪和傅里叶变换红外光谱仪对提取的茶皂素进行初步定性。
1.2.6 茶皂素的性能测定
采用Waring-Blender搅拌法进行茶皂素泡沫性质的测定[16],搅拌速度6 500 r/min,搅拌时间5 min。采用表面界面张力仪进行茶皂素表面张力的测定。
2 结果与讨论
2.1 提取剂的筛选
本实验拟比较甲醇、蒸馏水、无水乙醇、乙二醇、正丙醇作为提取剂对山茶油中茶皂素提取率的影响,但由于甲醇具有一定的毒性,因此排除甲醇作为提取剂。准确移取4份10 mL山茶油于100 mL锥形瓶中,分别加入蒸馏水、无水乙醇、乙二醇、正丙醇各40 mL于60℃恒温浸提2 h后负压浓缩,以茶皂素提取率为指标,比较各提取剂对茶皂素的提取效果。
在实验过程中,由于正丙醇同显色剂反应,为了避免错误,因此排除正丙醇作为茶皂素的提取剂。实验结果表明,无水乙醇作为提取剂时茶皂素的提取率(56.72%)明显高于使用蒸馏水或乙二醇得到的结果(分别为0.79%和1.22%)。因此,本实验选用无水乙醇作为提取剂。
2.2 单因素实验(见图1~图4)

图1 乙醇体积分数对茶皂素提取率的影响
由图1可知,茶皂素的提取率受乙醇体积分数的影响较大,随着乙醇体积分数的增加,提取率显著增加。因此,选择乙醇体积分数为100%。

图2 液料比对茶皂素提取率的影响
由图2可知,在液料比1∶1~10∶1范围内,随着液料比的增加,茶皂素提取率呈线性增加,这是因为样品在溶剂中的分散程度增加,接触面积增大。在较低液料比时,样品没有完全分散开来,未在溶剂中充分释放茶皂素。在较高液料比时,样品在溶剂中分散较开并充分释放茶皂素。在液料比10∶1~13∶1 时,提取率略有下降。因此,选择10∶1作为最优液料比。
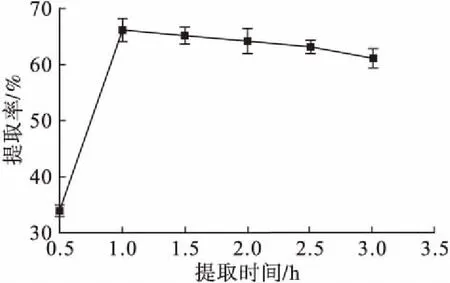
图3 提取时间对茶皂素提取率的影响
由图3可知,随着提取时间从0.5 h延长到1 h,提取率显著增加。大部分茶皂素在前1 h已被提取出来。1 h后,杂质被更多地提取出来,造成茶皂素提取率下降。因此,选择1 h作为最优提取时间。
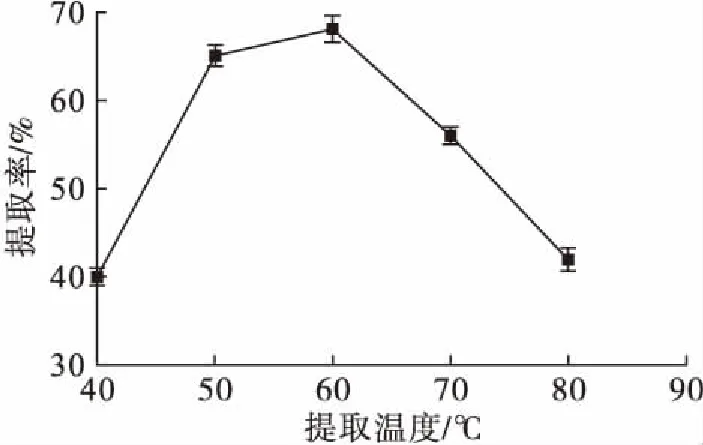
图4 提取温度对茶皂素提取率的影响
由图4可知,在40~60℃范围内,随着提取温度的升高提取率增加。因为随着温度的升高,分子运动增加,样品更容易分散在溶剂中。此外,在较高温度下,溶剂的溶解能力增加,这都有利于茶皂素的提取。在60~80℃范围内,随着提取温度的升高,提取率逐渐下降,这可能是因为较高的温度会破坏茶皂素的结构或使其变性。因此,选择60℃作为最优提取温度。
2.3 响应面优化实验
根据单因素实验结果,选择无水乙醇作为提取剂。以液料比(A)、提取温度(B)、提取时间(C)为因素,茶皂素提取率(Y)为响应值,根据Box-Behnken中心组合实验设计原理设计三因素三水平的实验方案优化提取工艺,响应面实验设计及结果见表1。
通过软件Design-Expert 8.0对表1中的数据进行多元拟合处理,得到茶皂素提取率对各因素的模型方程为:
Y=79.788 00+6.625 00A-1.121 25B+5.711 25C+2.582 50AB-1.832 50AC+1.365 00BC-6.541 50A2-9.804 00B2-4.974 00C2
对该模型进行方差分析,结果见表2。
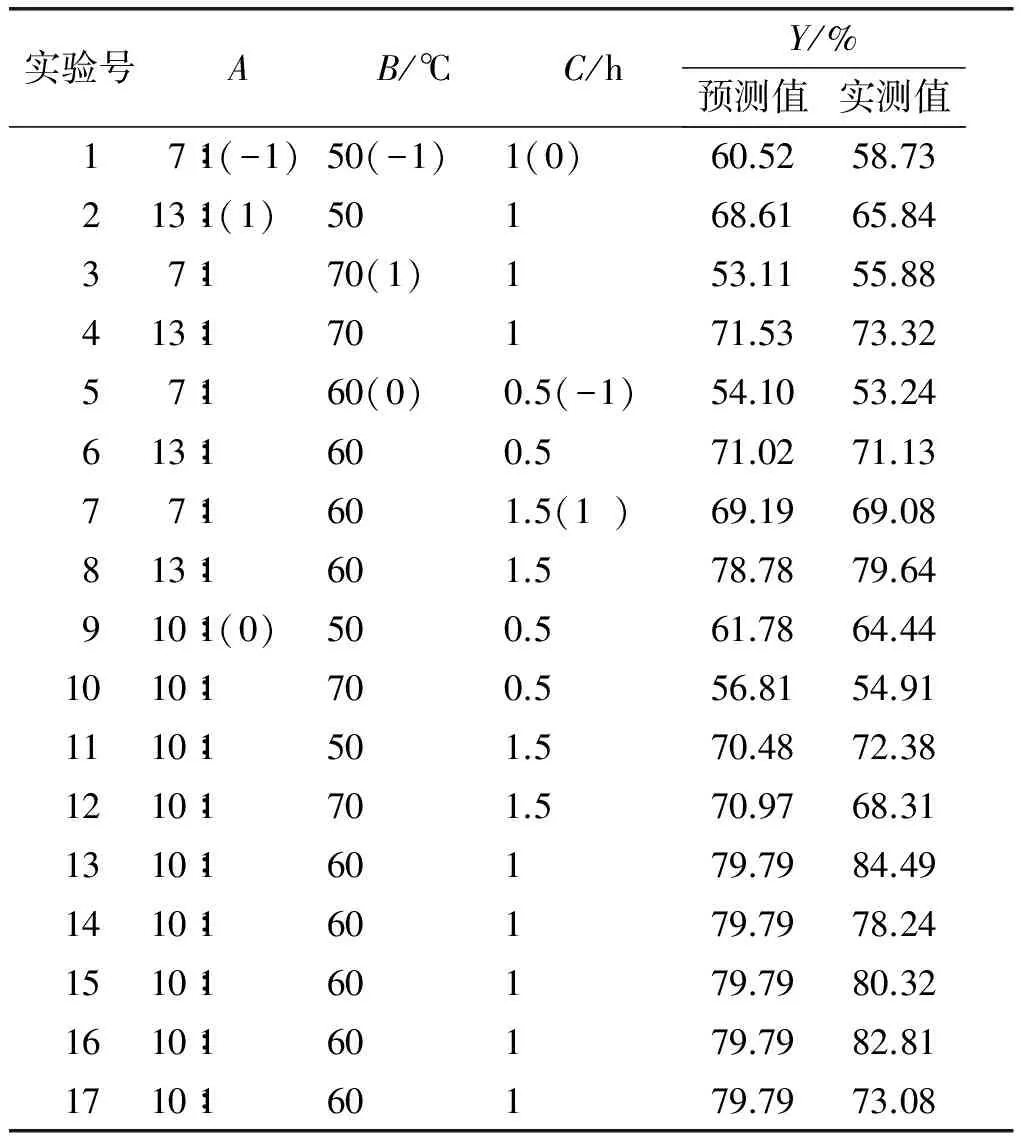
表1 响应面实验设计及结果

表2 方差分析

通过回归分析预测最优条件为液料比11.33∶1、提取温度60℃、提取时间1.25 h,茶皂素提取率的预测值为82.82%。为了方便操作,将最优条件修正为:液料比11∶1,提取温度60℃,提取时间1.25 h。茶皂素提取率的实测值为(82.50±0.03)%,与预测值无显著性差异。
对提取的茶皂素进行纯化,测得最终茶皂素的纯度为91.12%。
2.4 初步定性分析
精确称取3.39 mg制得的茶皂素,采用差示扫描量热仪进行分析。分析条件:以N2为保护气,程序设定为初始温度30℃,升温速率为10℃/min,终止温度为300℃。结果表明茶皂素吸热熔融峰值约为224℃,与报道的茶皂素熔点223~224℃[17]几乎一致。
通过傅里叶红外光谱对提取的茶皂素和茶皂素标准品进行比较分析(见图5)发现,与茶皂素标准品一样,样品在1 500~1 200 cm-1范围内有中强的阶梯峰证明了糖苷类物质的存在,在1 720~1 600 cm-1处有吸收峰,为羰基的伸缩振动峰。判断该物质为茶皂素。与粕中茶皂素的红外光谱图比较发现,在1 720~1 600 cm-1处油中茶皂素的振幅不大,峰形不明显;粕中茶皂素在此范围内有1个较明显的峰,说明油中茶皂素结构中羰基含量比粕中茶皂素的低,油中茶皂素结构稍异于粕中茶皂素结构。
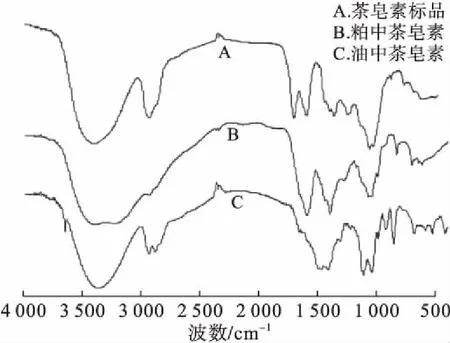
图5 茶皂素的红外光谱图
2.5 起泡性和泡沫稳定性(见图6、图7)
由图6可知,不同质量分数下油中茶皂素的起泡性稍强于粕中茶皂素的起泡性。由图7可知,不同质量分数下油中茶皂素的泡沫半衰期比粕中茶皂素的长,说明油中茶皂素的泡沫稳定性较好。
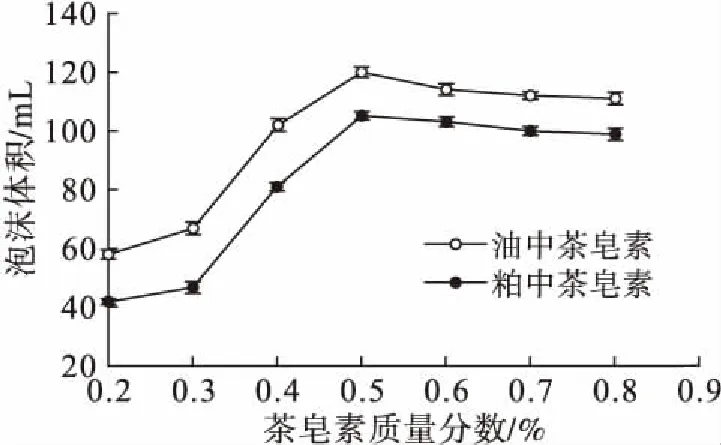
图6 两种茶皂素的起泡性
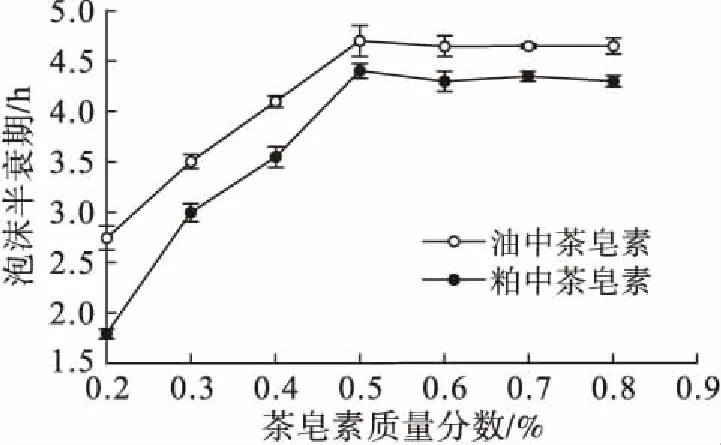
图7 两种茶皂素的泡沫稳定性
2.6 表面活性的测定(见图8)

图8 两种茶皂素的表面张力
由图8可知,油中茶皂素与粕中茶皂素的表面张力都随浓度的增加而减小,当浓度达到一定值后,其表面张力趋于稳定。油中茶皂素的临界胶束浓度为0.43%,最小表面张力为38.34 mN/m。粕中茶皂素的临界胶束浓度为0.47%,最小表面张力为43.69 mN/m。油中茶皂素的最小表面张力稍低于粕中茶皂素的最小表面张力,说明油中茶皂素的表面活性比粕中茶皂素的强。
3 结 论
(1)采用溶剂提取法提取山茶油中的茶皂素,得到茶皂素的最优提取条件为:以无水乙醇为提取剂,液料比11∶1,提取时间1.25 h,提取温度60℃。在最优条件下,所得茶皂素提取率为(82.50±0.03)%。
(2)对提取纯化的茶皂素进行初步定性,证实了茶皂素的存在。测得油中茶皂素的熔点为224℃,符合茶皂素的熔点范围。油中茶皂素的傅里叶红外光谱峰形不如粕中茶皂素的峰形明显,说明油中茶皂素结构有异于粕中茶皂素结构。油中茶皂素的起泡性和泡沫稳定性均强于粕中茶皂素的起泡性和泡沫稳定性;油中茶皂素的临界胶束浓度为0.43%,最小表面张力为38.34 mN/m,粕中茶皂素的临界胶束浓度为0.47%,最小表面张力为43.69 mN/m,油中茶皂素的表面活性稍强于粕中茶皂素的表面活性。
[1] 黄浦. 混菌液态发酵降解茶皂素的试验研究[D]. 广西 桂林: 桂林理工大学, 2016.
[2] FENG J, CHEN Y, LIU X, et al. Efficient improvement of surface activity of tea saponin through Ge mini-like modification by straight forward esterification[J]. Food Chem, 2015, 171: 272-279.
[3] YANG X P, ZHANG H Q. Synergistic interaction of tea saponin with mancozeb againstPestalotiopsistheae[J]. Crop Prot, 2012, 40(5): 126-131.
[4] ZONG J F, WANG R L, BAO G H, et al. Novel triterpenoid saponins from residual seed cake ofCamelliaoleiferaAbel. show anti-proliferative activity against tumor cells[J]. Fitoterapia, 2015, 104:7-13.
[5] LI S X, MU Y, ZHENG F Y. Influence of gastrointestinal digestion and edible plant combination on oral bioavailability of triterpene saponins, using a biomimetic digestion and absorption system and determination by HPLC[J]. J Agric Food Chem, 2013, 61(44): 10599-10603.
[6] 王延芳. 油茶皂素及其水解产物的分离及降血脂抗氧化活性研究[D]. 广州:华南理工大学, 2012.
[7] 卢雯静. 茶树花中茶皂素和茶多酚的综合提取、分离纯化及抑菌性研究[D]. 合肥:安徽农业大学, 2012.
[8] 张新富. 油茶皂苷分离纯化及生物活性研究[D]. 合肥:安徽农业大学, 2013.
[9] ZHANG W G, ZHANG D C, CHEN X Y. A novel process for extraction of tea oil fromCamelliaoleiferaseed kernels by combination of microwave puffing and aqueous enzymatic oil extraction[J]. Eur J Lipid Sci Technol, 2012, 114(3): 352-356.
[10] YAN J, WU Z, ZHAO Y, et al. Separation of tea saponin by two-stage foam fractionation[J]. Sep Purif Technol, 2011, 80(2): 300-305.
[11] WOJCIECHOWSKI K. Surface activity of saponin fromQuillajabark at the air/water and oil/water interfaces[J]. Colloids Surf B Biointerf, 2013, 108(8): 95-102.
[12] ZHOU H, WANG C Z, YE J Z, et al. New triterpene saponins from the seed cake ofCamelliaOleiferaand their cytotoxic activity[J]. Phytochem Lett, 2014, 8(1):46-51.
[13] 陈莹. 油茶籽粕皂素的提取纯化及表面活性研究[D]. 杭州:浙江大学, 2012.
[14] 张团结. 油茶籽粕中茶皂素提取及纯化工艺研究[D]. 江西 赣州:江西理工大学, 2015.
[15] 胡小冬. 低界面张力泡沫驱油体系研究与性能评价[D]. 湖北 荆州:长江大学, 2012.
[16] 熊晶晶. 茶皂素印迹聚合物的制备及其在茶皂素粗提物纯化中的应用[D]. 南昌:南昌航空大学, 2014.
Separationofteasaponinfromoil-teacamelliaseedoilanditsperformance
ZHANG Yao, LI Xinrong, WANG Chengming
(College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
Tea saponin was separated from oil-tea camellia seed oil. The extraction process was optimized by single factor experiment and response surface methodology, and the performance of the extracted tea saponin was analyzed and compared with that extracted from oil-tea camellia seed meal. The results showed that the optimal extraction conditions of tea saponin were obtained as follows: with anhydrous ethanol as extractant, ratio of solvent to material 11∶1,extraction time 1.25 h and extraction temperature 60℃. Under the optimal conditions, the extraction rate of tea saponin was (82.50±0.03)%. IR results showed that tea saponins from oil-tea camellia seed oil and oil-tea camellia seed meal had some differences in structure. The foamability, foam stability and surface activity of tea saponin from oil-tea camellia seed oil were better than those of tea saponin from oil-tea camellia seed meal.
oil-tea camellia seed oil; oil-tea camellia seed meal; tea saponin; separation; performance
2017-06-24;
2017-07-27
张 瑶(1993),女,硕士研究生,研究方向为食品营养与安全(E-mail)779737699@qq.com。
王承明,教授(E-mail)18971081261@126.com。
TS201.1;TQ646
A
1003-7969(2017)10-0126-05
