米淀粉为基质的脂肪替代品中麦芽糊精结构研究
2013-03-19杨玉玲陈银基
杨玉玲 游 远 陈银基 马 云
(南京财经大学食品科学与工程学院粮食储运国家工程实验室,南京 210046)
目前世界上有40余种淀粉为基质的脂肪替代品商品,这类脂肪替代品的制备方式通常分为两类。一类是通过对原淀粉进行交联、取代等改性方式制得的,其主要成分是淀粉和改性淀粉;另一类是通过对原淀粉进行轻度水解制得的,主要成分是DE值为2~6的麦芽糊精[1-2]。米或米淀粉为基质的脂肪替代品是利用高温α-淀粉酶对米粉或米淀粉进行轻度水解获到的,其DE值在2~3之间。这种脂肪替代品能模拟脂肪的根本原因在于其最主要成分麦芽糊精能形成特异性凝胶[3-4]。此脂肪替代品的凝胶特性与其结构密切相关。凝胶的网状结构是由直链麦芽糊精与支链麦芽糊精的外链相互作用形成的,如果二者的长度很短,就不能形成凝胶,因此研究脂肪替代品中麦芽糊精分子的结构具有重要意义。麦芽糊精分子的结构参数包括直链麦芽糊精分子的链长,支链麦芽糊精分子的A链与B链的比值、内链长和外链长[5]。支链麦芽糊精分子的A链是指以还原性末端通过α-1,6糖苷键结合到另一条链上而自己不被结合的链;B链是指结合到别的链上,同时又被别的链结合的链;C链是具有一个还原性末端的链。在一个支链麦芽糊精分子中只有一条C链。外链(ECL)是指非还原性末端至最靠近外侧分支点的一段链;内链(ICL)是指相邻两个α-1,6糖苷键为分支点的一段链。
食品体系中常见的凝胶有3种类型,即通过共价交联形成聚合物凝胶、通过微晶形成聚合物凝胶和通过颗粒堆积形成颗粒凝胶。通常认为淀粉凝胶是通过微晶区域起连接作用形成的[6],脂肪替代品中麦芽糊精在组成上与淀粉相同,在结构上与淀粉相似,但链长变短,能否形成微晶结构与其结构参数一样在国内外均未见报导。因此,鉴于米和米淀粉为基质脂肪替代品的制备方法和凝胶特性已有报道[3,7],本试验重点研究米淀粉为基质脂肪替代品中支链糊精的精细结构,并研究脂肪替代品的晶体结构,以期对这类脂肪替代品的质量控制提供参考。
1 材料与方法
1.1 材料与设备
1.1.1 材料
米淀粉(水分13.3%,淀粉 85.9%,脂肪 0.1%,蛋白质0.12%):实验室自制[3];高温 α-淀粉酶:无锡杰能科生物技术有限公司;β-淀粉酶[EC3.2.1.2](Type1-B)、异淀粉酶[EC3.2.1.68]、普鲁兰酶[EC3.2.1.41](Type1-B):Sigma公司;其他试剂均为分析纯。
1.1.2 仪器
QZ-5型高速喷雾干燥机:锡山林洲干燥机厂;YJ501型超级恒温水浴:上海跃进医疗器械厂;Allegra 64 R型高速冷冻离心机:美国贝克曼库尔有限公司;Dmar/ШB型X-射线衍射仪:日本理学公司。
1.2 试验方法
1.2.1 脂肪替代品的制备[3]
米淀粉140 g→调浆→调pH 6.0~6.5→调浆液浓度20%→90℃下糊化→加α-淀粉酶→水解至确定DE值(2、3、4)→灭酶→中和→过滤→喷雾干燥→包装保存。
1.2.2 还原糖含量和总糖含量的测定
还原糖含量用直接滴定法测定,总糖含量用苯酚硫酸法测定[8]。脂肪替代品的DE值为样品中还原糖含量占总糖含量的百分数。
1.2.3 脂肪替代品分子结构参数的测定
1.2.3.1 β-限制糊精的制备[5,9]
称取1.0 g脂肪替代品分散于50 mL浓度为0.02 mol/L,pH 4.8的醋酸缓冲液,加入 β-淀粉酶(5 000 U),液面以2滴甲苯覆盖以防止微生物生长,在37℃下水浴条件下进行酶反应。在反应过程中不断检测体系的还原能力,直到为恒定值时(反应时间需要30 h),将反应液充分煮沸20 min灭酶,加3倍体积的甲醇沉淀,冰浴30 min后离心(6 000 r/min、20 min),弃去上清液,加75%的甲醇反复洗涤至离心后的上清液中不含麦芽糖(需要3次洗涤),再经过冷冻干燥,得β-限制糊精。
1.2.3.2 支链糊精中A链与B链比和内链长度的测定[10-13]
称取β-限制糊精100 mg,以醋酸缓冲液(0.02 mol/L、pH 4.8)溶解并定容至 10 mL,经标定得到其真实浓度为7.652 mg/mL,取一定量的上述溶液,分别用异淀粉酶和普鲁兰酶进行脱支水解后,计算出A链与B链比。
异淀粉酶脱支水解:取100μL上述β-限制糊精溶液,加入适量异淀粉酶和醋酸缓冲液使总体积达到1 mL,37℃水浴中保温水解24 h,煮沸20 min灭酶后测定还原能力,此还原能力与A链和B链脱支产生的还原能力之间符合下列关系:

式中:I为异淀粉酶脱支水解β-限制糊精产生的还原能力,A为A链脱支产生的还原能力,B为B链脱支产生的还原能力。
以普鲁兰酶进行脱支水解:取100μL浓度上述β-限制糊精溶液中加入适量异淀粉酶和醋酸缓冲液使总体积达到1 mL,37℃水浴中保温水解24 h,煮沸20 min灭酶后测定其还原能力,此还原能力与A链和B链还原能力之间的关系符合公式(2);支链麦芽糊精的内链长度(ICL)与β-限制糊精中的总糖含量及普鲁兰酶脱支水解β-限制糊精产生的还原能力之间的关系符合公式(3)。

式中:J为普鲁兰酶脱支水解β-限制糊精产生的还原能力,A为A链脱支产生的还原能力,B为B链脱支产生的还原能力。

式中:ICL为支链麦芽糊精的内链长度,S为β-限制糊精中的总糖含量(以葡萄糖计),J为普鲁兰酶脱支水解β-限制糊精产生的还原能力(以葡萄糖计)。
1.2.3.3 β-淀粉酶水解率的测定[10-13]
取1.0 g脂肪替代品分散于50 mL浓度为0.02 mol/L、pH 4.8的醋酸缓冲液,加入 β-淀粉酶(5 000 U)进行反应(同1.2.3.1)至灭酶,测定体系中的总糖含量与还原能力,同时以不加酶的样品同样处理作为对照,通过公式(4)可以计算β-淀粉酶水解率。

式中:P为脂肪替代品β-淀粉酶的水解率/%,n为体系的还原能力(以葡萄糖计),m为体系的总糖含量(以葡萄糖计)。
1.2.3.4 脂肪替代品中直链麦芽糊精链和支链麦芽糊精外链的平均链长计算

式中:L为平均链长;m为1.0 g脂肪替代品样品中的总糖(以葡萄糖计);P为β-淀粉酶的水解率;C为1.0 g脂肪替代品样品中β-限制糊精经普鲁兰酶水解后提供的还原能力(以葡萄糖计);DE为脂肪替代品样品的DE值。
1.2.4 脂肪替代品的晶体结构测定
用X-射线衍射法进行。测定条件:电压35 kV、电流 20 mA、扫描速率 4°/min、测量范围 2θ=3~53°。
1.3 数据处理
所有试验均为3个样品重复,标准误差等数据用SAS9.3软件分析处理。
2 结果与讨论
2.1 脂肪替代品中支链麦芽糊精分子的精细结构
2.1.1 异淀粉酶的脱支反应
用异淀粉酶对脂肪替代品中的β-限制糊精进行脱支反应,测定水解液的还原能力,结果见表1。
从表1可见,当异淀粉酶用量超过100 U时,体系的还原能力已经达到最高值53.1μg(以葡萄糖计)。

表1 异淀粉酶用量与还原能力
在β-限制糊精α-1,6糖苷键上的葡萄糖单位为2个或3个,从统计学的角度看,残留在β-限制糊精上的具有2个葡萄糖单位的A链片段数目和具3个葡萄糖单位的片段数目相等[10]。异淀粉酶能水解残留在β-限制糊精上具有3个葡萄糖单位的A链片段的α-1,6糖苷键,但不能水解具有2个葡萄糖单位的A链片段的α-1,6糖苷键。因此,在体系水解完全时,异淀粉酶的还原能力在数值上等于A链脱支产生的还原能力的一半与B链脱支产生的还原能力之和。在给定反应时间的条件下,随异淀粉酶用量增加,水解的α-1,6糖苷键数目增加,被释放出的还原端增加,因此体系的还原能力增加,直到β-限制糊精上B链全部脱支,具有3个葡萄糖单位的A链片段也全部脱支,还原能力达到最高值53.1μg(以葡萄糖计)后不再增加,表明体系水解已经完全。
2.1.2 普鲁兰酶的脱支反应
用普鲁兰酶对脂肪替代品中的β-限制糊精进行脱支反应,酶用量与水解液还原能力的关系见表2。
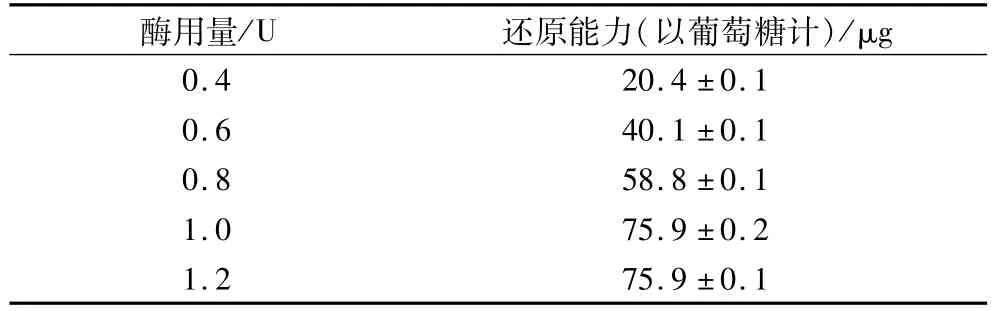
表2 普鲁兰酶用量与还原能力
从表2中可以确定,普鲁兰酶水解β-限制糊精的条件为:酶用量1.2 U,时间24 h。此时体系的最大还原能力为75.9μg(以葡萄糖计)。
普鲁兰酶能水解β-限制糊精上所有α-1,6糖苷键,因此体系水解完全时,普鲁兰酶作用后得到的还原能力为A链和B链脱支产生的还原能力之和[10]。在给定反应时间的条件下,随普鲁兰酶用量增加,水解的α-1,6糖苷键数目增加,体系还原能力也随之增加,当还原能力达到最高值75.9μg(以葡萄糖计)时,表示体系中α-1,6糖苷键全部水解。
2.1.3 支链麦芽糊精分子A链:B链比和内链平均链长
将异淀粉酶水解β-限制糊精后释放的还原能力53.1μg代入公式(1)得公式(6);将普鲁兰酶作用后释放的还原能力75.9μg代入公式(2)得公式(7)。


解上述二元一次方程得出A=45.5μg,B=30.5 μg。
由于一个A链和一个B链脱支时都仅能产生一个还原端,即产生的还原能力相同,因此A链和B链脱支产生的还原能力之比等于A链和B链数量之比,本试验中 A链∶B链等于1.5∶1。
在本试验中0.765 2 mgβ-限制糊精经普鲁兰酶水解后得到的还原糖(以葡萄糖计)为75.9μg,通过公式(3)计算得到支链麦芽糊精分子内链的平均链长为8.2个葡萄糖单位。
Marshell等[10]认为一般支链淀粉的A链与B链比值介于1.5~2.6∶1之间,普通玉米支链淀粉的A链:B链为1.7。杜先锋[14]测定了葛根支链淀粉的结构,其A链∶B链为1.2∶1,内链平均链长为8。敖自华等[15]报道了银杏支链淀粉的 A链∶B链为1.68∶1,内链平均链长为7。米支链淀粉的A链与B链之比在1.3~1.5∶1范围内[16],这与本试验中脂肪替代品中支链糊精A链:B链结果相符。其原因在于当米淀粉水解成脂肪替代品时,由于α-淀粉酶不能水解α-1,6糖苷键,所以支链淀粉和支链糊精中的β-限制糊精结构是一致的,因此只要支链淀粉和支链糊精都来自同一种原料,二者的A链:B链比值和内链平均链长就相同[6]。支链糊精形成凝胶不仅与相对分子质量有关,还与其结构参数如A链与B链的比值、内链长度、外链长度等有关[12]。A链和B链的比值越高则形成凝胶的能力强,在聚合度不变时,内链长度大会导致外链长度不足,凝胶能力变差[16]。
2.1.4 脂肪替代品中直链麦芽糊精链和支链麦芽糊精外链的平均链长
不同DE值的脂肪替代品经β-淀粉酶水解后测定其水解率,并根据公式5分别计算其直链糊精链和支链糊精外链的平均链长,结果见表3。
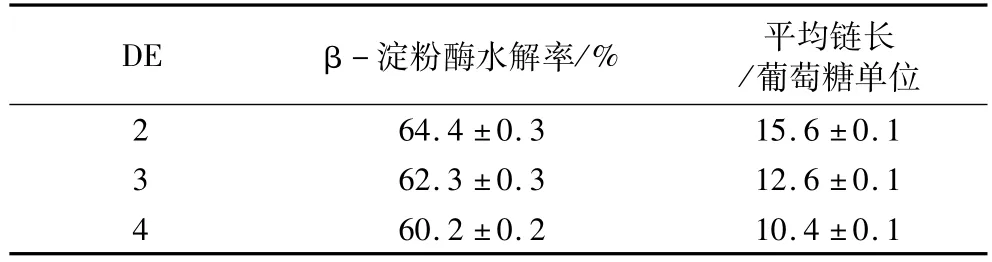
表3 脂肪替代品的DE值与平均链长
从表3可见,脂肪替代品的DE值越高,β-淀粉酶水解率越低。这是因为α-淀粉酶和β-淀粉酶都作用于α-1,4糖苷键,被α-淀粉酶切开的糖苷键不再被β-淀粉酶作用,而产品DE值越高,被α-淀粉酶水解程度越大,因此β-淀粉酶水解率越低。
从表3还可见,随着DE值增加,脂肪替代品中直链麦芽糊精分子链和支链麦芽糊精分子外链的平均链长变短,导致分子间相互缠结、相互作用减少,直接影响着脂肪替代品形成凝胶的能力。米和米淀粉为基质的脂肪替代品DE值在2~3之间,DE4时只能形成很弱的凝胶,不适合作脂肪替代品[4]。因此,米淀粉为基质脂肪替代品的β-淀粉酶水解率为62.3%~64.4%,平均链长为 12.6~15.6个葡萄糖单位。如果链长少于10.4个葡萄糖葡萄糖,则不适合作为脂肪替代品。目前,国内外尚未见此方面的研究报道。
2.2 脂肪替代品的晶体结构
在图1中,米淀粉在17.7°和22.8°处分别出现了强度为5.0和 3.9的衍射峰,为 A型晶体[17-18]。米淀粉为基质脂肪替代品在17.7°处也出现了强度很弱的衍射峰,但22.8°处不存在衍射峰,不属于A型晶体;此外,脂肪替代品在13.2°和20.7°处出现了强度分别为6.70和4.27的衍射峰,这是V型晶体的衍射峰[19],因此脂肪替代品中存在少量的V型晶体(图2)。
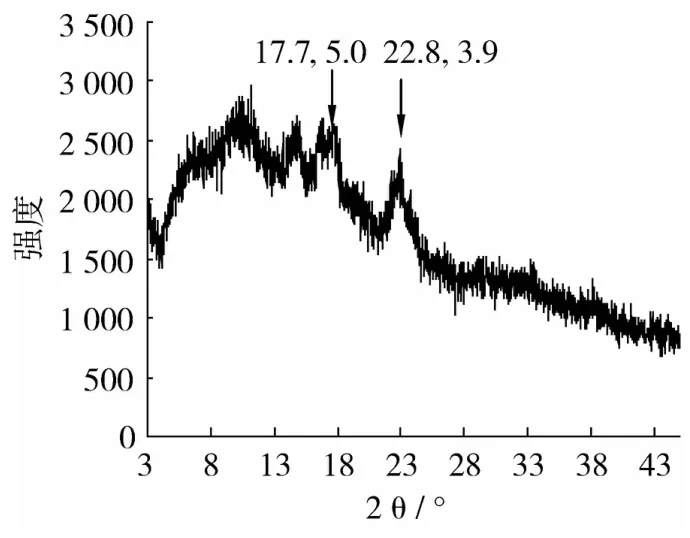
图1 米淀粉的X-射线衍射图

图2 米淀粉为基质脂肪替代品的X-射线衍射图
原料淀粉与脂肪替代品中晶体衍射峰不同说明二者的晶体结构发生了变化。在用米淀粉制备脂肪替代品的过程中,糊化步骤导致了原淀粉中A型晶体消失。并且淀粉糊化后,直链淀粉从淀粉粒中沥出,使脂肪有机会进入直链淀粉螺旋结构内部,并与之形成复合物。这种复合物能形成V型晶体衍射峰[17]。但脂肪替代品制备过程中,糊化的淀粉被轻度水解成麦芽糊精,脂肪替代品中的直链糊精能否有足够的链长形成螺旋结构并使脂肪陷在其中,到目前为止未见报道。但本研究发现脂肪替代品中含有少量V型晶体,说明脂肪替代品中的直链糊精还能形成螺旋结构,并能与脂肪形成晶体,这对脂肪替代品形成凝胶可能是有利的。
3 结论
脂肪替代品中支链麦芽糊精分子的A链∶B链为1.5∶1;支链麦芽糊精分子的内链平均链长为8.2个葡萄糖单位;DE值为2~3的脂肪替代品中直链麦芽糊精分子链和支链麦芽糊精分子外链的平均链长分别为12.6~15.6个葡萄糖单位。脂肪替代品中存在少量的V型晶体。
[1]Alexander R J.Fat Replacers based on starch[J].Cereal foods world,1995,40(5):366-368
[2]Mcpherson A E,Seib PA.Preparation and properties of wheat and corn starch maltodextrins with a low dextrose equivalent[J].Cereal Chemistry,1997,74(4):424-430
[3]Orthoefer F T,Mc D R,Caskill,et al.Rice based fat replacers[J].Food Technology.Europe,1995,2(3)36:38,40
[4]Yang YL,Xu.SY.Roles of Components of Rice-Based Fat Substitute in Gelation[J].Food Research International,2007,40:1155-1160
[5]Takeda Y,Hizukuri S.Structure of branched molecules of amylase of various origins and molar fractions of branched and unbranched molecules[J].Carbohydrate Research,1987,165:139-145
[6]Fennema O R著.食品化学[M].王璋,许时婴,江波,等译.第3版.北京:中国轻工业出版社,2003:105-107
[7]杨玉玲,许时婴,王璋.籼米为基质的脂肪替代品的凝胶性质[J].中国粮油学报,2003,18(5):8-11
[8]张维杰.糖复合物生化研究技术[M]第2版.杭州:浙江大学出版社,1999,8:12-13
[9]Yuan R C,Thompson D B,Boyer CD.Fine Structure of amylopectin in relation to gelatinization and retrogradation behavior of maize starches from threeωχ-containing genotypes intwo inbred lines[J].Cereal Chemistry,1993,70(1):81-89
[10]Marshall J J,Whelan,W J.Multiple branching in glycogen and amylopectin[J].Archives of Biochemistry-chemistry Biophysics,1974,161:234-238
[11]Wang L,Xie B,Shi J.Physicochemical properties and structure of starches from Chinese rice cultivars[J].Food Hydrocolloids,2010,24:208-216
[12]Erander SR.Starch biosynthesisⅡ The statistical model for amyopectin and its precursor plant glycogen[J].Starch,1998,50:275-285
[13]Erander S R.Starch biosynthesisⅢ The glycogen precursorusing phosphorylas in the production of the precursor glycogen[J].Starch,1998,50:319-330
[14]杜先锋.野生食品资源葛根的开发和应用-葛根淀粉的研究[D].无锡:无锡轻工业学院,1999:57-77
[15]敖自华,王璋,许时婴.银杏支链淀粉分子结构的研究[J].食品科学,2000,21(10):15-18
[16]Asaoka M,Okuno K,Fuwa H.Effect of environmental temperature at the milky stage on amylase content and fine structure of amylopectin of waxy and nonwaxy endospern starch of rice(oryza sativa L.)[J].Agri.Biol.Chem.,1985,49:373
[17]Imberty A,Buleon A,Tran V,et al.Recent Advances in knowledge of starch structure[J].Starch,1991,43:375-384
[18]Mathias P M,Bailey K,McEvoy J J,et al.Studies on the amylolytic breakdown of damaged starch in cereal and noncereal flours using high performance liquid chromatography and scanning electron microscopy[M]//Frazier P J.Starch:Structure and functionally.New York:The Royal Society of Chemistry 1997,53-125
[19]Galliard T.Starch:properties and potential[M].New York:The Society of Chemistry Industry,1987,24-88.
