保护剂对胆固醇氧化酶稳定性机理的研究
2013-02-19杨海麟张玉然仝艳军
陈 亦, 辛 瑜, 杨海麟, 张 玲, 张玉然, 仝艳军, 王 武
(江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
胆 固 醇 氧 化 酶 (cholesterol oxidase;COD;EC 1.1.3.6)属于黄素蛋白,能专一催化胆固醇转化为胆甾-4-烯-3-酮,作为检测酶广泛应用于医疗检测领域,是重要的诊断酶制剂。
诊断用酶制剂应用中,酶稳定性是重要因素之一,因此增强诊断用酶稳定性,成为了极为迫切的现实问题。提高酶稳定性方法有蛋白质工程、固定化、添加保护剂等,其中添加保护剂具有方法简单、成本低等优点,已成为一种常用的方法。酶保护剂主要有辅基、蛋白质、多元醇、防腐剂等,其中醇类能提高酶稳定性。Liao Y等[1]使用甘油促使冻干的过氧化氢酶复性,随着甘油浓度上升,过氧化氢酶复性速率加快;Costa等[2]研究多种添加剂对过氧化氢酶的影响,其中甘油和聚乙烯乙二醇能增加其储存稳定性。
作者所在实验室重组菌株E coli BL21(DE3)/pET28a表达的COD稳定性较差,通过研究液态纯酶稳定机理,选择甘油和核黄素两种保护剂,结合光谱法研究保护机理,提供增强酶稳定性的有效方法,对该酶应用具有重要价值,也为其他酶类稳定性提供参考。
1 材料与方法
1.1 实验材料与仪器
1.1.1 菌种来源 重组菌株 E.coli BL21(DE3)/pET28a-COD:作者所在实验室保藏。
1.1.2 主要仪器 电热恒温水浴锅:上海医疗器械五厂制造;蛋白电泳仪:美国BIO-RAD公司制造;F-7000型荧光分光光度仪:日立公司制造;MOS-450 AF-CD圆二色性光谱仪:法国Bio-Logic公司制造。
1.2 实验方法
1.2.1 COD纯酶制备 菌种培养发酵培养见文献[3],酶液亲和纯化见文献[4-5],制备COD纯酶液。
1.2.2 COD酶活测定方法 胆固醇氧化酶测定方法:参见文献[6]。
1.2.3 甘油对COD稳定性影响 6 U/mL(0.15 mg/mL)、pH 7.5的纯酶液分别添加体积分数5%、10%、15%甘油,37℃水浴,定时取样测定其残余酶活,初始酶活为100%,计算酶活保留率(%)。取样测定溶液浊度(OD340nm),同时取样SDS-PAGE和圆二色性光谱分析(扫描范围190~250 nm)。
1.2.4 核黄素对COD稳定性影响 6 U/mL(0.15 mg/mL)、pH 7.5 的纯酶液分别添加 10、20、40 μmol/L核黄素,37℃水浴定时取样,测定残余酶活及浊度,并取样荧光分析。COD激发波长280 nm,发射波长280~400 nm;辅基FAD激发波长460 nm,发射波长460~620 nm。
2 结果与讨论
2.1 胆固醇氧化酶(COD)稳定机理研究
COD最适反应pH为7.5[7],故实验选择37℃、酶浓度6 U/mL、pH 7.5研究酶稳定性,结果见图1。随时间延长酶活降低,45 h降至2.65%;初始酶液澄清透明,但随时间延长,酶分子运动速率加快,分子间碰撞速率增大,酶分子间聚集,溶液浑浊[8]。

图1 存储不同时间对COD酶活及浊度影响Fig.1 Effects of different time on cholesterol oxidase activity and turbidity
COD为单亚基蛋白质,相对分子质量59 000,SDS-PAGE电泳见图2。前4小时未产生多聚体,且目的条带粗细大致相同,说明酶自身未发生降解;而后逐渐出现多聚体条带,可能由于COD高级结构改变,导致分子间发生聚集作用。

图2 不同存储时间的COD SDS-PAGE图Fig.2 Analysis by SDS-PAGE after different time
蛋白质Trp、Tyr、Phe具有荧光性,FAD为 COD辅基,含异咯嗪环,也具荧光性[9]。图3a中COD最大荧光强度随时间延长先增加后减小,前8小时最大荧光强度逐渐增强,主要由于COD内部Trp、Tyr等疏水性基团逐渐暴露,导致荧光强度上升;后期最大荧光强度逐渐降低,可能由于聚集导致一些原本处于单分子表面的Trp、Tyr包裹于聚集体内部,荧光强度降低。
图3b显示辅基FAD荧光图谱,其最大荧光强度和最大发射峰变化均不明显。24 h内FAD荧光强度变化不大,通常COD与FAD结合摩尔比为1∶1,图3中与COD同等摩尔浓度的核黄素(B2)溶液荧光强度明显高于FAD,而且大肠杆菌不能提供充足FAD,且其自身不能进入细胞,只能通过将核黄素运输至胞内,并经浓缩和磷酸化作用转化为辅酶FAD[10],因此推断COD大量表达过程中,由于辅酶FAD合成速度有限,未能完全结合FAD辅基。
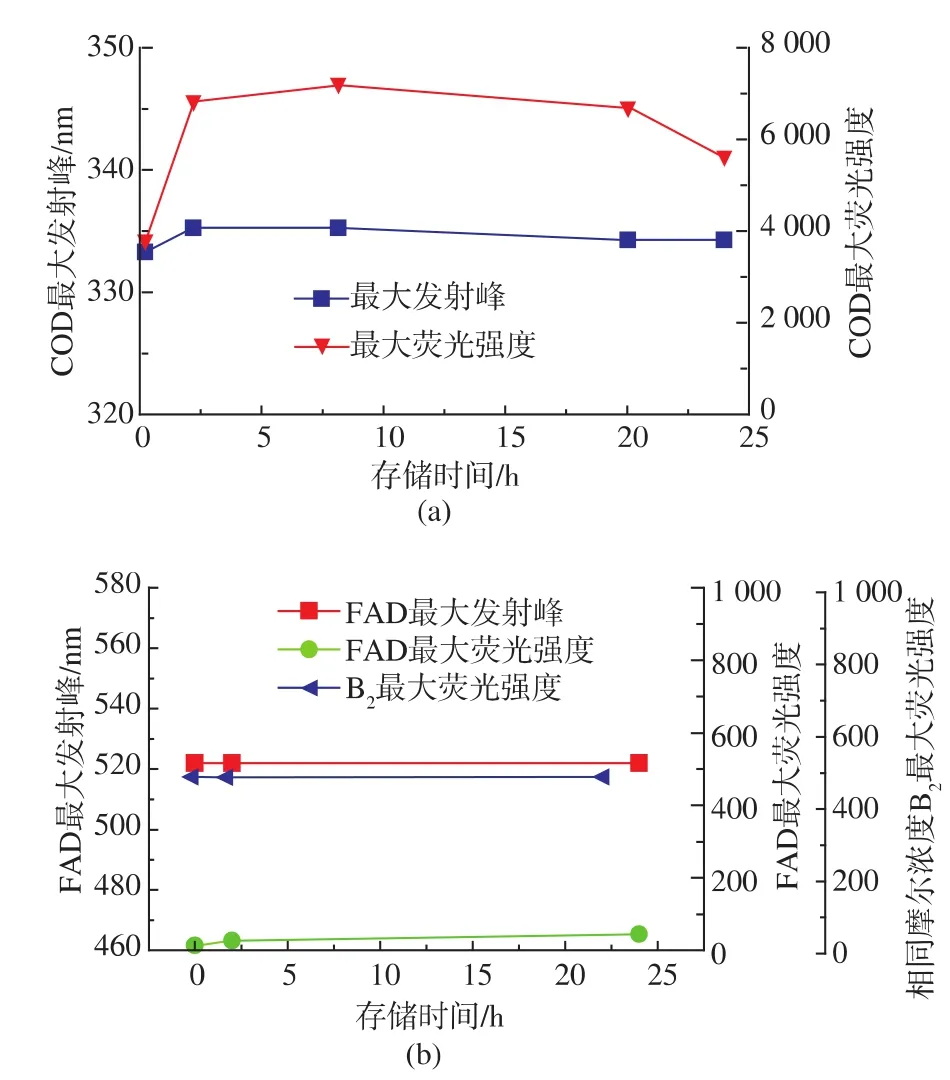
图3 不同存储时间COD和FAD的荧光光谱图Fig.3 Fluorescence spectra of cholesterol oxidase(a) and FAD(b)under different time
在图4中,COD在24 h二级结构特征峰基本消失,说明其天然构象破坏,酶变性失活。
通过酶活力、浊度、SDS-PAGE、荧光光谱及圆二色性光谱分析,37℃存储过程中,COD内部疏水基团逐渐暴露,二级结构破坏,分子间聚集导致溶液浊度上升,酶分子变性,导致酶活力下降,同时荧光光谱显示COD在表达过程中未充分结合FAD。因此,导致溶液COD不稳定因素主要有酶蛋白聚集导致构象变化以及缺乏辅基FAD。

图4 存储不同时间COD圆二色性光谱Fig.4 CD spectra of cholesterol oxidase under different time
2.2 甘油对COD稳定性影响
图5表示不同甘油浓度对COD酶活及浊度影响,浓度愈大保护作用愈强,45 h时15%甘油组酶活保留率60.25%,而对照组酶活保留率仅为2.2%。图5b甘油组酶液浊度低于对照组,30 h对照组OD340nm为0.461,甘油组OD340nm最高值仅为0.077。
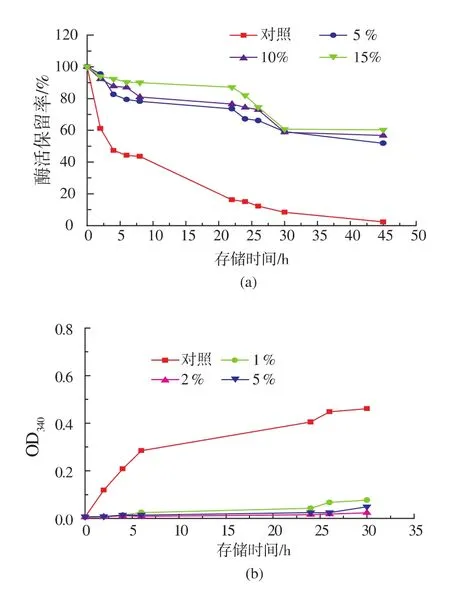
图5 不同甘油体积分数对COD酶活和浊度影响Fig.5 Effects on cholesterol oxidase activity (a) and turbidity(b)under different glycerol concentration
图6为不同体积分数甘油对COD的SDSPAGE图,a为对照组,8 h开始出现聚集体;5%甘油组30 h出现微量聚集体条带,而10%和15%甘油组45 h未出现聚集。

图6 不同甘油体积分数下COD的SDS-PAGE图Fig.6 Analysis by SDS-PAGE under different glycerol concentration
图7显示COD在添加不同体积分数甘油的CD光谱,对照组随时间的延长,二级结构逐渐丧失,24 h二级结构特征峰基本消失,酶分子基本变性;甘油对COD的保护作用明显,24 h COD二级结构保持较好,维持酶分子高级构象,使酶分子保持稳定。
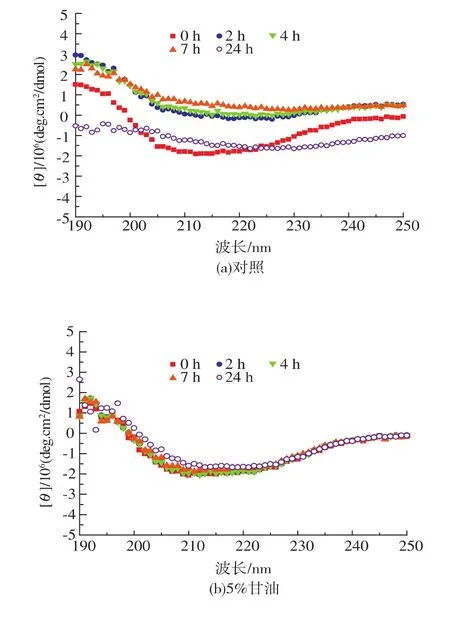

图7 不同甘油浓度下COD的圆二色性光谱Fig.7 CD spectra of cholesterol oxidase under different glycerol concentration
甘油能提高溶液粘度和增加分子表面水化层,粘度上升减少肽链间的碰撞,抑制酶分子间聚集[11],CD光谱显示甘油维持酶分子二级构象免遭破坏,维持酶分子天然构象,提高酶稳定性,表现酶活力相对稳定。
2.3 核黄素对COD稳定性影响
除诺卡氏菌Nocardia产的COD外[12],其他微生物源的COD均以FAD为辅基,本实验中COD与FAD属于非共价结合,而且大量表达COD时未完全结合FAD,因此添加FAD类似物的核黄素(B2)研究对COD稳定性影响。
不同浓度B2对COD酶活及浊度的影响结果见图8。加入B2的酶活保留率与对照组没有明显差别,29 h对照组OD340nm0.348,B2组OD340nm最大为0.431,溶液浑浊产生聚集现象,B2对COD未起保护作用,可能由于B2未与COD结合或者B2虽于COD结合但并未抑制其聚集。

图8 不同B2浓度对COD酶活和浊度影响Fig.8 Effects on cholesterol oxidase activity (a) and turbidity (b) under different riboflavin concentration
图9是不同浓度B2存在下,COD内源荧光及B2荧光图谱,B2具有异咯嗪环,因此也具荧光性。图9a中随B2浓度增加,荧光强度增幅愈小,可能由于B2和COD结合,使一部分疏水基团内埋于内部疏水环境中,同时COD最大发射峰未明显移动,见图9b。图9c表示B2荧光光谱,随着时间延长其荧光强度逐渐降低,可能原因有两个,一是B2异咯嗪环与COD结合导致B2荧光猝灭,另一可能就是B2降解致使荧光强度降低。图3b中B2在24 h后荧光强度未发生明显变化,说明24 h内B2未发生降解,表示该现象是由于B2与COD结合导致荧光强度降低。


图9 不同B2浓度下COD和相应B2荧光图谱Fig.9 Fluorescence spectra of cholesterol oxidase under different riboflavin concentration
荧光光谱表明B2与COD结合,抑制一部分疏水基团暴露,但由于该抑制作用较弱,未能防止COD间聚集,溶液浊度上升,COD构象变化,对COD稳定作用不佳。由于甘油能防止酶分子间聚集,通过向酶液中添加10%甘油,再以COD与B2摩尔比 1∶1、1∶5、1∶10 添加不同浓度的核黄素,分析其对COD稳定性影响,结果见图10。随摩尔比升高,酶活保留率却逐渐降低,65 h对照组酶活保留率39.3%,摩尔比1∶1组酶活保留率31.4%,而摩尔比1∶10组的酶活保留率却只有9.8%,核黄素由异咯嗪基和核糖醇基构成的一种B族维生素[13],核黄素的异咯嗪基虽与FAD结合域结合,但由于COD的FAD结合域口袋较浅,因此核黄素对COD稳定性作用不显著,而且摩尔比越大酶活保留率越低,可能由于过多的核黄素,其疏水基团与COD分子疏水基团结合,对COD构象具有不利影响,因此产生不利的稳定作用。

图10 不同摩尔比B2及甘油对COD活性影响Fig.10 Synthetic effects of different molar ratio of riboflavin and glycerol on cholesterol oxidase activity
3 结语
研究分析了COD不稳定机理,由于COD内部疏水基团暴露导致聚集以及缺乏辅基FAD,导致二级构象破坏,酶变性失活,造成酶分子不稳定。根据失活机理,选用甘油、核黄素两种保护剂,研究其对COD稳定性影响,甘油提高溶液粘度和分子表面水化层,防止分子间聚集,二级构象保持良好,酶活力相对稳定,酶稳定性提高;核黄素作为COD的辅基类似物,虽能与COD结合,抑制部分疏水基团暴露,但由于COD的FAD结合域口袋较浅,且过多核黄素的疏水基团与COD分子疏水基团结合,对COD稳定性产生不利的影响;实验结论不仅提供了可稳定COD酶液的方法,而且研究了其保护机理。
[1]Liao Y H,Brown M B,Quader A,et al.Protective mechanism of stabilizing excipients against dehydration in the freeze-drying of proteins[J].Pharm Res,2002,19(12):1854-1861.
[2]Costa S A,Tzanov T,Cameiro A F,et al.Studies of stabilization of native catalase using additives[J].Enzyme Microb Technol,2002,30:387-391.
[3]李闯,孙艳,张玲,等.乳糖诱导重组大肠杆菌表达胆固醇氧化酶的研究[J].食品与生物技术学报,2011,30(5):470-474.LI Chuang,SUN Yan,ZHANG Ling,et al.Expression cholesterol oxidase gene in recombinant Escherichia coli using lactose as inducer[J].Journal of Food Science and Biotechnology,2011,30(5):470-474.(in Chinese)
[4]王龙刚,邬敏辰,王武.胆固醇氧化酶基因的克隆及在E.coli中的表达[J].微生物学通报,2006,336:39-42.WANG Long-gang,WU Min-chen,WANG Wu.Cloning and expression of Brevibacterium sp.DGCDC-82 cholesterol oxidase gene in Escherichia coli[J].Microbiology,2006,336:39-42.(in Chinese)
[5]Yu Xin,Hailin Yang,Xiaole Xia,et al.Affinity purification of a cholesterol oxidase expressed in Escherichia coli[J].Journal of Chromatography B,2011:1-6.
[6]季文明,陈毅力,张和春.比色法测定COD酶活[J].无锡轻工大学报,2000,19(3):251-254.JI Wen-ming,CHEN Yi-li,ZHANG He-chun.Colormetric determination of the activity of cholesterol oxidase[J].Journal of Wuxi University of Light Industry,2000,19(3):251-254.(in Chinese)
[7]张玲,霍惠芝.甾短杆菌胆固醇氧化酶基因在大肠杆菌中的表达[J].生物加工过程,2008,6(1):21-26.ZHANG Ling,HUO Hui-zhi.Expression of cholesterol oxidase gene from Brevibacterium sp.DGCDC-82 in E.coli[J].Chinese Journal of Bioprocess Engineering,2008,6(1):21-26.(in Chinese)
[8]Speed M A,King J.Polymerization mechanism of polypeptide chain aggregation[J].Biotechnol Bioeng,1997,54:333-343.
[9]Martha P Brown,Catherine Royer.Fluorescence spectroscopy as a tool to investigate protein interactions[J].Biotechnology,1997,8:45-49.
[10]郝淑美,王宣军,张秀霞.用乳糖作为诱导剂进行重组蛋白的表达[J].中国生物制品学杂志,2005,18(5):409-412.HAO Shu-mei,WANG Xuan-jun,ZHANG Xiu-xia.Expression of recombinant gene in E.coli using lactose as inducer[J].Chin J Biologicals,2005,18(5):409-412.(in Chinese)
[11]Timasheff S N,Araka Wa T.Mechanisms of protein precipitation and stabilization by co-solvents[J].J Cryst Growth,1998,90:39-46.
[12]Cheelham P S J,Dunnill P,Lilly M D.The characterization and interconversion of three forms of cholesterol oxidase extracted from Nocardia rhodochrous[J].J Biochem,1982,201:515-521.
[13]王希成.生物化学[M].北京:清华大学出版社,2001.
