纳米乳液包埋技术在功能性食品中的研究进展
2013-02-19麻建国
梁 蓉 , 麻建国 , 钟 芳 *
(1.江南大学 食品胶体与生物技术教育部重点实验室,江苏 无锡214122;2.江南大学 食品学院,江苏 无锡214122)
纳米技术,是指运用物质在纳米尺度 (1~100 nm)时表现出的既不同于宏观物体,也不同于单个孤立原子的新颖物理化学和生物学特性,制造出的具有特定功能的产品,包括纳米材料、纳米器件以及纳米加工及检测技术等[1]。目前,随着纳米技术的不断发展,其应用领域已逐渐从电子、信息、生命科学等高新技术领域,向化工、机械、食品、农业等传统产业中渗透,并迅速发展成为农业和食品领域的一个重要战略平台[2]。其中,针对食品中功能性营养成分(例如:类胡萝卜素、黄酮类、植物甾醇、多不饱和脂肪以及油溶性维生素等)构建的纳米运输载体(例如:纳米脂质体、固体脂质纳米粒、聚合物纳米囊、纳米球、纳米分散液、微乳液、纳米乳液等),一直是食品纳米技术研究的重点和热点[3-6]。纳米载体技术可谓是微胶囊技术向纵深的发展,纳米级的粒径赋予其特殊的小尺寸效应和表面效应。因此,除了能很好的实现对营养素的保护以外,纳米载体往往显示出更高的稳定性和更卓越的体内吸收、控释和靶向性功能[7-9]。
然而,近期Lee等人[10]的研究显示,通过均质/有机溶剂挥发法制备的纳米小球,因为界面表面活性剂的紧密结构,而表现出比传统的乳液低的体外消化效率和生物转化率。因此,在构建纳米体系时,纳米颗粒的粒径是否越小越好,结构是否越牢固越好,成为了人们广泛关注的热点。同时,“纳米级的粒径”这把双刃剑也给该技术应用于人体时可能存在的安全性及毒性带来了风险[11]。为了降低界面张力和饱和超大界面,纳米体系通常需要采用高表面活性的乳化剂,而且添加量大,不可避免地给食品安全带来隐患。而且,纳米级的颗粒可能会改变正常的吸收途径,干扰物质的吸收、分布、代谢和排泄的过程[12-14],引起生物体内一些潜在的不确定变化,带来所谓的“Nanotoxicology”。
统观现有的诸多纳米载体技术,纳米乳液技术可能最具在食品中安全有效运用的潜力。首先,从形成方式看,纳米乳液的纳米粒径通常是高能外力作用的结果,相比于自组装或以共价键结合的纳米载体,吸收后被包埋物质从载体中释放并被利用的可能性大[15-16];其次,从定义来看,纳米乳液是指粒径在10~100 nm之间的胶体分散体系,相比于热力学稳定、粒径在10~30 nm之间的微乳,纳米乳液体系对表面活性剂的界面活性要求低,用量少,且可使用生物兼容性强的生物大分子表面活性剂[17-18]。因此,作者着眼于纳米乳液体系,综述了其在人体胃肠道内消化、吸收、代谢和排泄过程中的变化,并在此基础上总结了影响纳米乳液包埋营养素的生物利用率和纳米乳液潜在毒性的因素。
1 纳米乳液运输系统在人体肠道内的生物学效应
自2009年,Singh等人[19]综述了乳液在人体胃肠道的脂解过程后,2011年,Mcclements等人[20]发表了关于纳米乳液在人体胃肠道的消化与吸收的综述。从文献报道可以看出,伴随着人体消化道内不同部位复杂的物理化学和生物学条件,纳米乳液的结构和所运载的营养素的存在形式都会发生显示的变化,并对乳液的生物学效应和生物安全性产生影响。以下将概括介绍纳米乳液在人体内的消化、吸收、代谢和排泄的途径,为其生物学效应和潜在毒性的研究提供理论依据。
1.1 纳米乳液颗粒的摄入与消化
如图1所示,纳米乳液摄入后,在通过口腔、胃、小肠和大肠的消化过程中,主要受到不同部位的pH值、离子强度、消化酶、表面活性成分和剪切力的影响,而发生结构的变化。首先,在口腔强力的咀嚼推动力下,纳米粒子的结构可能发生部分裂解,形成不完整的碎片[21]。之后,在胃液的高酸度(pH为1~3)条件下,颗粒所带电荷可能发生中和,从而导致颗粒间的聚集[22-23]。如图2所示,Sarkar等人[24]考察了以β-乳球蛋白稳定的乳液经过胃液后的粒径大小变化,共聚焦显微照片显示颗粒间发生部分聚集,粒径也随之增大。同时,在胃液和肠液中各种消化酶的作用开始启动,水解纳米乳液颗粒的组成部分:胰脂肪酶/脂肪酶共同转换甘油三酯和甘油二酯形成甘油单酸酯和游离脂肪酸;磷脂酶转换磷脂形成游离脂肪酸及其他亲脂性物质;蛋白酶转换蛋白形成肽和氨基酸。在此过程中,内源性和外源性表面活性物质(例如:磷脂和蛋白质)将通过竞争性吸附从脂质的液滴表面取代原来的表面活性,脂类的消化产物,亲脂性成分 (如保健食品或药品),在此过程中被载入胆盐/磷脂形成的胶束或是囊泡中,然后通过肠表面的粘膜层被吸收。
1.2 纳米乳液颗粒的吸收、代谢、分布与排泄
一旦纳米乳液的液滴和/或它们的消化产物到达胃肠道的表面,它们即可被吸收利用。根据Sahay研究小组最近的研究报道,其吸收的机制可能存在以下两种[25-26]:1)细胞间吸收机制,如果纳米颗粒的粒径足够小,它将直接通过上皮细胞间的间隙被吸收,进入血液或淋巴系统。此机制很好地解释了Yuan等人[27]在考察固态脂肪纳米颗粒穿越上皮细胞时的情况。2)跨细胞吸收机制,纳米粒子可能被上皮细胞通过被动或主动运输机制直接吸收。该情况下,纳米粒子通常会被细胞粘膜层包裹,然后在此膜中形成囊泡后被吸收,见图3所示。接下来被上皮细胞吸收后的纳米颗粒可能存在以下几种代谢途径:1)被细胞内的酶消化并进一步被吸收利用;2)被细胞直接运输到血液或淋巴系统;3)在特定部位的细胞中累积。而通过以上途径进入血液或淋巴系统后的颗粒,会在人体内循环,其后可能被代谢、排泄在特殊器官内累积。
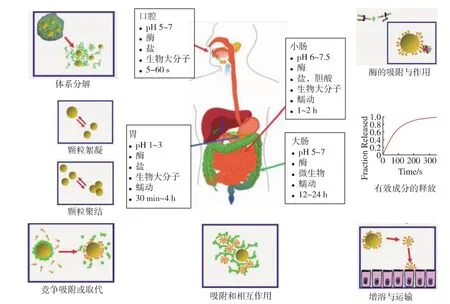
图1 纳米乳液体系在人体各部分消化系统的环境下可能发生的复杂物理化学和生物学变化Fig.1 Schematic diagram of the various physicochemical and physiological processes that may occur during nanoemulsions pass through the human GI tract
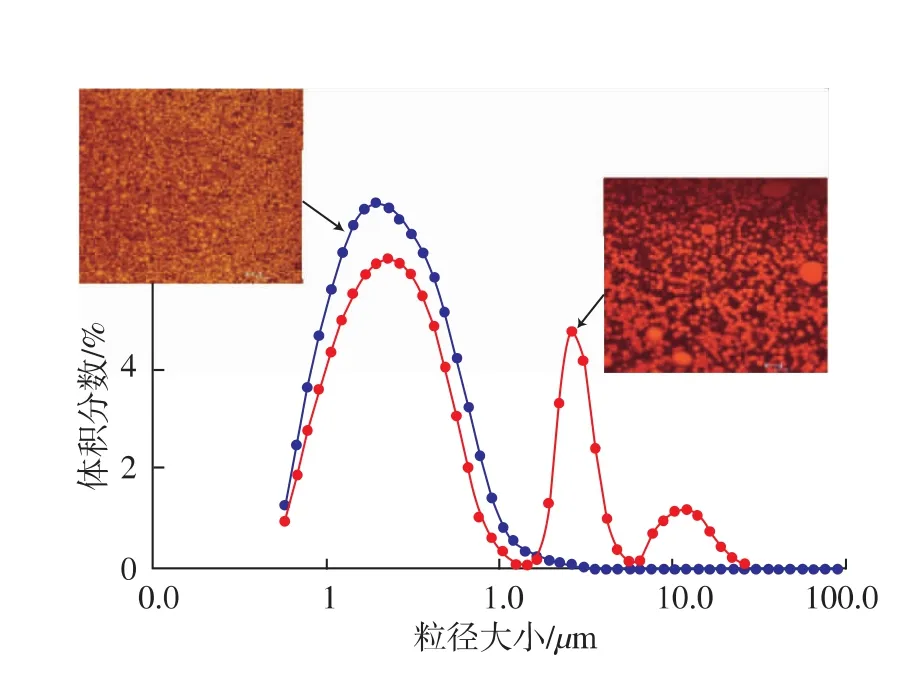
图2 β-乳球蛋白稳定的乳液(●)和在模拟胃液中1 h后乳液(●)的粒径分布及共聚焦显微图Fig.2 Particle size distribution and confocal micrograph of an emulsion made with β-lactoglobulin (●)and of an emulsion mixed with simulated gastric fluid after 1 h (●)

图3 纳米颗粒在人体小肠中的可能吸收模式Fig.3 Schematic diagram of the potential absorption mechanisms of particles by the cells in the GI tract
2 纳米乳液运载系统中营养素的生物利用率及调控
2.1 纳米乳液包埋的活性成分的生物学效价
在以上总结的乳液颗粒的消化吸收过程中,被包裹在其中的活性成分的吸收也会受到影响,其生物利用率(F)主要取决于以下几个因素:F=FB×FA×FM,其中FB是指从纳米载体中释放到胃肠道内的可以被生物利用的那部分活性物质;FA是指释放出来能被小肠上皮细胞吸收的那部分活性物质;FM是指吸收成分中能到达全身而不被代谢循环的那部分活性物质[28]。如图4所示,这三部分分别对应于纳米乳液在摄入、消化和吸收的各个步骤,并取决于乳液颗粒在此过程中发生的变化,并随着颗粒的组成成分和物理化学特性的变化而改变[29]。

图4 乳化载体中的生物活性物质在人体胃肠道内的生物化学变化Fig.4 Schematic diagram of physicochemical processes that occur when a bioactive component trapped within an emulsified carrier lipid in the GI tract
2.2 纳米乳液的构建对其包埋营养素的生物活性的影响
实验中,往往可以通过设计具有不同颗粒特性的纳米乳液输送体系,来控制被包埋在其中的生物活性成分的生物利用率。以下就这些乳液特性具体展开综述。
2.2.1 颗粒大小 在人体肠道内消化时,小的粒径能够增加颗粒的表面积,从而增加颗粒与消化酶的接触面积,提高乳液的消化效率,从而提高营养物的生物转化率[30]。Troncoso等人[31]的研究正好证明了此点,如图5所示,随着乳液颗粒由86 nm下降到30 nm,消化过程中的滞后时间由22.52 min下降到4.09 min,而且最终的消化效率由61.2%提高到71.09%。同时,Mcclements等人[32]进一步通过细胞模型模拟摄取吸收过程。研究发现:被β-乳球蛋白包埋的橘皮素纳米乳液的吸收摄取率显著高于分散在水中或油脂体系中的橘皮素,而且随着乳液粒径的减小,吸收效率显著提高。然而,Tan等人[33]在制备β-胡萝卜素纳米乳液时发现,在4℃储藏12周后,随着体系粒径从77.7 nm降低到55.7 nm,乳液中β-胡萝卜素的保留率也从32.1%下降到25.2%。因此,在构建纳米体系时,应在物理化学和生物学特性间寻求一个平衡点,达到最好的效果。

图5 以吐温20为乳化剂制备的玉米油纳米乳液在模拟消化过程中游离脂肪酸的释放随消化时间变化的曲线Fig.5 Free fatty acids released from corn oil-in water nanoemulsionsstabilized by Tween 20 asa function of digestion time
2.2.2 液滴组成 在乳液的主要成分中,生物活性物质的溶剂——脂类,通过其甘油三酯在人体肠道内的消化速率和程度的不同,而影响着活性成分的生物利用率。例如:Ahmed等人[34]分别选用短链、中链和长链的甘油三酯作为油相,制备得到姜黄色素的纳米乳液,并采用体外模型模拟小肠内乳液消化过程。如图6所示,初始的消化速率表现为短链>中链>长链,而最终的消化程度表现为中链>短链>长链,消化结束后的姜黄色素的生物利用率表现为中链>长链>>短链。Yu等人[35]也选用中链甘油三酯、玉米油、椰子油以及菜籽油制备姜黄色素纳米凝胶,结果同样显示中链甘油三酯能够更好的提高姜黄色素的生物利用率。同时,本研究小组在选用棕榈仁油和中链甘油三酯制备β-胡萝卜素的纳米乳液时发现,使用棕榈仁油的包埋体系显示更高的体外生物利用效率。不同的脂质成分表现出的不同的消化特性,主要取决于其在消化过程中形成的游离脂肪酸在水中的分散性[36-37]。

图6 油相类型对o/w乳液消化速率和程度的影响(以β-乳球蛋白为乳化剂,制备方法为高压均质法)Fig.6 Effect of carrier lipid type on rate and extent of lipid digestion of β-lactoglobulin stabilized oil-inwater emulsions formed by high pressure homogenization
2.2.3 界面组成 乳液在人体肠道内的消化转运过程,是一种发生在界面表面活性成分竞争吸附的反应。因此,乳液的界面特性也是决定消化吸收效率的主要因素[38]。而在乳液的颗粒组成中,界面的特性主要由使用的表面活性剂的特性决定。如图7所示,是几种常用于食品中的乳化剂形成的界面情况。

图7 常用于食品的乳化剂的界面吸附情况Fig.7 Major food-grade materials that can be used to stabilize emulsions by forming an adsorbed layer
在早期的研究中,Wickham等人[39]已发现,被包覆在磷脂中的脂肪颗粒的消化速度要快于包覆在蛋白质中的脂肪颗粒。Mun等人的[40]进一步总结发现,以不同乳化剂制备得到的脂肪颗粒在消化过程中表现出不同的阻力,依次表现为:非离子型表面活性剂(吐温20)<磷脂酰胆碱(卵磷脂)<蛋白(酪蛋白或WPI)。蛋白质和多糖通过美拉德反应得到的产物也被用来制备乳液,以期增加乳化层厚度,来控制乳液在胃肠道内的消化速率[41]。本研究小组也采用不同相对分子质量的改性淀粉制备β-胡萝卜素纳米乳液。研究发现,随着淀粉分子分散密度和多分枝结构的降低,乳液颗粒的消化效率提高,β-胡萝卜素生物利用率也随之增加。这些研究表明,通过合理地选择初始乳化剂,便可控制脂质的消化的速率以及活性成分的转运情况。
2.2.4 液滴的聚集状态 纳米乳液的液滴聚集状态受液滴间胶体相互作用力的影响,会对脂质的消化速率和程度产生显著影响[30]。这不仅取决于乳化剂的类型(例如:电荷,厚度,消化率),还取决于纳米乳液在体内所处的环境条件(例如:pH值,离子强度,温度和成分间的相互作用力)。如果液滴发生聚结,暴露于消化酶中的脂质总表面积将会减少,这可能会减慢消化过程。如果液滴发生絮凝,消化酶将需要穿过液滴才能到达絮凝物形成的脂滴中心,这将再次延缓预期的消化。因此,控制液滴在胃肠道内的聚集状态可能是一种有效的控制活性成分运输的方式。如图8所示,Golding等人[42]采用共聚焦显微镜记录了均一乳液粒子A在模拟胃肠液整个消化过程中的结构变化。B显示在胃液消化初期,乳液颗粒发生部分絮凝,这可能是由于胃部酸性环境导致表面电荷下降所致;随着消化时间的延长,在乳液进入肠液消化后,不同的乳液颗粒就表现出了不同的结构,C显示的是以β-乳球蛋白稳定的乳液,在进入肠液后pH值达到中和,而且颗粒能很好的重新分散,而以离子型表面活性剂制备的乳液,根据所选油相的不同会表现出聚结D或部分聚结E。若表面活性剂的界面作用很弱,这些粒子很可能就完全失去乳状液的结构,发生相分离F。因此,通过调节乳液的组成来控制其在消化过程中的聚集状态,从而调控消化过程,改变活性成分的利用率。
3 纳米乳液的潜在生物毒性
最后,由于纳米乳液会改变其在人体肠道内的消化吸收过程,因此,有必要对其摄入后可能存在的负面影响进行考察。目前关于食品级纳米乳液的潜在生物毒性的实验数据几乎没有,但从大量的物理化学和生物学机理不难推测,纳米颗粒的行为主要取决于它们的大小,形状以及同周围组织的相互作用活动性[11]。其潜在生物毒性可能由以下几个方面造成:

图8 不同类型乳液在模拟胃肠道中结构变化的共聚焦显微镜图谱Fig.8 Various structures of emulsions under simulated gastric and intestine conditions by confocal microscopy
3.1 生物活性成分状态的改变
由于纳米乳液的载体效应,被包埋的生物活性成分的存在状态将发生改变。对于水溶性的茶多酚,Ru等人[43]的研究显示,经过包埋后的EGCG乳液,与纯的EGCG相比较,在相同给药质量浓度50 μg/mL时,HepG2的存活率从62%下降到40%。对于水不溶的姜黄色素,Yu等人[44]采用变性淀粉的胶束包埋后,其对HepG2杀伤力显著提高,见图9。作者分析,这可能是由于包埋体系的运载和保护作用,使可溶性的活性成分浓度增加,生物利用率提高,产生一定的生物毒性。如果生物活性成分的纳米体系被加入到一种被经常消耗产品,例如:软饮料或饮料乳液中时,这种作用将不容忽视。
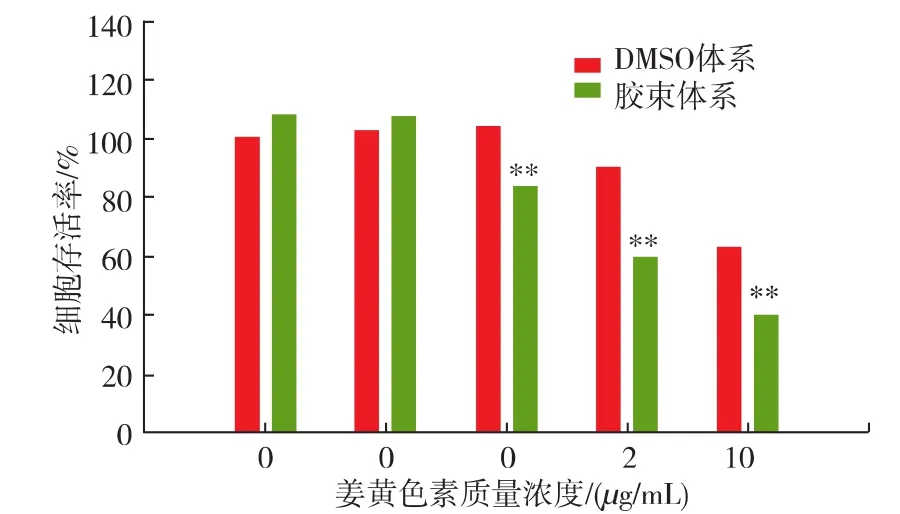
图9 游离和变性淀粉胶束包埋的姜黄色素对细胞存活率的影响Fig.9 Plot of relative cell viability versus curcumin concentration for bulk curcumin and HMS-encapsulated curcumin
3.2 干扰正常的肠道功能
非常小的液滴,具有高的比表面积和曲率,以及不同寻常的表面反应活性,当纳米粒子通过口腔,胃和小肠时,可能会改变胆汁盐,脂肪酶,和其他消化成分在液滴表面的作用情况,从而改变正常的胃肠道功能[45]。例如:吸附到颗粒表面的蛋白质,可能会导致变性,失去正常功能,这可能对人体健康的不利[46]。而且,这些粒子可能与细胞膜受体结合,破坏细胞的正常代谢和功能。总之,集小尺寸、高表面积和高表面能为一身的纳米乳剂颗粒,在生物系统可能带来不可预测影响[47]。
3.3 组成成分的毒性
通常用于制备纳米乳液的一些成分,在高浓度的食用条件下会显示毒性,例如:乳化剂和溶剂。目前,最广泛使用的制备纳米乳液的乳化剂是小分子表面活性剂(有时也作为辅助表面活性剂),此类乳化剂在高浓度下,会表现出毒性。Gong等人[48]对吐温80的溶血特性进行了测定,结果显示:当质量浓度为4 mg/mL时,其溶血系数达到60%左右。Lee S C等人[49]也得到相同的研究结果。因此,在食品级纳米乳液的构建中,天然的生物大分子乳化剂,例如:蛋白质、变性淀粉也常被使用[50-51]。然而,这些天然的表面活性剂,不易在油水界面上迅速展开,在制备过程中,如果单纯使用高速或高压均质,很难得到粒径小于100 nm的乳液。因此,一些新的纳米乳液制备方法(例如:溶剂的置换或蒸发方法)不断呈现。在这些乳液制备过程中,有机溶剂(例如:丙酮、己烷或乙酸乙酯)通常是通过蒸发除去,但在最终产物中可能会有一定的溶剂残留,带来一定的安全隐患[52]。
4 结语
从以上有关纳米乳液的生物学效应和潜在毒性的产生机理及影响因素相关综述可以看出:纳米乳液的构建、纳米乳液的物理化学特性与纳米乳液的生物学命运之间存在着必然的联系,并相互制约相互影响。但是在现阶段的研究中,对于纳米乳液运载的生物活性物质的生物利用率和潜在毒性的研究屈指可数,这也造成了纳米乳液构建中的安全隐患。因此,在纳米乳液应用于功能性食品配料的研究中,应以提高营养物的生物利用率及安全性为最终目的,并结合体外消化模型、细胞模型、动物模型以及毒性检测实验,通过选择合适的乳化剂构建和调节具有不同物理化学特性的稳定的纳米乳液体系。
[1]Nel A,Xia T,Madler L,et al.Toxic potential of materials at the nanolevel[J].Science,2006,311:622-627.
[2]Chen L,Remondetto G,Subirade M.Food protein-based materials as nutraceutical delivery systems[J].Trends Food Science Technology,2006,17:272-283.
[3]Yang X Q,Tian H X,Ho C T,et al.Inhibition of citral degradation by oil-in-water nanoemulsions combined with antioxidants[J].Journal of Agricultural and Food Chemistry,2011,59:6113-6119.
[4]Liang R,Xu S,Shoemaker C F,et al.Physical and antimicrobial properties of peppermint oil nanoemulsions[J].Journal of Agricultural and Food Chemistry,2012,60:7548-7555.
[5]Yu H L,Huang Q R.Improving the oral bioavailability of curcumin using novel organogel-based nanoemulsions[J].Journal of Agricultural and Food Chemistry,2012,60:5373-5379.
[6]Qian C,Decker E A,Xiao H,et al.Inhibition of beta-carotene degradation in oil-in-water nanoemulsions:Influence of oilsoluble and water-soluble antioxidants[J].Food Chemistry,2012,135:1036-43.
[7]Tarver T.Food nanotechnology[J].Food Technology,2006,60:22-26.
[8]Chen H,Weiss J,Shahidi F.Nanotechnology in nutraceuticals and functional foods[J].Food Technology,2006,60:30-36.
[9]Weiss J,Takhistov P,McClements,D J.Functional materials in food nanotechnology[J].Journal of Food Science,2006,71:R107-R116.
[10]Lee S J,Choi S J,Li Y,et al.Protein-stabilized nanoemulsions and emulsions:comparison of physicochemical stability,lipid oxidation,and lipase digestibility[J].Journal of Agricultural and Food Chemistry,2011,59:415-427.
[11]McClements D J,Rao J.Food-grade nanoemulsions:formulation,fabrication,properties,performance,biological fate,and potential toxicity[J].Critical Reviews in Food Science and Nutrition,2011,51:285-330.
[12]Hu L,Mao Z W,Gao C Y.Colloidal particles for cellular uptake and delivery[J].Journal of Materials Chemistry,2009,19:3108-3115.
[13]Bouwmeester H,Dekkers S,Noordam M Y,et al.A.Review of health safety aspects of nanotechnologies in food production[J].Regulatory Toxicology and Pharmacology,2009,53:52-62.
[14]Souto E B,Martins-Lopes P,Lopes C M,et al.A note on regulatory concerns and toxicity assessment in lipid-based delivery systems (LDS)[J].Journal of Biomedical Nanotechnology,2009,5:317-322.
[15]Anton N,Vandamme T F.The universality of low-energy nanoemulsification[J].International Journal of Pharmaceutics,2009,377:142-147.
[16]Leong T,Wooster T,Kentish S,et al.Minimising oil droplet size using ultrasonic emulsification[J].Ultrasonics Sonochemistry,2009,16:721-727.
[17]Bouchemal K,Briancon S,Perrier E.Nano-emulsion formulation using spontaneous emulsification:solvent,oil and surfactant optimization[J].International Journal of Pharmaceutics,2004:241-251.
[18]Huang Q R,Yu H L,Ru Q M.Bioavailability and delivery of nutraceuticals using nanotechnology[J].Journal of Food Science,2010,75:R50-R57.
[19]Singh H,Ye A Q,Horne D.Structuring food emulsions in the gastrointestinal tract to modify lipid digestion[J].Progress in Lipid Research,2009,48:92-100.
[20]McClements D J,Decker E A,Park Y.Controlling lipid bioavailability through physicochemical and structural approaches[J].Critical Reviews in Food Science and Nutrition,2009,49:48-67.
[21]van Aken G A.Modelling texture perception by soft epithelial surfaces[J].Soft Matter,2010,6:826-834.
[22]Ferrua M J,Singh R P.Modeling the fluid dynamics in a human stomach to gain insight of food digestion[J].Journal of Food Science,2010,75:R151-R162.
[23]Kong F,Singh R P.Disintegration of solid foods in human stomach[J].Journal of Food Science,2008,73:R67-R80.
[24]Sarkar A,Goh K K T,Singh R P,et al.Behaviour of an oil-in-water emulsion stabilized by beta-lactoglobulin in an in vitro gastric model[J].Food Hydrocolloids,2009,23:1563-1569.
[25]Sahay G,Kim J O,Kabanov A V,et al.The exploitation of differential endocytic pathways in normal and tumor cells in the selective targeting of nanoparticulate chemotherapeutic agents[J].Biomaterials,2010,31:923-933.
[26]Sahay G,Alakhova D Y,Kabanov A V.Endocytosis of nanomedicines[J].Journal of Controlled Release,2010,145:182-195.
[27]Yuan H,Chen J,Du Y Z,et al.Studies on oral absorption of stearic acid sln by a novel fluorometric method[J].Colloids and Surfaces B-Biointerfaces,2007,58:157-164.
[28]de Morais J M,dos Santos O D H,Delicato T,et al.Physicochemical characterization of canola oil/water nano-emulsions obtained by determination of required HLB number and emulsion phase inversion methods[J].Journal of Dispersion Science and Technology,2006,27:109-115.
[29]Acosta E.Bioavailability of nanoparticles in nutrient and nutraceutical delivery[J].Current Opinion in Colloid&Interface Science,2009,14:3-15.
[30]Lundin L,Golding M,Wooster T J.Understanding food structure and function in developing food for appetite control[J].Nutrition&Dietetics,2008,65:S79-S85.
[31]Troncoso E,Aguilera J M,McClements D J.Fabrication,characterization and lipase digestibility of food-grade nanoemulsions[J].Food Hydrocolloids,2012,27:355-363.
[32]McClements D J,Xiao H.Potential biological fate of ingested nanoemulsions:influence of particle characteristics[J].Food&Function,2012,3:202-220.
[33]Tan C P,Nakajima M.Beta-carotene nanodispersions:Preparation,characterization and stability evaluation[J].Food Chemistry,2005,92(4):661:671.
[34]Ahmed K,Li Y,McClements D J,et al.Nanoemulsion-and emulsion-based delivery systems for curcumin:Encapsulation and release properties[J].Food Chemistry,2012,132:799-807.
[35]Yu H L,Shi K,Liu D,et al.Development of a food-grade organogel with high bioaccessibility and loading of curcuminoids[J].Food Chemistry,2012,131:48-54.
[36]Pouton C W,Porter C J H.Formulation of lipid-based delivery systems for oral administration:materials,methods and strategies[J].Advanced Drug Delivery Reviews,2008,60:625-637.
[37]Porter C J H,Trevaskis N L,Charman W N.Lipids and lipid-based formulations:optimizing the oral delivery of lipophilic drugs[J].Nature Reviews Drug Discovery,2007,6:231-248.
[38]Nik A M,Langmaid S,Wright A J.Digestibility and beta-carotene release from lipid nanodispersions depend on dispersed phase crystallinity and interfacial properties[J].Food&Function,2012,3:234-245.
[39]Wickham M,Garrood M,Leney J,et al.Modification of a phospholipid stabilized emulsion interface by bile salt:effect on pancreatic lipase activity[J].Journal of Lipid Research,1998,39:623-32.
[40]Mun S,Decker E A,McClements D J.Influence of emulsifier type on in vitro digestibility of lipid droplets by pancreatic lipase[J].Food Research International,2007,40:770-781.
[41]Chung C,Sanguansri L,Augustin M A.In vitro lipolysis of fish oil microcapsules containing protein and resistant starch[J].Food Chemistry,2011,124:1480-1489.
[42]Golding M,Wooster T J.The influence of emulsion structure and stability on lipid digestion[J].Current Opinion in Colloid&Interface Science,2010,15:90-101.
[43]Ru Q M,Yu H L,Huang Q R.Encapsulation of Epigallocatechin-3-gallate (EGCG) Using Oil-in-Water(O/W) Submicrometer Emulsions Stabilized by κ-Carrageenan and beta-Lactoglobulin[J].Journal of Agricultural and Food Chemistry,2010,58:10373-10381.
[44]Yu H L,Huang Q R.Enhanced in vitro anti-cancer activity of curcumin encapsulated in hydrophobically modified starch[J].Food Chemistry,2010,119:669-674.
[45]Chaudhry Q,Scotter M,Blackburn J,et al.Applications and implications of nanotechnologies for the food sector[J].Food Additives and Contaminants,2008,25:241-258.
[46]P Hoet,I Bruske-Hohlfeld,O Salata.Nanoparticles-known and unknown health risks[J].Journal of Nanobiotechnology,2004,2:12.
[47]Jiang J,Oberdorster G,Biswas P.Size,Surface charge,and agglomeration characterization of nanoparticle dispersions for toxicological studies[J].Journal of Nanoparticle Research,2009,11:77-89.
[48]Gong J,Huo M R,Zhou J P,et al.Synthesis,characterization,drug-loading capacity and safety of novel octyl modified serum albumin micelles[J].International Journal of Pharmaceutics,2009,376:161-168.
[49]Lee S C,Kim C,Kwon I C,et al.Polymeric micelles of poly(2-ethyl-2-oxazoline)-block-poly(epsilon-caprolactone) copolymer as a carrier for paclitaxel[J].Journal of Controlled Release,2003,89:437-446.
[50]Kralova I,Sjoblom J.Surfactants used in food industry:A review[J].Journal of Dispersion Science and Technology,2009,30:1363-1383.
[51]He C X,He Z G,Gao J Q.Microemulsions as drug delivery systems to improve the solubility and the bioavailability of poorly watersoluble drugs[J].Expert Opinion on Drug Delivery,2010,7:445-460.
[52]Horn D,Rieger J.Organic nanoparticles in the aqueous phase-theory,experiment,and use[J].Angewandte Chemie-International Edition,2001,40:4331-4361.
