黑曲霉中葡萄糖氧化酶基因的克隆及其在毕赤酵母中的表达
2013-02-19刘虎军范新蕾余晓斌
刘虎军, 罗 玮, 范新蕾, 余晓斌
(江南大学 生物工程学院,江苏 无锡 214122)
葡萄糖氧化酶 (GOD,β-D-glucose:oxygen 1-oxidoreductase,EC 1.1.3.4)是一种糖蛋白类的氧化酶,能够将β-D-葡萄糖氧化成葡萄糖酸内酯和过氧化氢,过氧化氢在过氧化氢酶的作用下进一步转化成水和氧气,葡萄糖酸内酯能够进一步转化成葡萄糖酸[1]。葡萄糖氧化酶被广泛应用在食品、饲料、医药、传感器等行业中,例如:作为食品添加剂能够去除葡萄糖从而减缓美拉德反应的发生以防止产品在加工过程中出现褐变[2];能够在一定程度上降低蛋白清的致敏性[3];能够去除啤酒、葡萄酒、软饮中的氧气以提高产品的质量和货架期[4];作为饲料添加剂能够改善动物肠道环境促进动物生长[5];葡萄糖氧化酶是新型传感器中的重要的组成部分,可以用来测定糖含量[6];此外利用基因工程技术还可以将葡萄糖氧化酶基因克隆到植物体中用来抗虫抗病[7]。
目前,葡萄糖氧化酶主要采用黑曲霉和青霉进行发酵生产获得[8],但是存在发酵条件复杂、产量较低、发酵产物复杂和后期纯化成本高、难以获得较高纯度的酶制剂等缺点[9]。很多学者试图利用基因工程手段改良和提高葡萄糖氧化酶的生产,例如:增加黑曲霉菌株中葡萄糖氧化酶基因的剂量[10],在瑞氏木霉[11]等霉菌中表达、在原核菌株中表达[12]、在毕赤酵母中表达[13]等。其中利用甲醇毕赤酵母表达葡萄糖氧化酶基因具有较为明显的优势:毕赤酵母的遗传背景清晰、表达系统高效,同时甲醇毕赤酵母的高密度发酵经验非常有利于工业化生产[14]。然而,毕赤酵母中表达的外源葡萄糖氧化酶产量和酶活力仍然较低,远不能与其他产酶基因工程菌的表达水平相比较。
本实验旨在克隆来源于黑曲霉PCTC的葡萄糖氧化酶基因,在毕赤酵母GS115中异源表达,以期获得高产葡萄糖氧化酶的生产用菌株。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒 黑曲霉菌株PCTC:由作者所在实验室保存;大肠杆菌Top10,JM109:用来构建和克隆目的基因;毕赤酵母GS115:用来表达目的基因; 质粒 pMD18-T (Takara Biotechnology,Dalian Branch):用来构建克隆载体;质粒pPIC9K:用来表达目的基因。
1.1.2 试剂与仪器 PCR相关试剂、T克隆相关试剂和限制性内切酶:购自Takara公司;PCR产物纯化试剂盒和G418等:购自上海生工生物有限公司;琼脂糖、辣根过氧化物酶和邻联茴香胺等试剂:购自Sigma公司;色谱纯甲醇及其他试剂(AR):均购自国药集团。PCR仪和电转化仪:Eppendorf公司;电泳仪:北京六一仪器厂。
1.1.3 培养基 黑曲霉活化培养基用POD培养基,大肠杆菌的培养和转化用LB培养基。酵母的培养、转化和蛋白的诱导生成用YPD、MD、MM、BMGY及BMMY等培养基。培养基组成成分如下:
1)POD培养基:将洗净的去皮的马铃薯200 g切成小块,煮沸30 min,过滤,加入20 g葡萄糖,加水定溶到1 000 mL,自然pH值,121℃下灭菌20 min;
2)LB:蛋白胨 10 g,酵母膏 5 g,氯化钠 10 g,用NaOH调节pH值为7.4,定容至1 000mL;121℃下灭菌20 min;
3)YPD:蛋白胨 20 g,酵母膏 10 g,葡萄糖 20 g,定容至1 000mL;自然pH值,121℃下灭菌20 min;
4)MD:酵母基本氮源培养基(YNB)1.7 g,硫酸铵5 g,葡萄糖200 g,定容至1 000mL;自然pH值,121℃下灭菌20 min。加入500×B(过滤灭菌)2 mL;
5)MM:YNB1.7 g,硫酸铵 5 g,甲醇 12 mL,定容至1 000 mL;自然pH值,121℃灭菌20 min。加入500×B(过滤灭菌) 2 mL;
6)BMMY培养基:酵母浸出物 10 g,蛋白胨20 g,加入800 mL水中,121℃下灭菌20 min,冷至室温, 加入灭好菌的 PBS 100 mL,10×YNB 100 mL,500×B 2 mL(过滤灭菌),甲醇 5 mL;
7)BMGY培养基:酵母浸出物10 g,蛋白胨20 g,加入700 mL水中,121℃下灭菌20 min,冷至室温 加 入 灭 好 菌 的 PBS100 mL,10×YNB 100 mL,500×B 2 mL(过滤灭菌),10×GY 100 mL;
8)显色培养基:将10 mL的1%琼脂加热溶化并冷至50℃左右后加入3 mL的显色液(1 mL溶液2中加入 100 μL溶液 1和 200 μL溶液 3混匀,补加缓冲液到3 mL)。溶液1:0.1 g邻联茴香胺溶于10 mL甲醇中,4℃保存;溶液2:10%D-葡萄糖;溶液3:60 U/mL的辣根过氧化物酶。
1.2 实验方法
1.2.1 黑曲霉基因组DNA的提取和目的基因的克隆
1)黑曲霉PCTC菌体预处理:采用POD培养基平板活化黑曲霉PCTC,于28℃下培养24 h,刮取孢子配置成悬液,接种到含有50 mL种子液的250 mL摇瓶中,取培养好的种子液以相同的方法接种到含有1.5% 吐温-60(TW-60)的摇瓶中,于 200 r/min、30℃摇床中培养24 h。将数颗灭菌的玻璃珠加入到摇瓶中,置于200 r/min摇床中振荡3~4 h,取1~1.5 mL的菌液8 000 r/min离心,去掉上清液,用生理盐水洗涤两次,再次离心收集菌体。
2)基因组DNA的提取:采用氯化苄法[15]提取黑曲霉PCTC的基因组DNA。
3)目的基因的获得:设计如下引物:
GOD-R:TTGCGGCCGCTCACTGCATGGAAGCA TAATCTTCCAAG
GOD-F:GCTTACGTAAGCAATGGCATTGAAGC CAGCCTCCT
其中斜体部分分别为Not1、Snab1酶切位点,以黑曲霉基因组DNA为模板进行PCR扩增,PCR产物经纯化回收后,在T4连接酶的作用下连接到pMD18-T载体上,并转化E.coli JM109,经蓝白斑筛选和菌落PCR鉴定获得阳性克隆子,同时提取pMD18-GOD质粒送至上海生工生物工程有限公司测序进行验证。
1.2.2 表达载体的构建和宿主转化 用Snab1和Not1分别将pPIC9K和pMD18-GOD质粒酶切。pPIC9K酶切产物用PCR产物回收试剂盒回收纯化,pMD18-GOD质粒的酶切产物用胶回收试剂盒回收纯化。在T4连接酶的作用下构建重组质粒pPIC9K-GOD,转化E.coli Top10,经氨苄抗性平板筛选和菌落PCR鉴定,同时送至上海生工测序验证,保存测序正确的菌株,利用电转化方法转化毕赤酵母GS115,将电击转化的感受态细胞在MD培养基上培养至转化子出现。
1.2.3 GOD高效表达株的筛选 将上述获得的转化子制备成菌液涂布在含有G418的梯度平板上,G418质量浓度梯度从0 mg/mL到3 mg/mL,培养温度为30℃,挑选在高浓度下生长的单菌落,再将其分别点种在MM和MD平板中,以确定其表型。培养出单菌落后将MD平板置于4℃冰箱中保存,然后利用平板筛选法[16],将10 mL显色培养基倾倒在MM平板上。30℃下放置1 h,然后将其放于4℃冰箱中显色。将显色圈较大的阳性克隆子接种在3 mL BMGY培养基上,30℃、200 r/min下培养24 h,离心收集菌体,用3 mL的BMMY培养基重悬,在相同的培养条件下诱导表达,每24 h补充300 μL甲醇,摇床培养4 d后测定上清液中酶活性大小,确定高产菌株。
1.2.4 摇瓶发酵条件优化 为了提高毕赤酵母的产酶活性,作者对接种量、pH值、诱导温度、诱导甲醇浓度、装液量和诱导时间等6个因素进行了优化。将重组菌接种在含有100 mL的YPG培养基的500 mL的摇瓶中,在30℃、200 r/min下培养24 h,以5%的接种体积分数接种到含有BMGY培养基的250 mL的摇瓶中,在30℃、200 r/min下培养16~24 h,直到OD600达到5~6时,静置1~2 h以消耗剩余的甘油并且使菌体沉淀。然后倒掉上层培养基,用一定体积的BMMY培养基重悬,以后每24 h补加1%的甲醇诱导产酶。甲醇体积分数选择0.5%、1%、1.5%、2%和2.5%五个浓度;接种体积分数选择25%、50%、100%和150%四个梯度;pH 设置为 3、4、5、6和7五个梯度;诱导温度分别设为22、25、28、30 ℃; 装液量选择 15、20、30、40、50 mL 五个梯度;诱导表达时间的优化以每天取样测定酶活性、OD600来确定最佳发酵时间。每组实验设置3个平行,分别测定酶活性和OD值。
1.2.5 酶活性的测定 酶活性测定方法根据Sigma和周建芹[17]公司的方法并加以改进:配置21 μmol/mL的双氧水标准液,反应体系中含有2.5 mL的0.21 mmol/L的邻联茴香胺溶液,0.4 mL的10%葡萄糖溶液,0.1 mL的60 U/mL的辣根过氧化物酶,再加入1 mL不同浓度的双氧水,在35℃下预热5 min,加水补到10 mL,在OD500下测定吸光度,以吸光度为横坐标,以浓度为纵坐标制作标准曲线。样品的测定用1 mL稀释好的样品代替双氧水,反应1~5 min测定OD值然后计算酶活性大小,酶活性单位定义为:37℃下,每分钟催化产生1 μmol的双氧水所需要的酶量为一个酶活单位。
2 结果与分析
2.1 黑曲霉PCTC基因组DNA的提取和葡萄糖氧化酶基因克隆
将配制的黑曲霉孢子悬液(OD500=0.4)以不同的接种体积分数接种于摇瓶,培养24 h后加入等量的玻璃珠,摇床振荡4 h。未添加玻璃珠处理的培养液中,菌丝体集结形成菌球,难以提取出基因组DNA,用玻璃珠处理后则相对容易地提取出基因组DNA,这是因为采用玻璃珠处理使菌丝处于分散状态,有利于氯化卞和细胞壁充分接触。接种体积分数对基因组DNA的提取也产生很大的影响,接种量小于0.5%时容易形成较大菌球,当菌球直径大于0.2 mm时,即使用玻璃珠处理也无法提取出基因组DNA。另外TW-60有利于基因组DNA的提取,因为添加1.5%的TW-60能够有效减小菌球的直径和离散菌丝体。
以黑曲霉PCTC基因组为模板克隆获得了GOD基因,见图1。目的基因条带单一、浓度较高。图2中4号和5号为两个白色菌落的菌落PCR,第三条带为蓝斑质粒DNA线性化的条带,4号5号菌株经测序其全长为1 772 bp,将其提交Genbank所获序列登录号是JX105360与Genbank中其他葡萄糖氧化酶基因的序列的相似度在92%~98%之间,预期能够编码含有589个氨基酸残基的蛋白质。对序列进行分析,发现序列中不含有内含子和基因原有的信号肽序列,不含有Sac1、Not1和Snab1酶切位点,含有Ecor1酶切位点,符合之前的预测。
2.2 重组表达载体的构建
分别用SnabI和NotI对pMD18-T-GOD和pPIC9K做分步酶切,结果见图3。切胶回收位于2000 bp处的条带,pPIC9K酶切后用PCR回收试剂盒纯化回收,以适当比例混合后在16℃下进行连接。挑选阳性克隆进行菌落PCR验证,电泳检测结果见图4。由图4可以看出2、4、6、8和9号都出现目的条带,送2号测序,由测序结果可以看出目的基因正确的插入到pPIC9K中。
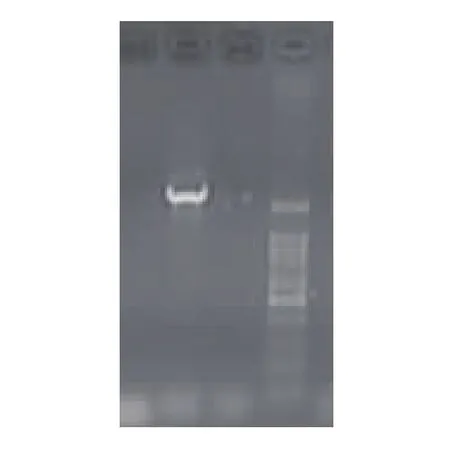
图1 目的基因克隆PCR电泳检测结果Fig.1 PCR assay of the Target gene
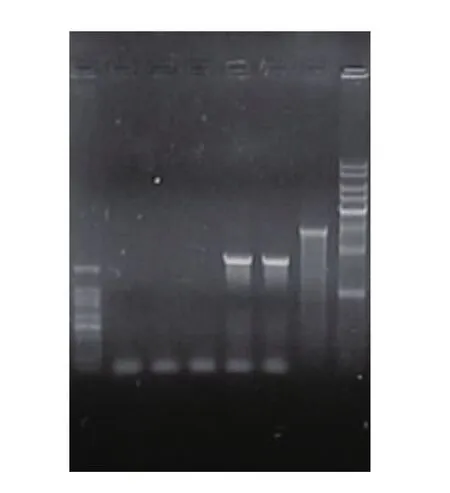
图2 蓝白斑筛选阳性克隆PCR验证结果Fig.2 PCR assay of the positive clones

图3 重组质粒pMD18-T-GOD的酶切鉴定Fig.3 Restriction pattern of recombinant pMD18-T-GOD

图4 重组质粒pPIC9K-GOD的PCR鉴定结果Fig.4 PCR assay of recombinant pPIC9K-GOD
2.3 毕赤酵母宿主菌转化和筛选
大量提取2号质粒做电转化,从MM平板、G418梯度平板筛选获得了20个阳性克隆子。再用显色平板筛选所获得的阳性克隆,见图5。从图5可以看出,A、B、C三个菌落的显色圈大小不同,经测定A酶活性最高,B酶活性较低,C基本没有酶活,说明该方法可以用来进行转化株的有效筛选。
对筛选得到的20株菌进行摇瓶复筛,其中菌株GOD2-14经诱导获得了最高的酶活性(0.128 U/mL)。将菌株分别接种在MM平板和MD平板上培养,结果显示转化子在MM平板上和MD平板上长势相近,其表型为HIS+MUT+。
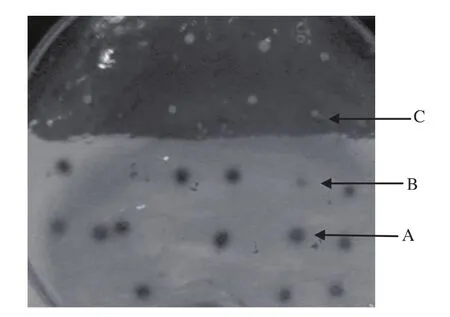
图5 重组酵母显色平板鉴定结果Fig.5 Plat assay for GOD production
2.4 发酵条件优化
对pH、接种量、甲醇浓度、装液量、培养温度和诱导时间等六个因素进行了优化。结果表明,当pH设置为5时,重组酵母的葡萄糖氧化酶表达活力比在4和6时高,到培养第七天时,其表达的酶活性比pH为4和6分别高34%和33%(图6a)。这有可能是葡萄糖氧化酶在碱性条件下不稳定的原因造成的[18]。不同接种体积分数的影响结果见图6b,接种体积分数为50%时,其发酵液酶活性最高;甲醇浓度对产酶也有很大影响,由图6c可以看出随着甲醇体积分数的增加,酶活性和菌浓度显著增加,当其体积分数达到2%的时候酶活性不再提高,反而有下降的趋势,这说明甲醇体积分数过高时会抑制重组菌产酶;随着装液量的增加细胞浓度不断降低,酶活性也随之降低,见图6d;装液量直接影响溶氧,装液量较高,溶氧不足,细胞浓度较低,酶活性也随之降低,但是由于装液量太小时不利于后期的取样和甲醇的添加,所以选取25 mL的装液量做为最佳值;不同温度下诱导产酶发现,22℃下产酶较高,随着温度的升高产酶量下降,这说明低温有利于菌株产酶,图6e;随着诱导时间的增加,菌体密度持续增加,酶活性也不断的增加,两者存在正相关性,在第7天时酶活性达到最高,为14.23 U/mL,见图6f。通过发酵条件的优化,获得了最佳发酵条件为200 r/min、pH 5、接种体积分数50%、装液量为20 mL,25℃下经1.5%甲醇诱导7~8 d,获得的最高酶活为25 U/mL,是优化前的73倍。
3 结语
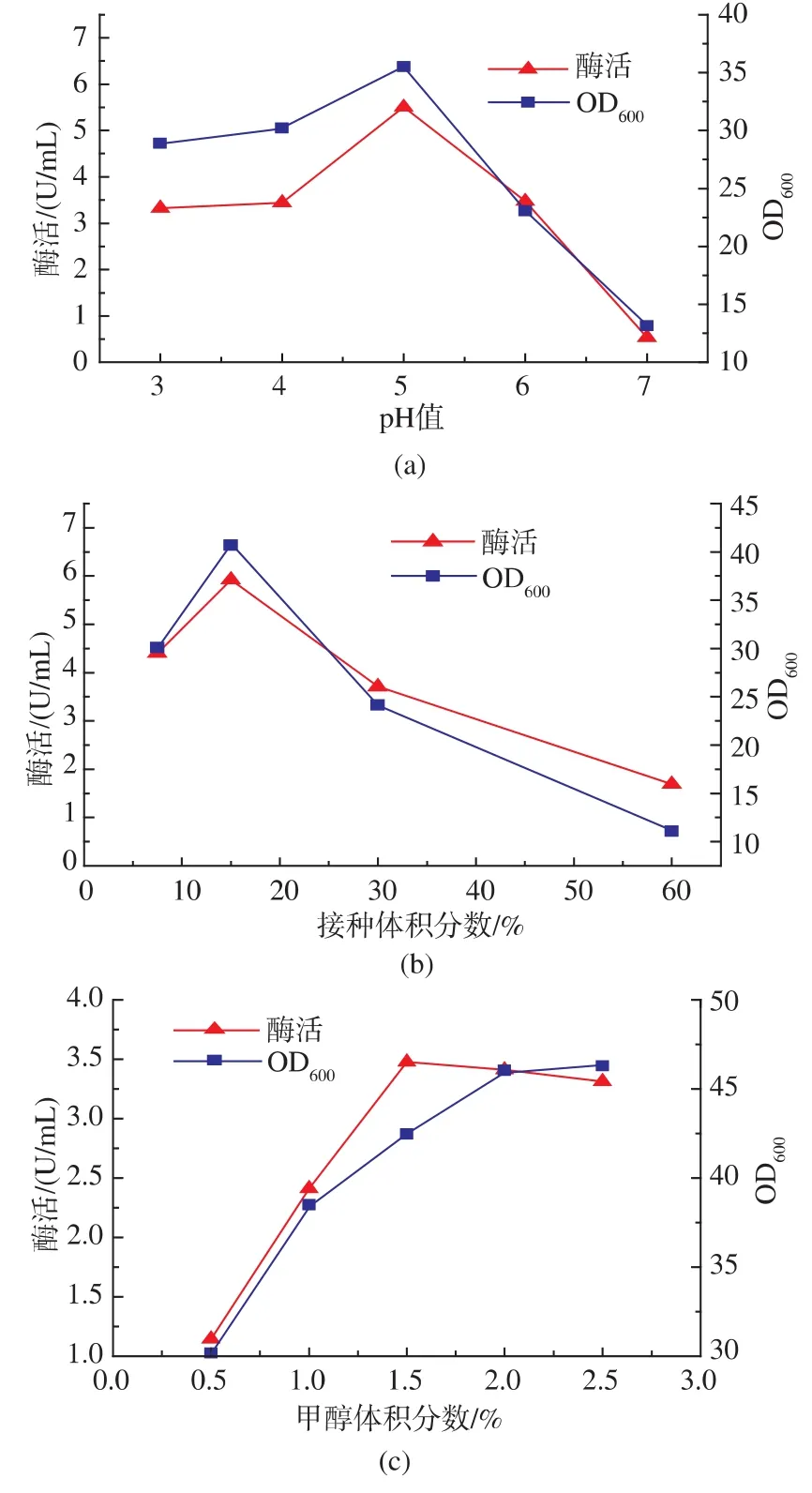
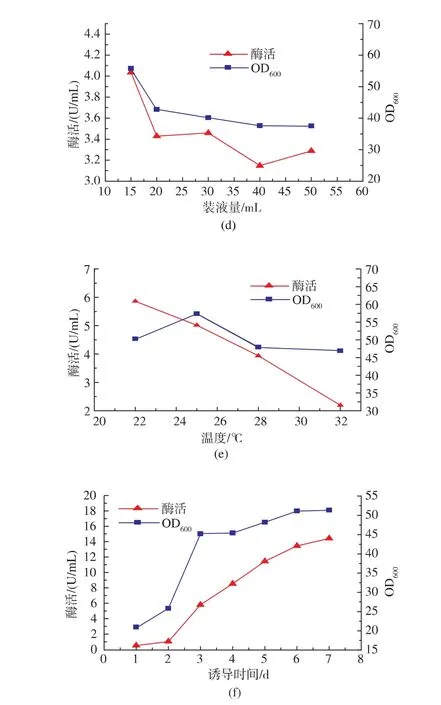
图6 重组菌发酵条件优化Fig.6 Optimization of fermentation conditions
从一株高产葡萄糖氧化酶的黑曲霉PCTC中获得了葡萄糖氧化酶基因的完整序列,并进行了克隆和表达的研究,获得了一株具有较强表达能力的重组菌。
本研究对通用的丝状真菌基因组DNA提取方法进行了改进,在加入氯化卞破壁前,用灭菌玻璃珠对发酵液进行预处理,获得了黑曲霉基因组DNA。该方法相对于液氮和溶菌酶的前处理方法,操作简单,经济安全而且能满足后续试验要求,因此更加适用于丝状真菌基因组DNA的提取。重组菌能够在以甲醇为惟一碳源的培养基上生长并在其诱导下高效表达葡萄糖氧化酶基因,以1.5%的甲醇诱导7~8 d,其酶活性达到20~25 U/mL。周亚凤[17]等利用pPIC9质粒成功将来源于黑曲霉的葡萄糖氧化酶基因在毕赤酵母GS115中表达,获得30~40 U/mL的酶活;Yao Guo[14]等利用pPICαA质粒将来源于黑曲霉的葡萄糖氧化酶基因在毕赤酵母SMD1168中表达,获得40 U/mL的酶活性。一般认为不同的表达系统和表达宿主对外源基因的表达会产生很大的影响;当外源蛋白质在宿主中表达时,常常由于密码子偏好性不同导致产量低甚至不表达;表达菌株的甲醇利用表型与表达盒的染色体整合位点和方式也会影响外源基因的表达。因此,通过筛选高表达菌株、密码子优化、选用不同的线性化位点、利用不同的表达载体和宿主菌以及信号肽优化会进一步提高重组菌的GOD表达水平。
[1]Ramzan I M,Mehmood T.Enhanced production of glucose oxidase from uvmutant of Aspergillus niger[J].African Journal of Biotechnology,2009,8(2):288-290.
[2]王树庆,刘秀华.葡萄糖氧化酶及其在食品工业上的应用[J].食品科技,2001,3:30-31.WANG Shu-qing,LIU Xiu-hua.Glucose oxidase and its application on food industry[J].Food Science and Technology,2001,3:30-31.(in Chinese)
[3]聂君,杨哪,金征宇,等.不同加工处理方式对蛋清致敏的影响[J].食品与生物技术学报,2011,30(7):528-534.NIE Jun,YANG Na,JIN Zheng-yu,et al.Influence of different processings on egg white’s antigenicity[J].Journal of Food Science and Biotechnology,2011,30(7):528-534.(in Chinese)
[4]Wong C M,Wong K H,Chen X D.Glucose oxidase:natural occurrence,function,properties and industrial applications[J].Appl Microbiol Biotechnol,2008,78(6):927-938.
[5]谌斌 唐雪明,沈微,等.粗糙脉孢菌漆酶基因的克隆及在毕赤酵母中的初步表达[J].食品与生物技术学报,2006,25(4):43-47.CHENG Bin,TANG Xue-ming,SHEN Wei,et al.Cloning of a laccase gene from Neurospora crassa and it’s preliminary expression in Pichia pastoris[J].Journal of food Science and Biotechnology,2006,25(4):43-47.(in Chinese)
[6]Chang G,Tatsu Y,Goto T,et al.Glucose concentration determination based on silica sol-gel encapsulated glucose oxidase optical biosensor arrays[J].Talanta,2010,83(1):61-65.
[7]Tang Q B,Hu Y H,Kang L,et al.Characterization of glucose-induced glucose oxidase gene and protein expression in Helicoverpa armigera Larvae[J].Archives of Insect Biochemistry and Physiology,2012,79(2):104-119.
[8]Sandip B,Bankar,Mahesh V,et al.Glucose oxidase-an overview[J].Biotechnology Advances,2009,27(4):89-501.
[9]Crognale S,Pulci V,Brozzoli V,et al.Expression of Penicillium variabile P16 glucose oxidase gene in Pichia pastoris and characterization of the recombinant enzyme[J].Enzyme and Microbial Technology,2006,39(6):1230-1235.
[10]Whittington H,Kerry-Williams S,Bidgood K,et al.Expression of the Aspergillus niger glucose oxidase gene in A.niger[J].Curr Gene,1990,18(6):531-536.
[11]母敬郁,王峤,杨纯中,等.瑞氏木霉表达黑曲霉葡萄糖氧化酶[J].生物工程学报,2006,1:82-85.MU Jing-yu,WANG Qiao,YANG Chun-zhong,et al.Recombinant Aspergillus niger glucose oxidase expression in Trichoderma reesei[J].Chinese Journal of Biotechnology,2006,1:82-85.(in Chinese)
[12]安玉麟,孙瑞芬,张鹤龄,等.黑曲霉葡萄糖氧化酶基因的原核表达及其蛋白产物的Western-blot分析 [J].华北农学报,2009,4:84-87.AN Yu-lin,SUN Rui-fen,ZHANG He-ling,et al.Prokaryotic expression and western-blot analysis of glucose oxidase gene from Aspergillus niger[J].2009,4:84-87.(in Chinese)
[13]Yao G,Feng X L,Hai Z Z,et al.Cloning and heterologous expression of glucose oxidase gene from Aspergillus niger Z-25 in Pichia pastoris[J].Appl Biochem Biotechnol,2009,162(2):498-502.
[14]齐连权,陈薇,来大志,等.毕赤酵母表达系统研究进展[J].中国生物工程杂志,2002,6:45-47.QI Lian-quan,CHENG Wei,LAI Da-zhi,et al.Advances in Pichia expression system[J].Journal of Chinese Biotechnology,2002,6:45-47.(in Chinese)
[15]周建芹,陈韶华,王剑文.测定葡萄糖氧化酶活力的一种简便方法[J].实验技术与管理,2008,25(12):58-60.ZHOU Jian-qin,CHEN Shao-hua,WANG Jian-wen.A simple and convenient method to determine the activity of glucose oxidase[J].Experimental Technology and Management,2008,25(12):58-60.(in Chinese)
[16]周亚凤,张先恩,刘虹,等.黑曲霉葡萄糖氧化酶基因的克隆及其在酵母中的高效表达[J].生物工程学报.2001,17(4):400-405.ZHOU Ya-feng,ZHANG Xian-en,LIU Hong,et al.Cloning and expression of Aspergillus niger glucose oxidase gene in methylotrophic yeast[J].Chinese Journal of Biotechnology,2001,17(4):400-405.(in Chinese)
