变幻青霉氨基甲酸乙酯降解酶产酶条件优化及酶的底物特异性
2013-02-19谷晓蕾田亚平
谷晓蕾, 田亚平
(江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
氨 基 甲 酸 乙 酯 (Ethyl Carbamate, 又 叫Urethane),是一种具有遗传毒性及致癌性的物质[1-5],存在于许多发酵食品(如酱油、酵母、奶酪等)和酒精饮料(如黄酒、白酒、葡萄酒等)中[6-12]。随着人民生活水平的不断提高,天然发酵食品中微量成分的合理控制和食品品质的不断提升已日益受到国内外食品行业的关注。研究表明,去除成品黄酒中已产生EC的主要途径之一为酶解法[13]。
目前,国内主要是对氨基甲酸乙酯检测方法的研究,而对氨基甲酸乙酯降解酶的研究报道较少。国外则早在20世纪60年代,就有报道说小鼠能降解被14C标记的氨基甲酸乙酯,之后,Yamamoto等人在小鼠肝脏中发现了降解氨基甲酸乙酯的能力,因为作用能力很低,所以,他们并不能确认这是酶促反应所致。近来,国外报道的来自小鼠粪便的柠檬酸杆菌(Kyoichi Kobashi等人,1990 年)[4]、小鼠肠胃的地衣芽孢杆菌 (Zhao Chun Ju等人,1991年)[5]和B.R.Mohapatra筛选自海洋微生物的球状细菌所产的氨基甲酸乙酯降解酶在酸性和中性条件下都具有一定的酶活。
本课题组前期筛选和鉴定出一种P.variabile JN-A525菌株具有产EC降解酶的能力,粗酶特性研究和初步应用效果发现,其最适pH在酸性范围,有一定耐乙醇能力,在复杂的实际黄酒体系中仍然有水解氨基甲酸乙酯的能力,具备一定的应用潜力。为提高该菌产酶能力,作者对P.variabile JNA525的生长及其产酶的适宜条件进行研究,并对所产氨基甲酸乙酯降解酶初步纯化,进一步考察该酶在模拟黄酒体系中所表现的底物特异性,为酶解法控制黄酒微量成分的实际应用建立了良好基础。
1 材料与方法
1.1 实验材料
1.1.1 菌株 P.variabile JN-A525是作者所在实验
室筛选获得的产氨基甲酸乙酯降解酶的菌株。
1.1.2 培养基
1)种子培养基:蛋白胨 1 g/L,NaCl 5 g/L,KH2PO42 g/L,pH 5.5。
2)基础发酵培养基:葡萄糖20 g/L,蛋白胨10 g/L,pH 6.0。
1.2 实验方法
1.2.1 孢子悬浮液的制备 用适量的无菌水洗下琼脂斜面上新鲜、生长旺盛的孢子,然后移入装有种子培养基的三角瓶中,置于恒温调速摇床中进行培养,转速为230 r/min,温度为30℃,培养6 h。
1.2.2 酶活的测定方法 根据Berthelot反应[14-15],用比色法625nm测定酶活力。
1.2.3 蛋白质含量的测定 采用Forlin酚法[16]测定,以牛血清白蛋白为标准。
1.2.4 发酵条件的优化 以P.variabile JN-A525生长状况、产酶活力为指标,优化培养基碳源、氮源、初始pH、培养温度、接种量、装液量等。并在单因素实验的基础上对接种量、装液量、起始pH和发酵温度进行4因素3水平L9(34)正交试验。
1.2.5 酶的初步纯化流程 酶的初步纯化流程见图1。

图1 酶的初步纯化流程图Fig.1 Workflow of preliminary purification of urethanase
1.2.6 初步纯化酶的底物特异性 在15%酒精含量、pH 4.4的条件下,分别以3%甘氨酸、3%谷氨酸、3%氨基甲酸甲酯、3%氨基甲酸乙酯、3%γ-氨基丁酸、3%苄酯、3%苯胺酰胺、3%尿素、3%氨基丁酸、3%丁酯、3%谷氨酰胺为底物,各取1 mL于标记好的比色管中,分别加入1 mL酶液,50℃水浴反应30 min,测定 OD625值。
2 结果与讨论
2.1 正交试验
前期对碳源、氮源、温度、转速、接种量、装液量、pH值、无机盐离子等单因素进行考察,在此基础上,采用四因素三水平进行L9(34)正交试验,不考虑因素间的相互作用,因素设计见表1,研究结果见表2。

表1 四因素三水平正交设计Table 1 Factors and levels of the orthogonal experiment

表2 正交试验结果Table 2 Results of the orthogonal experiment
由极差分析可以看出,各因素影响酶活力顺序为:C>A>B>D,即发酵温度是影响EC降解酶酶活力的主要因素,其次是装液量,然后是接种量和发酵pH值。产EC降解酶最适条件组合为:A2B2C3D1,即250 mL的三角瓶装液量70 mL,接种体积分数3%,发酵温度32℃,发酵初始pH 6。
将正交试验所得的最佳组合A2B2C3D1。做3次重复实验,测定酶活力平均值为522.1 U/L,与初始单因素优化前的150 U/L相比,酶活水平提高了3.47倍。1997年,B.R.Mohapatra和M.Bapuji筛选自海洋微生物的球状细菌所产的氨基甲酸乙酯降解酶酶活为0.897 IU/mL[13]。上述摇瓶的优化条件为后期进一步的发酵放大研究创造了良好的基础。
2.2 酶的初步纯化
前期考察表明该真菌所产的能降解氨基甲酸乙酯的酶是一种胞内酶,收集菌体破碎细胞后对粗酶进行研究,发现其最适温度为50℃,最适pH 6.0,具一定的乙醇耐受性(黄酒的酒精度15%时,相对酶活仍能达65%左右),模拟黄酒体系 (乙醇15%,EC 3%,pH 4.4)中对氨基甲酸乙酯(EC)有相对较强的水解能力,对氨基甲酸甲酯(MC)也有一定作用。
在上述基础上,为排除杂质干扰,相对准确地了解氨基甲酸乙酯降解酶的特性,采用超声破碎、盐析、Superdex G-75凝胶过滤层析基本步骤进行初步纯化,纯化结果见表3。
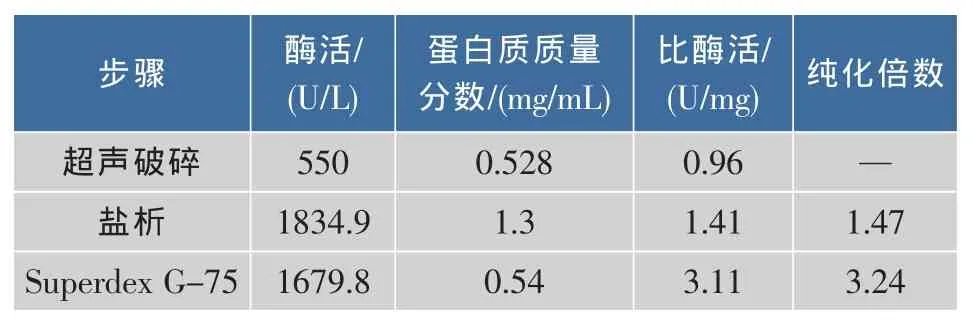
表3 变幻青霉氨基甲酸乙酯降解酶的初步纯化结果Table 3 Resultsofthe preliminary purification of urethanase from Penicillium variabile JN-A525
真菌发酵后的体系往往非常复杂,纯化过程中跟踪分析氨基甲酸乙酯降解酶的活性,过程中需要特别注意氨离子的干扰,盐析过程选择了硫酸钠在夏天30℃以上的室温进行,表3结果表明,纯化过程中该酶比活已获得逐步提高,幅度不大的原因可能与该酶低浓度时的稳定性欠佳有一定关系,所以后期可进一步采用传统诱变育种和分子生物学手段来提升产酶水平和所产酶的稳定性。
2.3 模拟黄酒体系下酶底物特异性验证
超声破碎后的粗酶液已进行过一些酶学基本特性的研究,为排除干扰,对经过上面步骤纯化后的酶在模拟黄酒体系下进行底物特异性方面的验证。图2结果表明:Penicillium variabile JN-A525菌株所产EC分解酶对氨基甲酸乙酯、尿素、苯甲酰胺有相对较强的降解能力,对氨基甲酸甲酯也可以作用,但作用较弱,对一些氨基酸基本没表现作用。因尿素是生成氨基甲酸乙酯的前体物质,因此该酶可通过作用于尿素,减少其进一步与乙醇生成氨基甲酸乙酯的可能,亦可直接作用于氨基甲酸乙酯,降低黄酒中氨基甲酸乙酯的含量。

图2 变幻青霉所产EC降解酶的底物特异性Fig.2 Substrate specificity of urethanase from Penicillium variabile JN-A525
3 结语
作者在单因素研究基础上运用正交研究变幻青霉Penicillium variabile JN-A525产氨基甲酸乙酯降解酶的培养基和发酵条件,使得酶活提高了3.47倍,为后期大规模发酵调控的研究建立了一定的基础。
对初步纯化后的氨基甲酸乙酯降解酶在模拟黄酒体系下的底物特异性的研究,说明了该酶不但可通过作用于尿素,减少其进一步与乙醇生成氨基甲酸乙酯的可能,亦可直接作用于氨基甲酸乙酯,降低黄酒中氨基甲酸乙酯的含量,说明该酶有在黄酒一些微量成分的控制中发挥作用的潜力。
真菌产生的酶系往往非常丰富和复杂,还有周期较长的缺陷,因此课题组将在充分考察其所产酶的特性基础上,进一步采用分辩率较高手段纯化该酶,获得其蛋白质序列,可为其后期的异源高效表达创造良好条件。
[1]吴世嘉,王洪新.发酵食品中氨基甲酸乙酯的研究进展[J].化学与生物工程,2009,26(9):15.WU Shi-jia,WANG Hong-xin.Research advancement of ethyl carbamate in fermented food[J].Chemistry and Bioengineering,2009,26(9):15.(in Chinese)
[2]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindyo building[J].Analytical Biochemistry,1976,72:248.
[3]Ough C S.Ethyl carbamate in fermented beverages and foods:Naturally occuringethyl carbamate[J].Journal of Agricultural and Food Chemistry,1996,24:323-327.
[4]ZHAO C J,Kobashi K.Urethanase in rat tissues[J].Biological Pharmaceutical Bulletin,1994,17:773-778.
[5]Chun J Z,Lisa I,Kyoichi K.Urethanase of Bacillus licheniformis sp.isolated from mouse gastrointestine[J].Chemistry Pharmaceutical Bulletin,1991,9:3303-3306.
[6]WANG B,LI Y F,HUANG C Z.Characterization of interaction of DNA with Hoechst33258 using resonance light scattering spectra and their analytical application[J].Journal of Southwest University:Natural Science Edition,2008,5:62-66.
[7]LI R T,SU J S,LONG Y F.Resonance light scattering spectrophtometic determination of trace DNA with the system of FYOCTMAB and its analytical application[J].Journal of Hunan University of Science and Technology:Natural Science Edition,2007,3:109-112.
[8]高年发,宝菊花.氨基甲酸乙酯的研究进展[J].中国酿造,2006,9:1-4.GAO Nian-fa,BAO Ju-hua.Research advancement of ethyl carbamate[J].China Brewing,2006,9:1-4.(in Chinese)
[9]王斌,李原芳,黄承志.双苯甲亚胺与DNA作用的共振光散射特征及其分析应用[J].西南大学学报:自然科学版,2008,5:62-66.WANG Bin,LI Yuan-fang,HUANG Cheng-zhi.Characterization of interaction of DNA with Hoechst33258 using resonance light scattering spectra and their analytical application[J].Journal of Southwest University:Natural Science Edition,2008,5:62-66.(in Chinese)
[10]李韧韬,苏界殊,龙云飞.固黄O-CTMAB-DNA三元体系的共振光散射光谱的研究及应用[J].湖南科技大学学报:自然科学版,2007,3:109-112.LI Ren-tao,SU Jie-shu,LONG Yun-fei.Resonance light scattering spectrophtometic determination of trace DNA with the system of FYO-CTMAB and its analytical application[J].Journal of Hunan University of Science and Technology:Natural Science Edition,2007,3:109-112.(in Chinese)
[11]周景文,堵国成,陈坚.发酵食品有害氨(胺)类代谢物:形成机制和消除策略[J].中国食品学报,2011,11(9):8.ZHOU Jing-wen,DU Guo-cheng,CHEN Jian.Harmful amines (ammonia) metabolites in fermented foods:formation mechanism and the elimination strategy[J].Journal of Chinese Institute of Food Science and Technology,2011,11(9):8.(in Chinese)
[12]刘俊,赵光鳌,徐岩.黄酒中氨基甲酸乙酯直接减除技术的研究[J].食品与生物技术学报,2011,31(2):171-175 LIU Jun,ZHAO Guang-ao,XU Yan.Directly removal of ethyl carbamate in Chinese rice wine[J].Journal of Food Science and Biotechnology,2011,31(2):171-175 (in Chinese)
[13]CHUN J Z,Kyoichi K.Purification and characterization of iron-containing urethanase from Bacillus lichenifrmis[J].Biological Pharmaceutical Bulletin,1994,17(6):773-778.
[14]Mohapatra B R,Bapuji M.Characterization of urethanase from Micrococcus species associated with the marine sponge(Spirasfrella species)[J].Letters in Applied Microbiology,1997,25:393-396.
[15]王秀奇.基础生物化学实验[M].北京:高等教育出版社,1999:177-181.
