蕤核叶总黄酮分离纯化工艺的研究
2013-01-30韩蕾赵国建李雪姣邰源临魏学智
韩蕾,赵国建,李雪姣,邰源临,魏学智,*
(1.山西师范大学生命科学学院,山西临汾041004;2.山西师范大学工程学院,山西临汾041004 3.水利部水土保持植物开发管理中心,北京100083)
蕤核(Prinsepia uniflora Batal.)又名蕤李子(救荒本草),扁禾木(树木分类学),茹茹(山西)等,属蔷薇科(Rosaceae) 李亚科(Prunnoideae focke) 扁核木属(Prinsepia Royle)的落叶灌木。主要分布于河南、山西、陕西、内蒙古等省区,生长在900 m~1 100 m 山坡阳处或山脚下,是喜光、耐旱、耐寒的阳性树种。果实风味独特,酸甜适口,果仁可入药,养肝明目,是一种具有经济价值野生植物资源[1]。黄酮类化合物(flavonoids)是高等植物体内普遍存在的一大类重要的次生代谢产物,对人类的衰老、肿瘤、心血管等疾病的预防和治疗具有重要意义[2-3]。
目前有关蕤核黄酮类物质的研究报道甚少[4],对总黄酮分离纯化的工艺条件未见报道,因此本试验选取4 种大孔树脂进行静态吸附解吸及静态动力学研究,筛选出最佳的树脂类型并确定其最佳工艺条件,为蕤核叶总黄酮的分离纯化奠定了理论基础。
1 材料与方法
1.1 材料
供试材料蕤核叶片,于2011年8月采自山西省临汾市龙祠村。叶片除杂、洗净、烘干,用粉碎机粉碎,过60 目筛置于塑封袋中备用。
1.2 仪器
RE-52A 型旋转蒸发仪:上海青浦沪西仪器厂;SHB-Ⅱ型循环水式多用真空泵:郑州长城科工贸有限公司;721 型可见分光光度计:上海天普分析仪器有限公司;101-3BS 型电热鼓风干燥箱:金坛市荣华仪器有限公司。
1.3 方法
1.3.1 树脂的预处理
用无水乙醇浸泡24 h,使树脂充分溶脂,以湿法装柱,乙醇洗脱至流出液乙醇-水(1 ∶5)不成白色浑浊为止,然后用蒸馏水洗至无醇味,取出树脂备用[5]。
1.3.2 蕤核叶总黄酮提取液制备和含量测定
取叶片粉末适量,按料液比1 ∶25,体积分数为60 %乙醇在70 ℃超声波仪器中,辅助提取50 min 后抽滤,重复3 次,合并滤液浓缩,用石油醚反复萃取直到醚相基本无色,去除色素等脂溶性的杂质,水相用3 倍~4 倍量95 %乙醇沉淀去除多糖、蛋白质等杂质[6]。
测定含量参照梁晓华[7]的方法,以芦丁为标准品,510 nm 处测吸光值,绘制标准曲线,得到回归方程:A=0.011 3C+0.000 5(R2=0.999 8),式中:C 为总黄酮浓度,(mg/L);A 为吸光度。
1.3.3 静态吸附与解析
准确称取处理好的4 种树脂1 g 置于100 mL 锥形瓶中,加入黄酮提取液45 mL,封口后,室温下振荡24 h,使其充分吸附后,吸取上层液按1.3.2 的方法测定黄酮浓度。将静态吸附饱和后的4 种树脂抽滤干,转至另4 个干净的100 mL 锥形瓶中,加入60%乙醇溶液45 mL,封口后,室温下振荡解吸24 h,同法测定解吸液中黄酮浓度。计算各大孔树脂对蕤核叶片黄酮的静态吸附量、解吸率[8]。
吸附量(mg/g)=(提取液浓度-吸附后剩余溶液浓度)×上样液体积/树脂质量
解吸率=[解吸液浓度×洗脱液体积/(提取液浓度-吸附后剩余溶液浓度)×上样液体积]×100%
1.3.4 静态吸附动力学分析
准确称取处理好的大孔树脂1.00 g 于100 mL 锥形瓶中,加入45 mL 提取液后振荡至吸附平衡,每隔1 h 取上层液测定吸光值,绘制吸附动力学曲线。
1.3.5 最适树脂分离纯化黄酮的工艺条件
1.3.5.1 提取液pH 的筛选
取2 g 预处理后的树脂于100 mL 锥形瓶中,分别加入pH2.0、3.0、4.0、5.0、6.0、7.0、8.0 的提取液,吸附饱和后测定黄酮的浓度,计算不同pH 条件下树脂的吸附量。
1.3.5.2 上样液浓度的筛选
取2 g 预处理后的树脂于100 mL 锥形瓶中,依次加入50 mL 不同浓度的提取液1、2、3、4、5 mg/mL,充分吸附后测定黄酮浓度。
1.3.5.3 上样量的筛选
取2 g 预处理后的树脂于100 mL 锥形瓶中,分别加入10、16、20、26、30 mL 的提取液,充分吸附后测定黄酮的浓度。
1.3.5.4 洗脱剂浓度的筛选
将经过预处理的树脂湿法装柱,按照已确定的最佳条件上样,充分吸附后,蒸馏水洗至无糖反应(Molish 反应),用浓度分别为30%、40%、50%、60%、70%、80%的乙醇溶液洗脱,洗脱流速为2 mL/min,测定黄酮的浓度。
1.3.5.5 洗脱剂用量的筛选[9]
按照最佳条件上样、吸附和洗脱,洗脱速度为2 mL/min,每收集0.5 BV 体积测定其黄酮的浓度,共收集6 BV 体积,绘制洗脱曲线,确定洗脱剂的用量。
2 结果与分析
2.1 4 种树脂的静态吸附率和解析率
4 种树脂的静态吸附率和解析率,结果见表1。
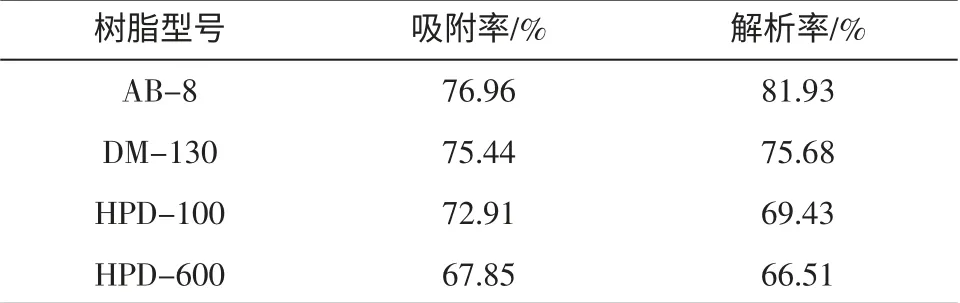
表1 不同型号树脂饱和吸附率和解析率Table 1 Adsorption capacity and desorption rate of different kinds of macroporous resins
大孔吸附树脂的纯化是利用特殊的吸附剂-大孔吸附树脂的吸附性和分子筛相结合的原理,从提取液中有选择地吸附住有效成分,去除杂质[10-11]。不同的树脂对于黄酮的纯化效果不同,为了更大限度的回收有效成分黄酮,考察树脂的吸附率和解析率尤为重要。由表1 可知,大孔树脂AB-8 吸附率为76.96%,DM-130 吸附率为75.44%,两种树脂的吸附效果接近,从解析率来看,AB-8 的解析率明显的高于另外3 种树脂,达到81.93%。基于试验结果和综合考虑,初步确定AB-8 大孔树脂是纯化蕤核叶总黄酮的最佳树脂。
2.2 静态吸附动力学曲线
对大孔树脂进行吸附动力学研究,结果见图1。
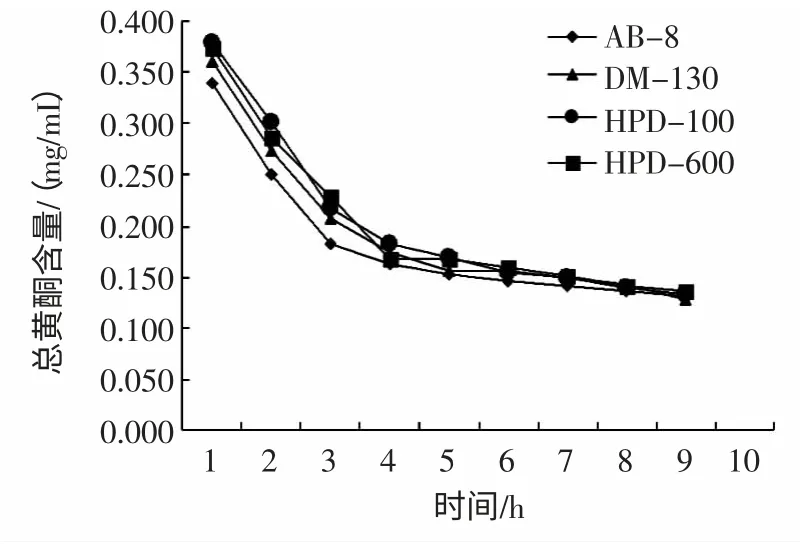
图1 静态动力学曲线Fig.1 Static adsorption curvc of total flavonoids
由图1 可知,4 种树脂在4 h 内吸附速度较快,4 h~5 h 基本达到饱和,5 h 后黄酮浓度趋于平稳,其中大孔树脂AB-8 对蕤核叶黄酮的吸附能力最强,结合上述树脂的吸附率和解吸率,适合纯化黄酮类物质不仅有较好的吸附能力,而且有较好的解吸能力,同时节约时间,在工业化生产中能提高生产效率。所以选择AB-8 型大孔树脂作为纯化蕤核叶总黄酮的树脂。
2.3 AB-8 纯化蕤核叶总黄酮工艺的确定
2.3.1 提取液pH 的筛选
黄酮类化合物是多羟基酚类,成弱酸性,在弱酸或酸性条件下吸附效果较好[12]。提取液pH 的不同,树脂对蕤核叶总黄酮的吸附效率也不同,结果见图2。
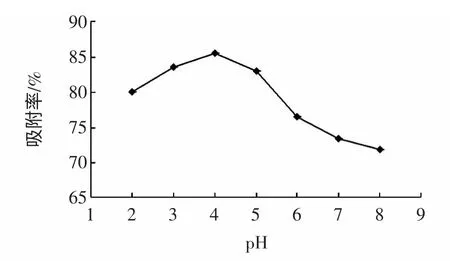
图2 提取液pH 对吸附量的影响Fig.2 Effect of pH value sample solution on adsorption
由图2 可知,提取液的pH 为4 时吸附率最高,随着pH 的增大,吸附率降低,所以确定提取液pH 为4时吸附效果最好。
2.3.2 上样液浓度的筛选
上样液浓度对吸附量的影响见图3。
从图3 上样液浓度对吸附量的影响曲线中可以看出,随着蕤核叶总黄酮提取液浓度的增加,树脂的吸附量先升后降,当浓度达到2 mg/mL 时,吸附量最大,之后吸附量出现了降低的趋势,所以蕤核叶总黄酮的浓度在1 mg/mL~2 mg/mL 时吸附效果最佳。
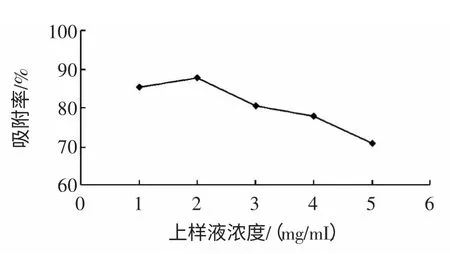
图3 上样液浓度对吸附量的影响Fig.3 Effect of sample concentration on adsorption
2.3.3 上样量的筛选
上样液量与树脂比对吸附量的影响见图4。
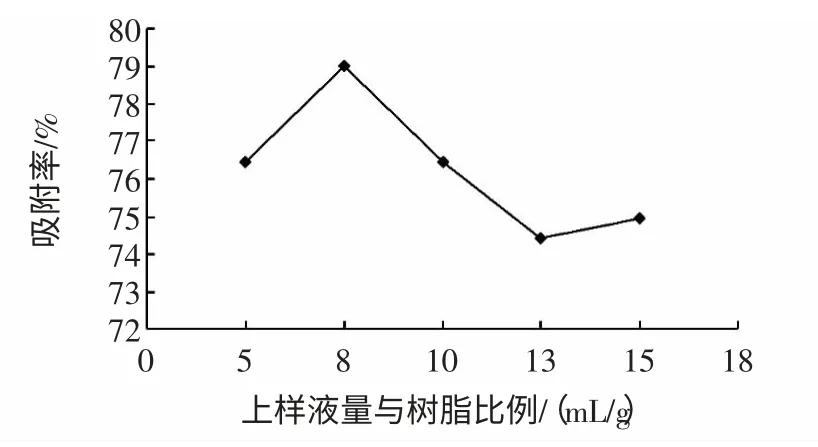
图4 上样液量与树脂比对吸附量的影响Fig.4 Effect of ratio sample solution to resin on adsorption
由图4 显示,在树脂量一定的情况下,添加同一浓度不同量的上样量,上样量与树脂的比为8 ∶1 时吸附量最大。上样量少时,吸附量大,但纯化周期长,上样量多时,达到树脂的饱和吸附量后,会造成部分黄酮的损失,树脂吸附率降低。所以上样量与树脂的比例为8 ∶1 时吸附效果最佳。
2.3.4 洗脱剂浓度的筛选
洗脱剂浓度对解吸率的影响见图5。
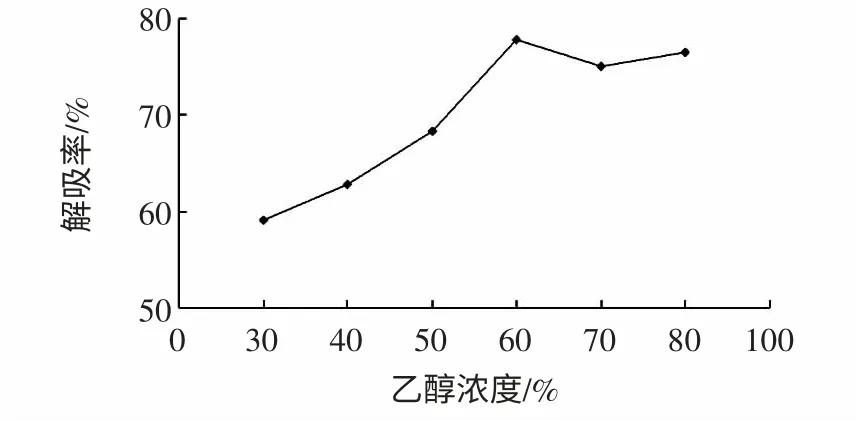
图5 洗脱剂浓度对解吸率的影响Fig.5 Effect of eluent concentration on desorption rate
由图5 可知,不同浓度的乙醇溶液洗脱的效果不同,乙醇浓度达到60%时洗脱率最高,继续增加乙醇浓度,洗脱率的变化不大,考虑到溶剂成本,确定60%的乙醇溶液是最佳洗脱溶剂。
2.3.5 洗脱剂用量的筛选
洗脱剂用量影响见图6。
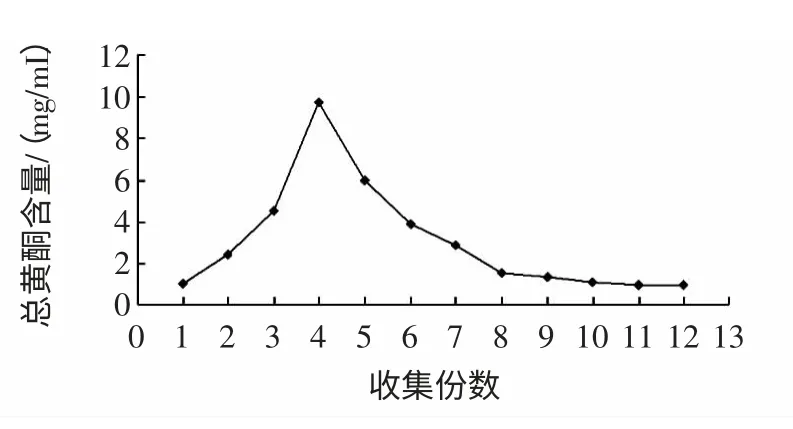
图6 洗脱剂用量的影响Fig.6 Effect of eluent solvent amount
在树脂的洗脱过程中,洗脱剂的用量过少时,黄酮不能完全被洗脱,用量太多,对于后期的浓缩带来不便,也会造成时间过长和试剂的浪费。由图6,在收集的第3 份至第6 份洗脱液为清澈的黄色溶液,此时总黄酮浓度最大。随着洗脱剂用量的增加,洗脱液颜色逐渐变浅,当收集到第8 份时洗脱液几乎无色,经检测黄酮含量极少,即第8 份已被完全洗脱,以树脂体积计,洗脱剂约为4 BV。
3 讨论与结论
大孔吸附树脂是由可聚合成分与添加剂经悬浮或反悬浮聚合反应制备而成,具有大孔结构的高分子吸附分离材料。其吸附作用源于范德华力或氢键作用,吸附选择性源于其中的功能基及其网状结构的筛分性能[13]。因此树脂的筛选至关重要。大孔吸附树脂具有吸附容量大、吸附速度快、再生方便等优点,已被广泛应用于医药工业、化学工业、分析化学等领域[14]。
本文通过4 种树脂对蕤核叶总黄酮吸附和解吸性能的分析,综合考虑吸附率、解析率和静态吸附动力学三方面因素,筛选出AB-8 型树脂最适合于蕤核叶总黄酮的分离纯化。接着对影响纯化效果的工艺参数进行了研究,首次对上样液浓度、上样液用量、洗脱剂的浓度、洗脱剂的用量等因素的研究,得到AB-8 树脂最佳纯化工艺条件:提取液pH 为4,吸附时间4 h,上样液的浓度为1 mg/mL~2 mg/mL,上样量与树脂之比8 ∶1;洗脱剂选用60%乙醇,用量4 BV。通过实验结果分析,应用AB-8 型大孔树脂纯化的最佳工艺条件,蕤核叶总黄酮的纯度由15.3%提高到48.6%。
本试验在纯化处理之前,对粗提液进行了石油醚脱脂等预处理,有效防止叶绿素及其杂质造成树脂的污染和堵塞,提高树脂纯化效果并降低成本。
[1] 斯琴,敖特根,布仁吉雅,等.蕤核果实营养成分分析[J].内蒙古草业,2007,19(1):55-63
[2] Chung H S,chang L C,Lee S K,et al, Flavonoid Constituents of Chorizanthe diffusa with Potential Cancer Chemopreventive Activity[J].J Agric Food Chem,1991,471:36-41
[3] Middleton J R.Biological properities of plant flavonoid:anovrview[J].Int J P Harmacognos,1996,34:344-348
[4] 张秀秀,魏学智,张强,等.响应面法优化蕤核叶片总黄酮提取工艺[J].中国野生植物资源,2011,30(2):27-31
[5] 尹蓉莉,江靖,张淑儒,等.大孔吸附树脂纯化白芍总苷的工艺研究[J].中医药信息,2002,19(2):23-25
[6] 睢玉祥,张家铭,穆楠,等.翅果油树叶总黄酮分离纯化工艺研究[J].植物研究,2010,30(3):373-378
[7] 梁晓华,徐成东,王陆琴.云南13 种蕨类植物中总黄酮的测定[J]. 安徽农业科学, Journal of Anhui Agri Sci,2008,36(19):7965-7966
[8] 赵占义,孙学斌,陈明刚,等.大孔树脂纯化卫矛总黄酮的工艺研究[J].植物研究,2009,29(1):124-128
[9] 李瑞光,刘邻渭,郑海燕,等.大孔树脂分离纯化芦苇叶总黄酮[J].食品研究与发,2009,30(3):60-64
[10] 何琳.陕北荞麦麸皮中黄酮类化合物的提取及纯化研究[D].陕西:陕西科技大学,2011
[11] 于智峰,王敏,金颖.大孔吸附树脂对苦荞黄酮吸附分离特性研究[J].食品研究与开发,2006,27(11):1-4
[12] 吴春,陈林林.大孔吸附树脂分离纯化菟丝子黄酮的研究[J].中草药,2006,37(11):163-166
[13] 李洁.大孔吸附树脂在天然产物分离纯化中的应用研究[D].甘肃:兰州理工大学,2010
[14] 于智峰,王敏.大孔吸附树脂在黄酮类化合物分离中的应用[J].中药材,2006,29(12):1380-1384
