玉竹三种提取物抗氧化活性比较
2013-01-30林奇泗李京华杨冬芝王慧
林奇泗,李京华,杨冬芝,王慧
(1.徐州医学院药学院,江苏徐州221004;2.沈阳药科大学药学院,辽宁沈阳110016)
中药玉竹别名萎蕤、玉参、尾参,为百合科植物玉竹Polygonatum odoratum(Mill.)Druce 的干燥根茎[1]。全国大部分地区有分布,主产河南、江苏、辽宁、湖南、浙江。玉竹最早载于《神农本草经》,列为上品,其味甘性平,入肺、胃经,功能养阴,润燥,除烦,止渴,用于治热病阴伤,咳嗽烦渴,虚劳发热,消谷易饥,小便频数。
玉竹中含有具有挥发性的脂溶性成分[2],本研究用GC-MS 法对玉竹脂溶性成分进行鉴别,以谱库对照进行组分定性。并计算各组分峰的保留指数[3]。玉竹的水提液已被证实具有抗氧化活性[4],其黄酮类和糖类成分的抗氧化活性已有报道[5-7]。本研究提取玉竹脂溶性、多酚类及皂苷类成分进行体外抗氧化活性研究,为玉竹开发应用提供实验参考。
1 仪器与材料
1.1 仪器
QP5050A 气质联用仪、UV-1700 型可见-紫外分光光度计:日本SHIMADZU 公司;H-2 数显恒温水浴锅:浙江省嘉兴市俊思仪器设备厂;SC-97 自动三重纯水蒸馏器、RE-52AA 旋转蒸发仪:上海亚荣生化仪器厂;BS110 电子天平:北京赛多利斯仪器系统有限公司。
1.2 材料
实验用水为沈阳药科大学实验室自制三重蒸馏水;C8-C30正 构 烷 烃、2,4,6-反 式2-吡 啶 基 三 嗪(TPTZ)、福林酚(FC)试剂、2,6-二叔丁基对甲酚(BHT)、购自上海阿拉丁试剂有限公司;其它试剂均为分析纯,购自山东禹王实业有限公司。玉竹药材购自沈阳南塔大药房,经沈阳药科大学中药学院贾景明教授鉴定,为百合科黄精属植物玉竹[Polygonatum odoratum(Mill.)Druce]的干燥根茎,将药材粉碎,过二目筛备用。
2 方法与结果
2.1 样品制备
2.1.1 脂溶性提取物制备
取20 g 玉竹粉末,加入石油醚溶液500 mL,回流提取3 次,每次提取1 h。过滤,合并提取液。旋转蒸发浓缩至近干,转至氮气下吹干,得到脂溶性提取物,称定重量,计算得率。临用时用适量甲醇溶解定容,即得。
2.1.2 总酚酸提取物制备
准确称取干燥玉竹粗粉20 g 加入12 倍量70 %乙醇溶液,80 ℃水浴加热提取1 h,再以10 倍量的一定浓度的乙醇溶液,同样条件提取2 次。提取液过滤合并,50 ℃减压浓缩至无醇味。加入蒸馏水稀释至50 mL,用等量乙酸乙酯萃取5 次,收集乙酸乙酯萃取液。将乙酸乙酯萃取液50 ℃减压浓缩至干,加入蒸馏水20 mL 溶解,再以10%Na2CO3溶液调节pH 至10,在2 000 r/min下离心30 min,取上清液以1%盐酸调pH 至中性,浓缩得到总酚酸提取物,称定重量,计算得率。临用时用适量甲醇溶解定容,即得。
2.1.3 总皂苷提取物制备
准确称取干燥玉竹粗粉20 g 加入12 倍量70 %乙醇溶液,80 ℃水浴加热提取1 h,再以10 倍量的一定浓度的乙醇溶液,同样条件提取2 次。提取液过滤合并,50 ℃减压浓缩至无醇味。加入蒸馏水稀释至50 mL,用等量正丁醇萃取5 次,收集正丁醇萃取液。将正丁醇萃取液挥干,残渣用10 mL 乙醇溶解,加入200 mL丙酮,静置过夜。将溶液过滤,收集沉淀得到总皂苷提取物,称定重量,计算得率。临用时用适量甲醇溶解定容,即得。
2.2 GC-MS 分析
2.2.1 气质条件
色谱柱:HP-5 弹性石英毛细管柱(30 m×0.25 mm×0.25 mm);进样口温度:280 ℃;载气:氦气;流速:1.0 mL/min;分流比5 ∶1;进样量:1 μL;升温程序:柱温120 ℃,保持4 min,以10 ℃/min 升至180 ℃,保持10 min,继续以5 ℃/min 升至240 ℃,保持10 min。电离方式EI,电子轰击能量70 eV,离子源温度200 ℃,接口温度:230 ℃,分辨率1 000,扫描范围(m/Z)33 amu~550 amu。
2.2.2 脂溶性成分鉴别
取2.1.1 项下制得的脂溶性提取物用甲醇定溶至2.0 mL,溶液依GC-MS 条件进行测定。采用美国国家标准局NIST107 定性谱库检索,结合保留指数定性。各色谱峰的保留指数依据公式(1)进行计算。式中t′R(Z),t′R(X),t′R(Z+n)分别代表待测物质x 和具有Z 及Z+n 个碳原子数正构烷烃的相对保留时间。
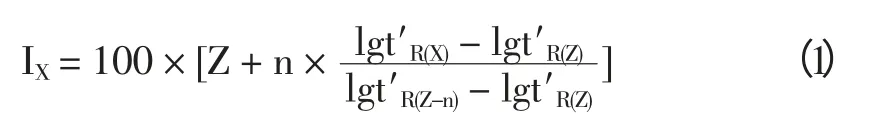
2.3 多酚含量测定
2.3.1 对照品溶液制备
精密称取没食子酸对照品0.050 g,用双蒸水配制成0.1 mg/mL 的没食子酸标准溶液,作为对照品溶液。
2.3.2 福林-酚法测定总酚酸含量[8]
准确移取上述没食子酸标准溶液0.1、0.2、0.3、0.4、0.5、0.6、0.7 mL 于10 mL 棕色容量瓶中,分别用重蒸水补充至2.0 mL,再加入1.0 mL 福林酚试剂,4.0 mL质量百分数26.7%的Na2CO3饱和溶液,充分混匀后用水定容至10 mL,室温下静置2 h,随后于760 nm 波长处测定吸光度。以没食子酸的质量浓度为横坐标,吸光度为纵坐标绘制没食子酸标准曲线。
准确移取2.1.2 项下一定浓度的总酚酸提取物供试品溶液500 μL,用蒸馏水补充至2.0 mL,再加入1.0 mL FC 试剂,4.0 mL 质量百分数26.7 %的Na2CO3饱和溶液,充分混匀后用蒸馏水定容至10 mL,室温下静置2 h,于760 nm 波长处测定吸光度。
2.4 皂苷含量测定
2.4.1 对照品溶液制备
精密称取经干燥至恒重的β-胡萝卜苷对照品6.1 mg,加甲醇溶解定容至25 mL,作为对照品溶液。
2.4.2 硫酸-香草醛法测定总皂苷含量[9]
精密吸取2.1.1 项下对照品溶液0.10、0.15、0.20、0.25、0.30 mL 分别加入10 mL 具塞试管中,按2.1.2 项下的香草醛-高氯酸显色方法后测定吸光值,每个浓度平行测定3 次,以吸光度为纵坐标,以对照品质量为横坐标,绘制标准曲线。
准确吸取玉竹总皂苷提取溶液适量,置于10 mL具塞试管中,沸水浴挥干溶剂,加入0.8 mL 5%香草醛-冰醋酸溶液,再加入3.2 mL 70%硫酸溶液,摇匀,于60.0 ℃水浴加热25 min,立即取出置冰水浴2 min~3 min,加冰醋酸溶剂稀释至5.0 mL,摇匀,以不加对照品的样品管为空白。在544 nm 下测定其吸光度。
2.5 抗氧化活性研究
2.5.1 对DPPH 自由基的清除作用[10]
将2.1 项下玉竹挥发油提取溶液、总皂苷提取溶液、多酚提取溶液稀释为一系列不同浓度受试样品溶液。分别取2.0 mL 待测液与2.0 mL 0.2 mmol/L 的DPPH乙醇溶液混合,振摇均匀后放于暗处静置30 min,于518 nm 处测定吸光度(Ai)。同时测定2.0 mL 0.2 mmol/L DPPH 溶液与2.0 mL 95%乙醇混合液的吸光度(Aj),以及2.0 mL 待测液与2.0 mL 95%乙醇混合液的吸光度(Ac)。按式(2)计算清除率,以BHT 甲醇溶液为阳性对照。根据不同浓度样品的清除率作曲线求出半清除率(EC50),每份样品测定3 次并取平均值。
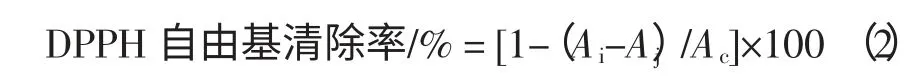
2.5.2 FRAP 法测定总抗氧化能力[11]
2.5.2.1 TPTZ 工作液的配制
(4) 有同学建议,将本实验使用的白炽灯改为LED灯,因为白炽灯产热多,会使不同组之间的温度产生差异而影响实验结果。此建议得到了老师和同学们的一致赞同,这是因为这一改进有利于遵循____________原则。
将2.5 mL 20 mmol/L FeCl3·6H2O,2.5 mL 10 mmol/L TPTZ(以40 mmol/L 盐酸溶解),25 mL 0.3 mmol/L 的醋酸缓冲液(pH3.6),临用前混合,即得。
2.5.2.2 FeSO4标准曲线的制作
分别取不同质量浓度的FeSO4溶液50 μL,各加入3.0 mL 2.1.3 项下配制的TPTZ 工作液,37 ℃水浴30 min,测定597 nm 处的吸光度。以吸光度为纵坐标,FeSO4质量浓度为横坐标绘制标准曲线。
2.5.2.3 FRAP 值测定
准确吸取2.1 项下3 种提取溶液50 μL,加入3.0 mL TPTZ 工作液,37 ℃水浴30 min,测定597 nm 处的吸光度,并计算其FRAP 值,FRAP 值表示为每克供试品消耗的Fe2+毫摩尔数(mmol/g)。
3 结果与讨论
3.1 脂溶性成分鉴别
依2.1.1 项下方法提取玉竹脂溶性提取物,得率为0.039%。按GC-MS 条件进行测定,总离子流图见图1。
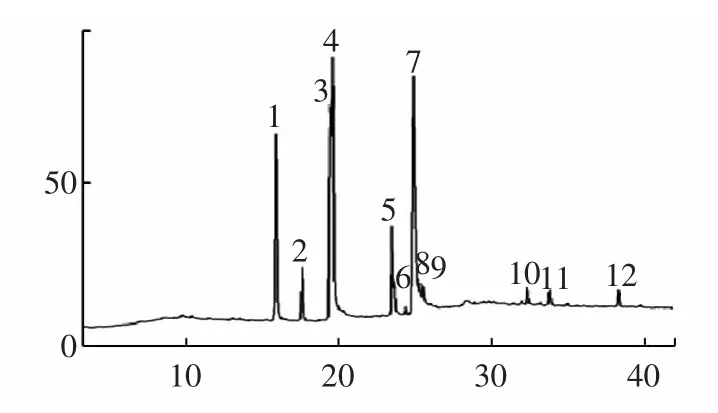
图1 玉竹提取物总离子流图Fig.1 TIC of extraction of Polygonatum odoratum
本研究从玉竹脂溶性提取物中分离得到12 个峰,鉴定了其中6 种组分,占总峰面积的91.0%,结果见表1。
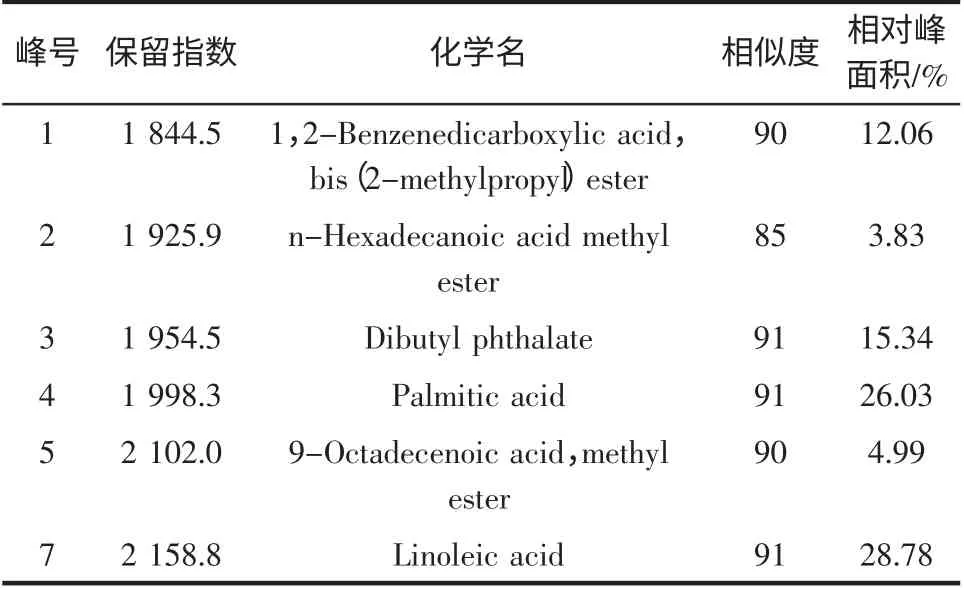
表1 玉竹提取物GC-MS 分析Table 1 Major components of extraction of Polygonatum odoratum
因加热时间和温度的影响,故必定有部分成分损失,与文献报道的挥发性成分组成有所不同[2]。
3.2 总酚酸提取物中多酚含量
以没食子酸质量浓度(μg/mL)为横坐标,吸光度为纵坐标,得回归方程y=11.690 0x+0.068 2(R=0.999 2)。总酚酸提取物得率为0.186 %,多酚含量以每克总酚酸提取物相当于没食子酸的毫克数计为(19.40±0.245)mg/g。
3.3 总皂苷提取物中皂苷含量
以加入的β-胡萝卜苷质量(mg)为横坐标,吸光度为纵坐标,得线性回归方程y=7.947 5x+0.061 5,(R=0.999 1)。总皂苷提取物得率为0.062%,皂苷含量以每克总皂苷提取物相当于β-胡萝卜苷的毫克数计为(282.63±9.789)mg/g。
3.4 3 种提取物抗氧化活性比较
3.4.1 对DPPH 自由基的清除作用
以BHT 为对照,分别测出玉竹一系列不同浓度提取物吸光度Ai,Aj,Ac,根据公式(1)计算出其相应的自由基清除率,以清除率为纵坐标,以质量浓度(mg/mL)为横坐标,结果见图2。
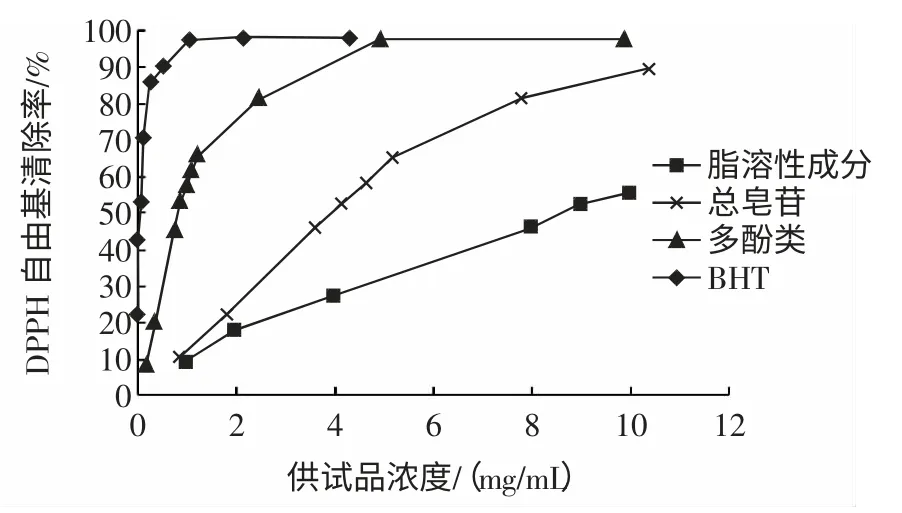
图2 提取物DPPH 清除率测定结果Fig.2 DPPH radical scavenging activities of the extracts from Polygonatum odoratum
从图2 可看出,自由基清除率随着加入量的增加而增加,但随着抗氧剂浓度的增加,其捕获的DPPH 自由基也越多,逐渐达到饱和状态,变化也逐渐趋于缓慢。
半清除率(EC50)测定结果见表2。
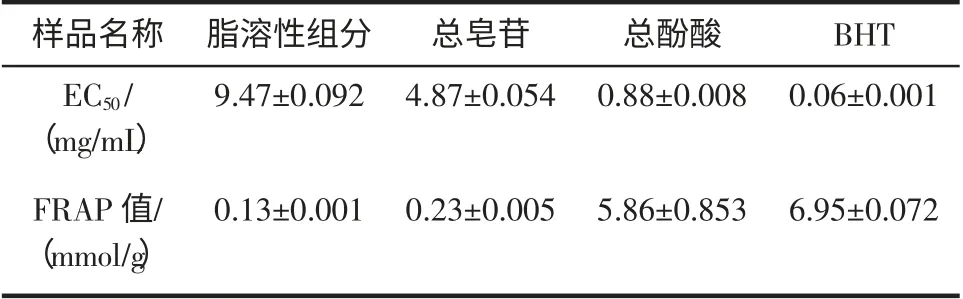
表2 玉竹不同提取物抗氧化活性比较Tab.2 Antioxidant activity of the different extracts from Polygonatum odoratum
EC50越小,则其对DPPH 自由基的清除活性越强。由表2 可知,玉竹各提取物的DPPH 清除能力顺序为:脂溶性提取物<总皂苷提取物<总酚酸提取物 3.4.2 FRAP 法测定抗氧化能力试验结果 实验确定了以FeSO4为对照品的总还原能力标准曲线方程y=0.195x+0.003(r=0.999 2)。由此得出玉竹各种提取物的FRAP 值结果见表2。而玉竹各提取物FRAP 值大小次序为:脂溶性提取物<总皂苷提取物<总酚酸提取物 本研究分别提取了玉竹的脂溶性成分、多酚和总皂苷。由本研究可知,玉竹脂溶性成分、皂苷类成分和多酚类成分都具抗氧化活性。在这3 种提取物中,脂溶性成分抗氧化活性最弱,且含量最低;玉竹多酚类成分的报道较少,但抗氧化活性强于玉竹皂苷类成分。 [1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010:78 [2] 彭秧锡,陈启元,钟世安,等.玉竹的不同溶剂提取物中化学成分的GC-MS 对比分析[J].天然产物研究与开发,2006,18(5):775-777 [3] B D Sˇkrbié.Unified retention concept-statistical treatment of Kova'ts retention index[J].Journal of Chromatography A,1997,764(2):257-264 [4] 徐大量,林辉,李盛青,等.玉竹水提液体内外抗氧化的实验研究[J].中药材,2008,31(5):729-731 [5] 张轩铭,王冬梅,王瑾,等.不同产地玉竹黄酮提取物体外抗氧化活性研究[J].西北植物学报,2011,31(3):628-631 [6] 陈双,张娜,牛付阁.玉竹糖蛋白体内抗氧化作用研究[J].食品与药品,2012,14(7):250-253 [7] 阎欲晓, 石庆师.玉竹多糖分离纯化及自由基清除能力研究[J].食品工业科技,2009,30(2):149-151 [8] Gene E Lester,Kim S Lewers,Marjorie B Medina,et al.Comparative analysis of strawberry total phenolics via Fast Blue BB vs. Folin-Ciocalteu: Assay interference by ascorbic acid[J]. Journal of Food Composition and Analysis,2012,27(1):102-107 [9] Moyo M, Amoo S O, Ncube B, et al. Phytochemical and antioxidant properties of unconventional leafy vegetables consumed in southern Africa[J].S Afr J Bot,2013,84(1):65-71 [10] Huang D,Ou B,Prior R L.The chemistry behind antioxidant capacity assays[J].Journal of Agriculture and Food Chemistry,2005,53(6):1841-1856 [11] Lalit Giri,Praveen Dhyani,Sandeep Rawat,et al.In vitro production of phenolic compounds and antioxidant activity in callus suspension cultures of Habenaria edgeworthii: A rare Himalayan medicinal orchid[J].Industrial Crops and Products,2012,39(1):1-64 结论
