萱草总黄酮体外抗氧化研究
2013-01-30白雪松张晶莹李善姬
白雪松,张晶莹,李善姬
(1.吉林医药学院营养教研室,吉林吉林132013;2.吉林省卫生检测检验中心,吉林长春130062)
萱草又名金针菜,黄花菜、忘忧草,为百合科萱草属多年生草本植物,原产于中国南部及日本,其根、叶、茎、花在东亚地区作为食品和传统的药品已有几千年的历史[1]。萱草营养丰富,含有糖类、蛋白质、维生素、无机盐及多种人体必需的氨基酸。在现代生活中,萱草与香菇、木耳、冬笋一起被称为蔬菜类中的四大珍品[2]。《本草纲目》记载黄花菜有利胸膈、五脏、轻身明目、治小便赤涩、解烦热、除酒瘟、令人好欢无忧等药效。黄酮乃植物中广泛存在的一种有效成分,具有保肝抗炎、镇定补脑、延缓衰老、抗氧化自由基活性作用,此外还有降压、降血脂、提高机体免疫力等药理活性[3]。因此近年来黄酮类化合物成为了新药开发研究中的一个非常重要的资源,具有广阔的开发应用前景。
目前对萱草总黄酮的研究主要集中在提取工艺的研究,关于其抗氧化活性的研究尚未见到报道。本文对萱草总黄酮体外抗氧化作用进行了初步研究,以期为萱草资源在抗氧化功能食品、药品及天然抗氧化剂的研究及开发领域服务。
1 材料与仪器
1.1 材料
萱草:购自吉林市;2-D-脱氧核糖(2-Deoxy-Dribose,购自Sigma 公司,CAS:533-67-5);芦丁标准品(中国药品生物制品检定所,CAS:153-18-4);无水乙醇、乙醚、硫酸亚铁、磷酸氢二钠、磷酸氢二钾、氯化钾、三氯乙酸、2-硫代巴比妥酸蔗糖、抗坏血酸、过氧化氢等试剂均为国产分析纯。
1.2 仪器
UV-1800 紫外分光光度计:日本岛津;ZN-500A高速中药粉碎机:长沙市岳麓区中南制药机械厂;KQ-100DB 数控超声波清洗器:昆山市超声仪器有限公司;TD5A 台式低速离心机:湖南省凯达实业发展有限公司;HHS 电热恒温水浴锅:上海博讯实业有限公司医疗设备厂;SHB-111A 循环水式多用真空泵:上海豫康科教仪器设备有限公司;202-1 电热恒温干燥箱:天津市泰斯特仪器有限公司。
2 方法
2.1 萱草总黄酮的提取
称取干燥粉碎的萱草粉100 g,用乙醚在60 ℃下脱脂脱色4 h,脱脂后的萱草粉按料液比1 ∶20 加入60 %乙醇,60 ℃超声浸取40 min,提取液离心10 min(3 000 r/min)上清液即为黄酮提取液,将黄酮提取液置旋转蒸发仪浓缩并用60%乙醇定容至50 mL,稀释500 倍,取1 mL 稀释液于360 nm 处的吸光度,按下列公式计算黄花菜总黄酮含量:总黄酮含量=[样品中相当于标准芦丁浓度(μg/mL)×稀释倍数×100]/[萱草样品质量(g)×测定用样品的体积(mL)×1 000]×100%。
标准曲线的绘制精确称取10 mg 已烘至恒重芦丁标样,以60%乙醇溶液溶解并定容至50 mL,摇匀即得浓度为0.2 mg/mL 标样储备液。取芦丁标样储备液5.00 mL 于25 mL 容量瓶中,用质量分数60%乙醇溶液定容,用紫外分光光度计在190 nm~400 nm 范围内进行吸光度扫描,2 次扫描重复平均,最大特征吸收峰为360 nm。分别移取0.0、0.5、1.0、1.5、2.0、2.5 mL 芦丁标样储备液于6 个10 mL 容量瓶中,加入质量分数60%的乙醇溶液定容,在360 nm 处测定吸光度。以浓度对吸光度进行回归,计算回归方程和相关系数。
2.2 抑制DPPH·作用测定
采用改进的Nagai 法[4],样品组取各浓度黄酮样品提取液(20.0、40.0、60.0、80.0、100.0 μg/mL)2.0 mL,分别加入4.0 mL DPPH·60%乙醇溶液,混匀,放置30 min。于波长517 nm 处测定吸光度值,记为A样品,对照组以60%乙醇代替黄酮提取液,加DPPH·60%乙醇溶液4.0 mL,混匀,测吸光度值,记为A对照,同时设立空白组,取各浓度黄酮样品提取液2.0 mL,加入60%乙醇溶液4.0 mL,混匀,测吸光度值,记为A空白。每个试样做3 次平行,取平均值,根据如下公式计算抑制率。

2.3 清除·OH 作用测定
·OH 清除活性的测定采用2-脱氧核糖氧化法[5],每支试管分别加入5 mmol/L FeSO4,5 mmol/L EDTA,5 mmol/L 2-D-脱氧核糖各0.2 mL,与0.2 mL 不同浓度黄酮样品混合,加入0.1 mol/L PBS 缓冲液(pH7.4)1.0 mL,0.2 mL 的5 mmol/L H2O2,37 ℃水浴4 h,加1.4%三氯乙酸、0.5%硫代巴比妥酸各1 mL。沸水浴10 min后迅速冷却至室温。波长532 nm 处测定各管的吸光度值A样品。与样品组对比,空白组不加2-D-脱氧核糖,对照组60%乙醇代替样品,测得的吸光度为A对照。

2.4 对H2O2 诱导肝匀浆脂质过氧化的影响
取小鼠肝组织,用冷生理盐水洗净,冰浴下匀浆,制成1%(质量体积比)的悬浮液。取1%肝匀浆2 mL,加入样品0.4 mL,再加入6 mmol/L FeSO40.2 mL,60 mmol/L H2O20.2 mL,对照组加0.4 mL 的60%无水乙醇,阳性对照组与以各黄酮溶度一致的VC溶液代替测得的吸光度分别是A样品,A对照,A空白。37 ℃温育1 h 后,加入15%三氯乙酸2.0 mL,终止反应,以3 000 r/min 离心10 min,取上清液,加0.67%硫代巴比妥酸2.0 mL,沸水浴15 min,流水冷却,测定532 nm 处的吸光度值。
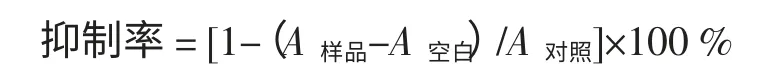
2.5 对H2O2 所致的红细胞氧化溶血的影响
将小鼠断头取血,肝素抗凝,2 000 r/min 离心10 min得取沉淀即为红细胞,用冷生理盐水洗涤3 次,直至上层澄清无红色,制成0.5%红细胞悬液(质量体积比)。取悬液4 mL 加入不同浓度的样品0.2 mL,混匀后加入0.1 mL 100 mmol/LH2O2启动反应,37 ℃温育1 h 后,2 000 r/min 离心10 min,加入4 mL 生理盐水稀释后于415 nm 波长下测定吸光度值。以0.1 mL 100 mmol/L H2O2+5%红细胞+60%乙醇溶液为对照组,以与各黄酮提取液一致的溶度的VC溶液代替黄酮提取液作为阳性对照组。

2.6 数据处理
所有实验数据数据处理采用Excel 数据库录入数据并用SPSS11.5 软件进行分析,不同实验组间采用t检验。
3 结果与讨论
3.1 萱草总黄酮的提取
经紫外分光光度计分析,芦丁标准品线性回归方程为Y=36.121 4X+0.546 6,R=0.999 9。经计算,萱草总黄酮含量为0.536%。
3.2 萱草总黄酮抑制DPPH·作用
DPPH·自由基是一种稳定的自由基,其最大的吸收波长为517 nm。DPPH·自由基遇到提供质子的物质如抗氧化剂时就会被清除,表现为吸光度的降低[6]。基于这个原理,物质的抗氧化活性可以用其清除DPPH·自由基的能力来表示。结果见表1。
表1 萱草总黄酮对DPPH·抑制作用(±s,n=3)Table 1 Inhibition effect of DPPH·by total flavonoids from Hemerocallis fulva L(±s,n=3)
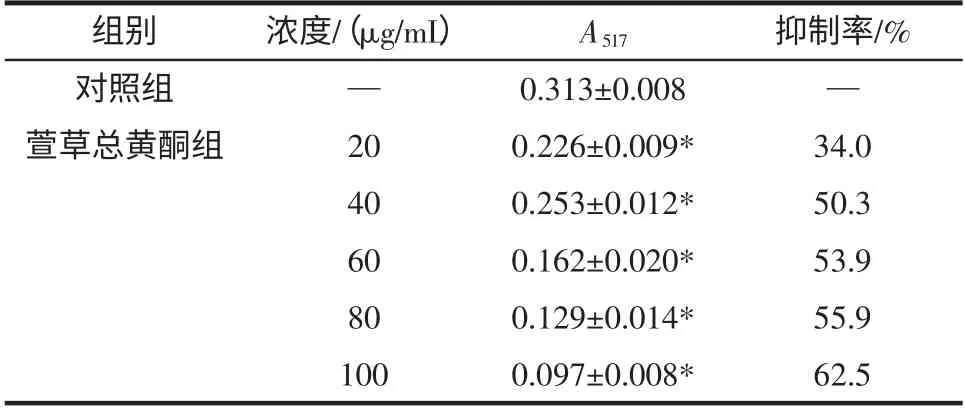
表1 萱草总黄酮对DPPH·抑制作用(±s,n=3)Table 1 Inhibition effect of DPPH·by total flavonoids from Hemerocallis fulva L(±s,n=3)
注:*萱草总黄酮组与对照组比较,P<0.05;“—”表示空白。
?
由表1 数据可知,萱草总黄酮提取液对DPPH·具有较高抑制作用,在20 μg/mL~100 μg/mL 范围内可见,随浓度的增加,对DPPH·的抑制率明显增强,且抑制率与黄酮的浓度呈一定量效关系。
3.3 萱草总黄酮清除·OH 作用
·OH 是目前所知活性氧中对生物体危害最大的一种自由基,对细胞内DNA 的破坏作用最大。活性氧所导致的DNA 损伤在细胞里的积累被认为是机体老化的主要原因[7],因此研究·OH 的清除作用具有重要的应用价值。萱草总黄酮自身可作为优良供氢体,向活泼自由基提供氢后,通过共振杂化与其它自由基结合成稳定二聚体,抑制率值越大表明供氢能力越强,即还原能力越强,越能发挥抗氧化作用。结果见表2。
表2 萱草总黄酮对·OH 抑制作用(±s,n=3)Table 2 Inhibition effect of·OH by total flavonoids from Hemerocallis fulva L(±s,n=3)
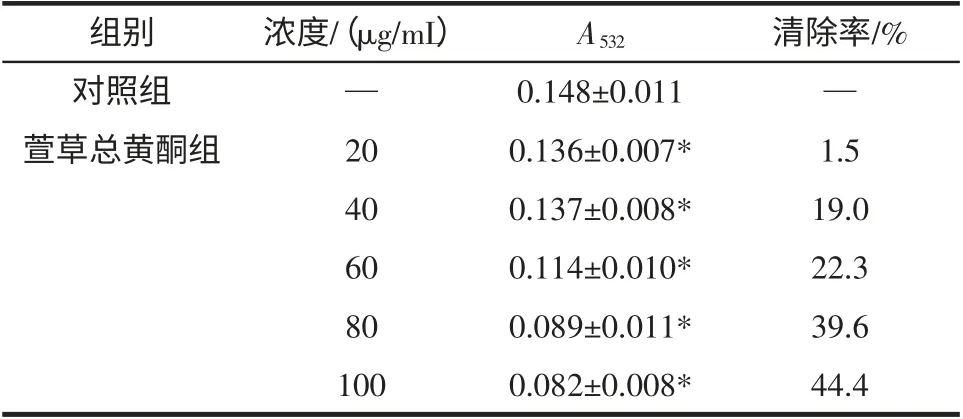
表2 萱草总黄酮对·OH 抑制作用(±s,n=3)Table 2 Inhibition effect of·OH by total flavonoids from Hemerocallis fulva L(±s,n=3)
注:*萱草总黄酮组与对照组比较,P<0.05;“—”表示空白。
?
由表2 数据可知,萱草总黄酮在较低浓度20 μg/mL时,对·OH 有较弱清除作用,但随着浓度的增加,清除率逐渐增加,且清除率与黄酮的浓度呈一定量效关系。
3.4 萱草总黄酮对H2O2 诱导肝匀浆脂质过氧化的影响
硫代巴比妥酸法[8]测定脂质过氧化物的原理是基于一分子丙二醛可与两分子硫代巴比妥酸发生缩合反应,在酸性条件下形成在波长532 nm 处有最大吸收的红色化合物。丙二醛(MDA)是脂质过氧化的降解产物之一,其含量变化可间接反映被测体系中发生脂质过氧化的程度。结果见表3。
表3 萱草总黄酮对H2O2 诱导肝匀浆脂质过氧化影响(±s,n=3)Table 3 Inhibition effect of H2O2 induced lipid peroxidation by total flavonoids from Hemerocallis fulva L(±s,n=3)
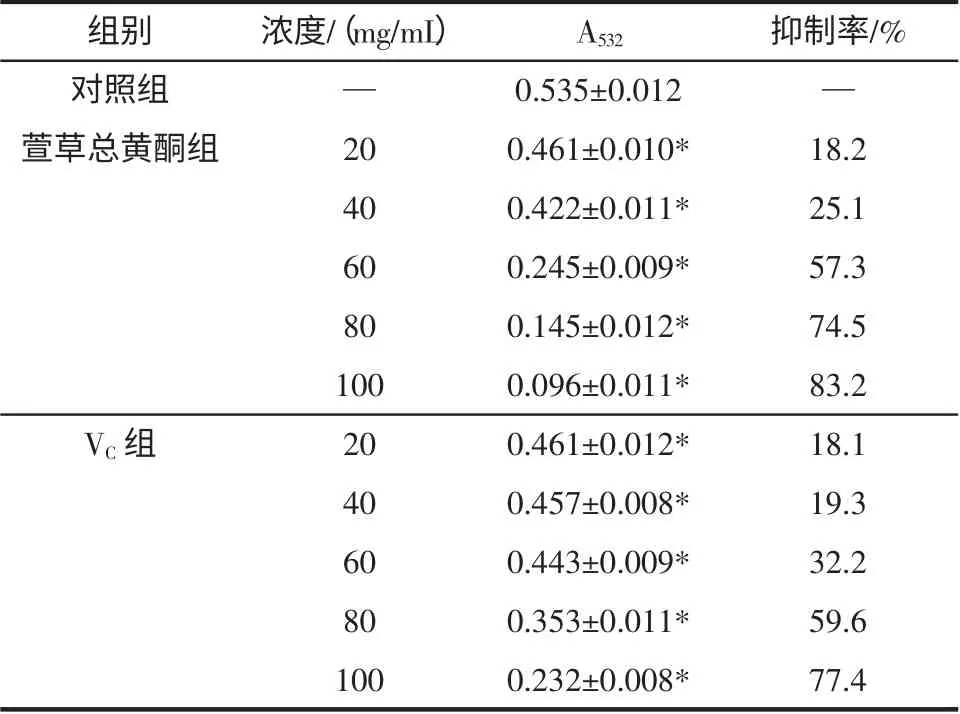
表3 萱草总黄酮对H2O2 诱导肝匀浆脂质过氧化影响(±s,n=3)Table 3 Inhibition effect of H2O2 induced lipid peroxidation by total flavonoids from Hemerocallis fulva L(±s,n=3)
注:*与VC 组比较,P<0.05;“—”表示空白。
?
从表3 中可以看出,VC溶液和萱草黄酮溶液均能较好地抑制由Fenton 反应产生的·OH 诱导的离体肝细胞丙二醛的生成。在试验浓度范围内,各组的抑制作用随浓度的增加而逐渐增大,表现一定的量效关系,且在同浓度下,萱草黄酮样品的抑制率大于VC溶液,差异具有统计学意义(P<0.05)。
3.5 萱草总黄酮对H2O2 所致的红细胞氧化溶血的影响
红细胞在体外因自身氧化或者诱导氧化细胞膜破裂而发生溶血,当加入抗氧化物质时,可抑制或减缓红细胞氧化的过程[9]。从表4 中可以看出,萱草黄酮浓度从20 mg/mL 增加到100 mg/mL 时,萱草黄酮对红细胞的溶血有抑制作用,且随着浓度增加,抑制率明显提高,当浓度为100 mg/mL 时,萱草黄酮对H2O2红细胞氧化溶血的抑制率可达55.03%。萱草黄酮对红细胞的溶血抑制作用低于VC溶液,差异具有统计学意义(P<0.05)。结果见表4。
4 结论
本实验结果表明,萱草总黄酮有较强的抗氧化活性,能显著抑DPPH·、·OH 自由基,并能有效抑制红细胞膜的氧化损伤,保护细胞膜,显著抑制H2O2所致的红细胞溶血,对体外温育和H2O2诱导的肝匀浆丙二醛(MDA)生成具有较强抑制作用。
表4 萱草总黄酮对H2O2 所致的红细胞氧化溶血的影响(±s,n=3)Table 4 Inhibition effect of H2O2 induced oxidative hemolysis of red blood cells by total flavonoids from Hemerocallis fulva L(±s,n=3)
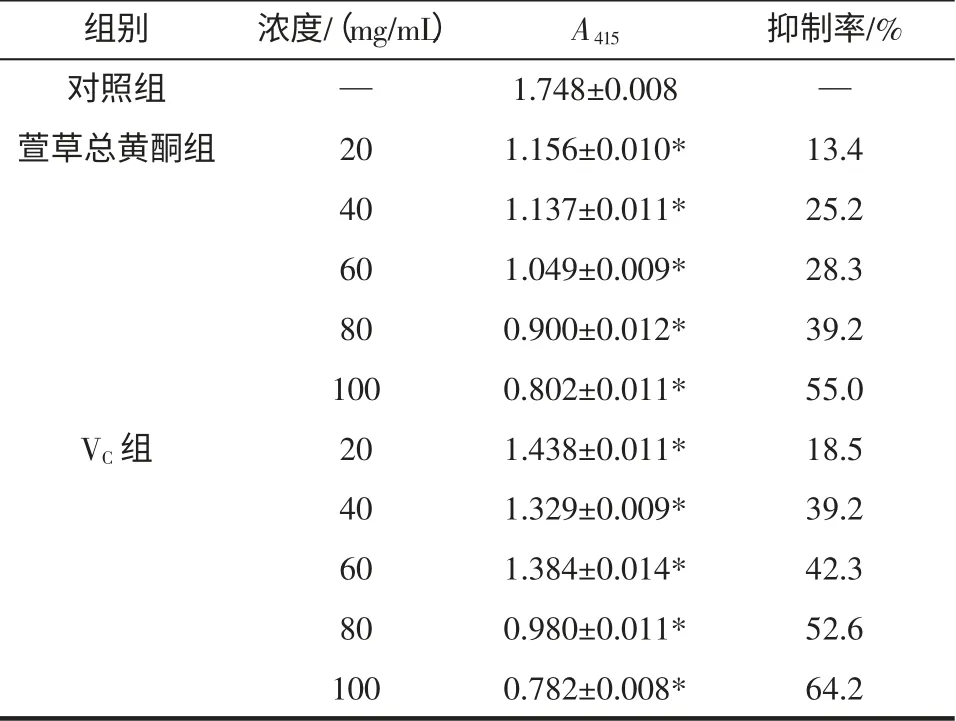
表4 萱草总黄酮对H2O2 所致的红细胞氧化溶血的影响(±s,n=3)Table 4 Inhibition effect of H2O2 induced oxidative hemolysis of red blood cells by total flavonoids from Hemerocallis fulva L(±s,n=3)
注:*与VC 组比较,P<0.05;“—”表示空白。
?
[1] Tai C Y,Chen B H.Analysis and stability of carotenoids in the flowers of daylily(Hemerocallis disticha)as affected by various treatments[J].Journal Agriculture and Food Chemistry,2000,48(12):5962-5968
[2] 邓放明,尹华,李精华,等.黄花菜应用研究现状与产业化开发对策[J].湖南农业大学学报:自然科学版,2003,29(6):529-532
[3] 徐任生,叶阳,赵维民.天然产物化学[M].北京:科学出版社,2004:562-564
[4] Nagai T,Inoue R,Inoue H,et al. Preparation and antioxidant properties of water extract of propolis[J].Food Chemistry,2003,80:29
[5] 金鸣,蔡亚欣,李金荣.邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基的新方法[J].生物化学与生物物理进展,1999,26(2):553-555
[6] Amarowicz R,Pegg R B,Rahimi Moghaddam P,et al.Free- radical scavenging capacity and antioxidant activity of selected plant species from the Canadian prairies[J].Food Chemistry,2004,84(4):551-562
[7] Bernstein C.Sex and DNA Repair[M].Newyork:Academic Press,1991:166
[8] 娄翠,汤顺清.海带岩藻多糖的抗脂质过氧化作用研究[J].中国酿造,2011,21(8):25-28
[9] 黄晓兰,阎俊,吴晓文,等.枸杞多糖对H2O2诱导的小鼠生殖细胞损伤的影响[J].食品科学,24(12):116-118
