柴胡提取物对氯苯那敏经大鼠肝微粒体代谢抑制的考察
2013-01-04惠俊敏郭延垒赵德璋吴明军于超重庆医科大学生命科学研究院重庆400016
惠俊敏,郭延垒,赵德璋,吴明军,于超 (重庆医科大学生命科学研究院,重庆400016)
感冒由多种病毒(如鼻病毒、腺病毒、柯萨奇病毒、冠状病毒、副流感病毒等)引起的急性上呼吸道感染,是临床上的常见病与多发病。中药在治疗感冒时的有效性已被人们广泛认可,据调查,在某院所有感冒处方中,中西药合用的处方所占比例达62.4%[1]。柴胡是许多用于抗感冒的中成药或中药复方的主要药物之一,如小柴胡汤、小柴胡颗粒等,而第一代组胺H1受体拮抗剂马来酸氯苯那敏常用于缓解流泪打喷嚏流涕等感冒症状,因此二者联合使用的可能性非常大。因此,柴胡与马来酸氯苯那敏的联合使用是否会发生药物-药物相互作用值得探究。
药物对P450代谢酶活性的抑制或诱导是引发药物相互作用的常见机制。而柴胡是否对P450代谢酶产生抑制或诱导而影响马来酸氯苯那敏的代谢未见相关文献报道,本实验就柴胡提取物对马来酸氯苯那敏代谢的影响进行体外研究,为临床安全合理用药提供参考。
1 材料
1.1 仪器 LC-2010A HA高效液相色谱仪、紫外检测器(日本岛津公司);组织匀浆机(德国IKA公司);Elix10超纯水净化系统(美国 Millipoep公司)。
1.2 试药 实验用柴胡采自青海大通县,经中国科学院西北高原生物研究所梅丽娟副研究员鉴定为小叶黑柴胡(伞形科柴胡属植物,Bupleurumsmithii Wolffvar.parvifoliumShan et Y.Li);马来酸氯苯那敏(批号D9684-5G)、D-葡萄糖-6-磷酸(D-glucose 6 phosphate solution,批号 C3025-5G)、辅酶Ⅱ(NADP+,批号 N5755-250MG)、6-磷酸葡萄糖脱氢酶(glucose-6-phosphate dehydrogenase,批号 G6378-250UN)均为Sigma公司;甲醇、乙腈为色谱纯,购于美国TEDIA公司;其他试剂均为市售分析纯。
1.3 实验动物 清洁级雄性SD大鼠10只,每只体质量(200±20)g,由重庆医科大学实验动物中心提供,实验动物合格许可证号:SCXK(渝)2007-0002。
2 方法与结果
2.1 色谱条件 采用 Waters Symmetry C18反相柱(4.6 mm×150 mm,5μm);流动相为20 mmol·L-1醋酸铵(pH4.3)-乙腈=(75∶25);流速1.0mL·min-1;柱温30℃;进样量20μL;检测波长262 nm。
2.2 标准溶液配制 精密称取马来酸氯苯那敏对照品3.91 mg于2 mL量瓶中,用100 mmol·L-1磷酸盐缓冲液(PBS)溶解并定容至刻度,作为标准溶液置于4℃储存备用。
2.3 柴胡提取物的制备[2]精密称取柴胡细粉15 g,置具塞锥形瓶中,精密加入80%乙醇500 mL,称定,冷浸过夜后超声提取60 min,放至室温后称重,用80%乙醇补足减失的质量,摇匀后过滤,取全部续滤液浓缩并烘干至恒重,得2.775 g干浸膏,即柴胡提取物,提取率约为18.5%,1 g干浸膏相当于约5.405 g柴胡。并于4℃储存备用。精密称取柴胡提取物20 mg于2 mL量瓶中用热水溶解并定容至刻度备用得10 mg·mL-1柴胡提取物,每1 mL柴胡提取物相当于0.054 05 g柴胡。
2.4 大鼠肝微粒体制备[3]SD大鼠断头处死后取肝脏,用含0.15 mmol·L-1氯化钾的PBS pH7.4洗至土黄色,并称取适量肝脏于50 mL烧杯中,按1 g组织加入3 mL100 mmol·L-1PBS pH7.4,将肝脏剪碎于冰上匀浆。取匀浆液于4℃以12 000 r·min-1离心15 min,弃掉沉淀,重复该操作2次,收集上清液。将该上清液置于10 mL离心管中于4℃ 以100 000 r·min-1离心60 min,弃掉上清液,重复该操作2次,收集沉淀并用适量100 mmol·L-1PBS重悬,即得微粒体蛋白,以小牛血清蛋白为标准品,采用Lowry法测定微粒体蛋白含量。
2.5 体外药物代谢孵育体系的建立[4]及样品处理200μL酶孵育体系,包括100 mmol·L-1D-葡萄糖-6-磷酸20μL,10 U·mL-16-磷酸葡萄糖脱氢酶20 μL,40 mmol·L-1氯化镁20μL,5 mg·mL-1鼠肝微粒体蛋白20μL,500μmol·L-1氯苯那敏20μL,磷酸钾缓冲液(pH7.4)80μL,37℃预孵育3 min,加入20μL10 mmol·L-1辅酶Ⅱ(NADP+)启动反应。于37℃水浴箱中孵育30 min后,加入冰乙腈200μL终止反应,于4℃以12 000 r·min-1离心15 min。取上清液进行HPLC分析。
2.6 统计学分析 本实验数据用±s表示,采用Graphhpad Prism5.01软件进行方差分析P<0.05为有统计学差异。
2.7 系统适应性试验 为考察所选色谱条件下专属性,对孵育液中氯苯那敏进行HPLC分析。结果发现,氯苯那敏峰形良好,且柴胡提取物及微粒体反应体系中无其他内源性物质干扰。所以该方法适用于该体系中氯苯那敏的测定,见图1。

图1 氯苯那敏高效液相色谱图Fig 1 HPLC profiles of chlorpheniramine
2.8 线性关系与检测限 为建立氯苯那敏在该色谱条件下的标准工作曲线,取浓度为10.0,25.0,50.0,100.0,250.0,500.0,750.0,1 000.0μmol·L-1氯苯那敏溶液20μL,加入180μL含0.5 mg·mL-1失活大鼠肝微粒体的PBS中,并加入200μL冰乙腈,充分涡旋后4℃下以12 000 r·min-1离心15 min,取上清液进行HPLC分析,记录氯苯那敏峰面积,以氯苯那敏峰面积(Y)为纵坐标,各稀释浓度(X,μmol·L-1)为横坐标,进行回归分析,得到氯苯那敏在孵育体系中的回归方程:Y=2 734.24X-724.24,r=0.999 9(n=6)。结果表明氯苯那敏在1~100μmol·L-1范围内线性关系良好,其检测限为0.25μmol·L-1(S/N>3,n=5)。
2.9 精密度与稳定性 取浓度为20.0,200.0,600.0μmol·L-1氯苯那敏溶液20μL,加入180μL含0.5 mg·mL-1失活大鼠肝微粒体的PBS中,并加入200μL冰乙腈,充分涡旋后4℃下以12 000 r·min-1离心15 min,取上清液于4℃冰箱保存,且同日、连续3 d及第1,3,5天进行HPLC分析,各浓度平行3组(n=9)。通过精密度考察可知,低、中、高3个浓度氯苯那敏日内精密度RSD分别为3.50%,0.24%,0.25%,日间精密度 RSD 分别为2.62%,1.28%,0.52%,表明精密度良好。通过稳定性考察可知:5 d内,4℃冰箱内低、中、高3个浓度氯苯那敏的 RSD分别为1.17%,0.15%,0.13%,表明样品5 d内4℃保存稳定性良好。
2.10 方法回收率 取浓度为20.0,200.0,600.0 μmol·L-1氯苯那敏溶液20μL,加入180μL含0.5 mg·mL-1失活大鼠肝微粒体的PBS中,并加入200 μL冰乙腈,充分涡旋后4℃下以12 000 r·min-1离心15 min,取上清液进行HPLC分析,各浓度平行3组(n=9)。通过方法回收率考察可知,3个浓度氯苯那敏的提方法收率分别为103.15%,99.48%,99.05%,其RSD均小于2%,表明该测定方法准确性良好,符合生物样品检测要求,适用于该体系氯苯那敏的检测,见表1。
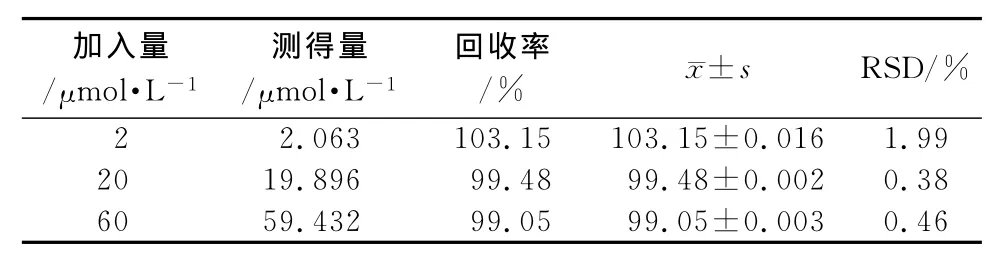
表1 大鼠肝微粒体内氯苯那敏的方法回收率(n=9)Tab 1 Method recovery of chlorpheniramine in rat liver microsomes(n=9)
2.11 氯苯那敏在大鼠肝微粒体中的代谢动力学为考察氯苯那敏在大鼠微粒体中的代谢动力学,分别取25,50,75,150,200,450,900μmol·L-1氯苯那敏标准液各20μL加至蛋白含量为0.5 mg·mL-1的大鼠肝微粒体孵育体系中,37℃孵育30 min,分别加入200μL冰乙腈终止反应,充分涡旋后4℃下以12 000 r·min-1离心15 min,取上清液进行 HPLC分析,各浓度平行3组(n=9),测定孵育后体系中剩余氯苯那敏的含量。用Graphhpad prism5.01软件以氯苯那敏浓度为横坐标,以氯苯那敏减少速率为纵坐标作图,得到氯苯那敏经大鼠肝微粒体代谢的米氏曲线,见图2,并采用该软件进行动力学分析得到相关动力学参数Vmax为0.625 7 nmol·min-1·mg-1;Km为23.68μmol·L-1;代谢清除率Clint为0.083 mL·min-1·mg-1。

图2 氯苯那敏底物浓度与氯苯那敏减少速率曲线图Fig 2 Plot of chlorpheniramine concentration vs velocity of decrease of chlorpheniramine after incubation
2.12 不同浓度柴胡提取物对氯苯那敏经大鼠肝微粒体代谢的影响 按“2.5”项下孵育体系,加入不同浓度柴胡提取物20μL,于37℃预孵育3 min后,加入20μL10 mmol·L-1辅酶Ⅱ(NADP+)启动反应。并于37℃孵育30 min,加入冰乙腈200μL终止反应,离心后,取上清进行HPLC分析,测定孵育后体系中剩余氯苯那敏含量,各浓度平行3组(n=9)。以只加PBS而不加柴胡提取物为对照组。通过孵育体系氯苯那敏剩余量间接反映出柴胡提取物对大鼠肝微粒体酶活性的影响。以对照组剩余氯苯那敏量为100%,计算柴胡提取物对氯苯那敏经大鼠肝微粒体代谢的相对抑制率。当体系中柴胡提取物质量浓度分别为150,250,350,500μg·mL-1时,各组氯苯那敏经大鼠肝微粒体代谢的相对抑制率分别为(2.24±0.4)%,(12.81±2.8)%,(19.89±3.3)%,(28.57±1.3)%,RSD分别为0.57%,2.91%,3.17%,1.45%。方差分析结果显示,除低浓度实验组(柴胡提取物质量浓度为150μg·mL-1)外,其余各实验组与对照组比较差异均有显著性(P<0.01),见图3。结果表明,经过柴胡提取物作用后的大鼠肝微粒体对氯苯那敏的代谢能力减弱,即柴胡提取物对氯苯那敏经大鼠肝微粒体的代谢有明显抑制作用,且其抑制作用与柴胡提取物浓度呈正相关,即该抑制作用呈浓度依赖性。由此推断,柴胡与马来酸氯苯那敏合用可能发生药物-药物相互作用。
3 讨论
柴胡为传统中药,具有解热、抗炎、镇静、保肝、降低血压和减缓心率等多种药理活性[5],在中国有2000多年的临床应用历史。文献[6]报道了小柴胡汤对大鼠肝线粒体的单胺氧化酶有一定抑制作用,柴胡注射液对CYP4A有抑制作用[7]。所以,当柴胡或含有柴胡的药物与其他药物联合使用的时候发生药物相互作用的可能性大大增加。马来酸氯苯那敏是第一代组胺 H1受体拮抗剂,能缓解流泪打喷嚏流涕等感冒症状。而柴胡同样有抗感冒的功效,临床上常将二者联合使用。所以探讨柴胡与氯苯那敏是否存在相互作用具有重要意义。本文在前期实验的基础上,研究了柴胡提取物对氯苯那敏经P450酶代谢的影响,为临床合理用药提供理论依据。
经研究发现柴胡提取物对氯苯那敏的代谢存在抑制作用,由此推断当柴胡与马来酸氯苯那敏合用时可能发生药物-药物相互作用。本课题组前期研究发现该柴胡提取物主要成分是皂苷类物质且其总皂苷含量>2.77%[2]。有文献[8]报道,氯苯那敏主要经P450酶中的2D6代谢。因此柴胡提取物对氯苯那敏代谢抑制原因可能是其皂苷类物质对CYP2D6产生抑制,进而抑制氯苯那敏的代谢。本文仅在体外研究中发现柴胡提取物对氯苯那敏的代谢有明显的抑制作用,而在动物体内是否存在抑制作用及其抑制机制需进一步验证及探讨。
[1]江晓燕.感冒患者的常见中西药连用的合理性与配伍禁忌[J].现代医院,2011,11(10):41-43.
[2]曹纬国,陶燕铎,张有金,等.青海产小叶黑柴胡中皂苷类成分的含量分析[J].中国现代应用药学,2012,29(4):323-326.
[3]张艳辉,于超,郭延垒,等.高效液相色谱法测定鼠肝微粒体中CYP1A2酶的活性及动力学考察[J].药物分析杂志,2012,32(2):189-193.
[4]郭延垒,于超,杨竹,等.HPLC法测定大鼠UGT1A6的酶活性及体外动力学分析[J].药物分析杂志,2012,32(4):717-720.
[5]孙宗喜,吕晓慧.柴胡注射液的药理及不良反应文献分析[J].中国医院药学杂志,2012,32(11):904-905.
[6]吴春福,刘雯,解庆峰,等.小柴胡汤对大鼠肝线粒体的单胺氧化酶的抑制作用[J].沈阳药学院学报,1991,8(3):207-210.
[7]王晶,余辉艳,郭蕾,等.柴胡注射液对大鼠细胞色素P450各亚型活性的影响[J].中国临床药理学与治疗学,2007,12(9):1037-1041.
[8]Yasuda SU,Zannikos P,Young AE,etal.The roles of CYP2D6 and stereoselectivity in the clinical pharmacokinetics of chlorpheniramine[J].Bri J Clin Pharmacol,2002,53(5):519-525.
