灵芝三萜酸对小鼠急性肝损伤的保护作用
2013-01-04李鹏魏晓霞南婷婷沈翠娥黄秀旺许建华福建医科大学药学院天然药物学系福建福州5000福建省立医院药学部福建福州50001福建医科大学研究生教育学院福建福州5000福建医科大学临床药理研究所福建福州5000福建省高校天然药物药理学重点实验室福建福州5000
李鹏,魏晓霞,南婷婷,沈翠娥,黄秀旺,许建华,5 (1.福建医科大学药学院天然药物学系,福建 福州5000;.福建省立医院药学部,福建 福州50001;.福建医科大学研究生教育学院,福建 福州5000;.福建医科大学临床药理研究所,福建 福州5000;5.福建省高校天然药物药理学重点实验室,福建 福州5000)
灵 芝 [赤 芝Ganodermalucidum(Leyss.ex Fr.)Karst]是担子菌纲多孔菌科灵芝属真菌的子实体,自古便被列为名贵药材,有滋补强壮、扶正固本等功效[1]。灵芝在临床上已用于肝炎的治疗[2],其保肝作用的有效成分可能是灵芝肽[3]、三萜类[4]等。在此基础上,本实验主要研究从灵芝总三萜中获得的总三萜酸类组分对四氯化碳(CCl4)和56度白酒诱导小鼠急性肝损伤的影响,探讨保肝作用及其机制。对于合理开发利用灵芝三萜酸类成分具有一定意义。
1 材料
UV-250紫外可见分光光度计(日本岛津公司);DP70数码摄像显微图像系统(Olymbus Optical CO.,Ltd,Japan);灵芝药材购自福建仙芝楼生物科技有限公司,由福建医科大学药学院张永红教授鉴定为赤芝的子实体;泊洛沙姆188(F68,沈阳药科大学药大药业,批号070417);四氯化碳(CCl4,武汉市江北化学试剂厂);56度红星二锅头白酒(北京红星股份有限公司);联苯双酯滴丸(南京建成生物工程研究所);丙氨酸转氨酶(ALT)试剂盒、天门冬氨酸转氨酶(AST)试剂盒、超氧化物歧化酶(SOD)试剂盒和丙二醛(MDA)试剂盒均购自南京建成生物工程研究所。普通级昆明种雄性小鼠,体质量(20±2)g[福建医科大学实验动物中心,动物合格证号:SYXK(闽)2008-0001]。
2 方法
2.1 灵芝三萜酸(GTA)的提取与制备 灵芝药材饮片粉碎成粗粉后,用90%乙醇加热回流提取3次,每次3 h,合并3次提取液,回收乙醇得浸膏,用水稀释后用醋酸乙酯萃取多次,得醋酸乙酯萃取液。余下步骤参考文献[5]进行,即醋酸乙酯萃取液用饱和碳酸氢钠水溶液萃取多次,合并碳酸氢钠萃取液,用6 mol·mL-1盐酸调节pH2~3,用醋酸乙酯萃取,醋酸乙酯液用水洗涤后减压浓缩、真空干燥得灵芝总三萜酸(GTA,浅黄色固体粉末,1 g生药相当于12.5 mg固体)。用F68制备成固体分散体(溶剂法),4℃保存备用,临用前用纯化水配成所需浓度。
2.2 白酒诱导小鼠急性肝损伤[6]昆明种小鼠60只,自由饮水进食,饲养1 d后,随机分为6组,即GTA低、中、高剂量组(GTA 剂量分别为0.5,1,2 g·kg-1),阳性对照组(联苯双酯0.1 g·kg-1),空白对照组与酒精性肝损伤模型组(与GTA高剂量组等剂量的泊洛沙姆水溶液)。灌胃给药,qd,连续7 d。末次给药2 h后,除空白对照组外其余各组均腹腔注射56度红星二锅头白酒,注射容量为0.05 mL/10 g。空白对照组腹腔注射等体积生理盐水,禁食不禁水,16 h后,称重。眼球取血,3 000 r·min-1离心,得血清,-20℃冰箱中保存,按试剂盒方法(赖氏法)测血清ALT和AST活性;小鼠颈椎脱臼处死,快速摘取肝脏,滤纸吸干,称重,测定肝脏指数;取0.3 g肝左叶,用生理盐水清洗,用PBS做成10%肝组织匀浆,按试剂盒方法测肝组织MDA含量(硫代巴比妥酸法)和SOD活性(黄嘌呤氧化法)。
2.3 CCl4诱导小鼠急性肝损伤[6]实验分组及给药方法同酒精性肝损伤实验,第7天给药2 h后,除空白对照组外其余各组均腹腔注射0.1%CCl4花生油溶液,注射容量为0.1 mL/10 g,空白对照组腹腔注射等体积生理盐水。禁食不禁水,16 h后,称体质量。肝脏指数的测定,血清ALT和AST活性的测定,肝组织MDA含量和SOD活性的测定同酒精性肝损伤模型。另取部分肝组织用10%中性甲醛溶液固定,经脱水、透明,石蜡包埋,切片,HE染色后,观察肝组织的脂肪变性、炎症坏死等病理变化。
2.4 统计学处理 使用SPSS11.0进行相关数据处理,数据以±s表示。组间比较采用单因素方差分析,P<0.05为差异有显著性。
3 结果
3.1 对急性酒精性肝损伤小鼠血清转氨酶的影响模型组小鼠血清ALT、AST比空白对照组明显升高(P<0.01);与模型组比较,GTA高、中剂量组小鼠血清ALT、AST水平均有降低趋势,其中高剂量组统计学比较差异显著(P<0.05),中剂量组的ALT降低无统计学差异,AST降低具有统计学意义(P<0.05),而低剂量给药组与模型组相比差异无显著性,见图1。

图1 GTA对急性酒精性肝损伤小鼠血清ALT和AST的影响(±s,n=10)Fig 1 Effect of GTA on activities of serum ALT and AST in acute alcoholic hepatic injury of mice(±s,n=10)
3.2 对急性酒精性肝损伤小鼠肝组织中 MDA、SOD和肝脏指数的影响 与空白对照组比较,模型组小鼠肝组织中 MDA含量显著增加(P<0.05),而SOD活性显著降低(P<0.05)。与模型组比较,GTA高剂量组和中剂量组小鼠肝组织MDA含量明显降低(P<0.01,P<0.05),而各剂量组小鼠肝组织中SOD活性均明显升高(P<0.01),显示出一定的剂量反应关系。与空白对照组相比,模型组小鼠的肝脏指数明显增大(P<0.01);与模型组相比,高、中剂量给药组均能显著降低肝脏指数(P<0.01),低剂量给药组与模型组相比,差异无显著性,见表1。
3.3 对CCl4所致急性肝损伤小鼠血清转氨酶的影响 模型组与空白对照组比较小鼠血清ALT、AST活性显著升高(P<0.01),表明急性肝损伤模型复制成功。与模型组相比,GTA各剂量组均能降低CCl4所引起的ALT、AST的升高,且呈剂量依赖性,其中高剂量组统计学比较差异显著(P<0.01),见图2。
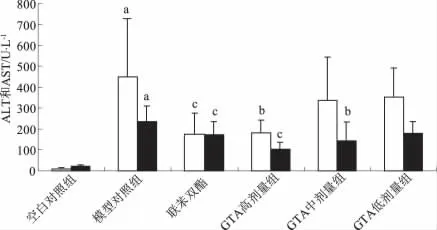
图2 GTA对四氯化碳致急性肝损伤小鼠血清ALT和AST的影响(±s,n=10)Fig 2 Effect of GTA on serum ALT and AST activities in acute liver injury induced by CCl4in mice(±s,n=10)
3.4 对CCl4所致急性肝损伤小鼠肝组织中MDA、SOD和肝脏指数的影响 与空白对照组相比,模型组小鼠肝组织中 MDA明显增高(P<0.01),SOD显著降低(P<0.05),说明CC14所致小鼠急性肝损伤与氧化应激有关;与模型组相比,GTA各剂量组小鼠肝组织MDA明显降低(P<0.05),GTA高剂量组小鼠肝组织中SOD明显升高(P<0.01),而中、低剂量组差异无显著性。与空白对照组相比模型组小鼠肝脏指数明显增大(P<0.01);与模型组相比,高剂量与中剂量给药组均能显著降低肝脏指数(P<0.01,P<0.05),低剂量给药组与模型组相比,差异无显著性,见表2。
3.5 对CCl4所致急性肝损伤小鼠肝脏组织病理改变观察 肉眼观察正常对照组小鼠肝脏外形正常,暗红色,被膜光滑。模型组肝脏体积明显增大,包膜紧张,边缘钝厚,质地变软,有油腻感,表面无光泽,呈淡黄色。各给药组肝脏外观介于正常对照组和模型组之间。
HE染色,在光镜下观察结果如图3所示,正常对照组小鼠肝组织结构完整、清晰,肝小叶结构正常,肝窦清晰可见,肝索排列整齐。肝细胞大小正常,胞核居中,无脂肪变性等异常改变。模型组肝小叶界限不清,肝细胞索排列紊乱,大部分肝窦消失,肝细胞体积明显增大,甚至肿胀呈圆形,中央静脉和汇管区出现弥漫性的炎症细胞浸润;而GTA各给药组大部分肝细胞结构完整,排列整齐,肝细胞水肿、气球样变及炎症细胞浸润均明显减轻,与模型组相比各给药组肝脏病理变化显著改善。
表1 GTA对急性酒精性肝损伤小鼠肝组织中MDA、SOD及肝脏指数的影响(±s,n=10)Tab 1 Effect of GTA on MDA content and SOD activity of liver homogenates and liver index in acute alcoholic hepatic injury of mice(±s,n=10)

表1 GTA对急性酒精性肝损伤小鼠肝组织中MDA、SOD及肝脏指数的影响(±s,n=10)Tab 1 Effect of GTA on MDA content and SOD activity of liver homogenates and liver index in acute alcoholic hepatic injury of mice(±s,n=10)
注:与空白对照组比较,aP<0.05,b P<0.01;与模型对照组比较,c P<0.05,d P<0.01
组别 剂量/g·kg-1 MDA/nmol·mg-1 SOD/U·mg-1 肝脏指数/%空白对照组 - 5.1±0.8 60.7±23.7 4.5±0.3模型对照组 ﹣ 5.9±0.6a 29.7±15.6a 5.5±0.4b联苯双酯组 0.1 4.81±0.22d 121.4±20.4d 3.91±0.1d GTA高剂量组 2.0 4.9±0.7d 109.8±44.9d 4.4±0.3d GTA中剂量组 1.0 5.1±0.8c 94.2±17.6d 4.9±0.5d GTA低剂量组 0.5 7.2±1.6 79.2±34.5d 5.2±0.6
表2 GTA对四氯化碳致小鼠急性肝损伤肝组织MDA和SOD的影响(±s,n=10)Tab 2 Effect of GTA on MDA content and SOD activity of liver homogenates and liver index in acute liver injury induced by CCl4in mice(±s,n=10)

表2 GTA对四氯化碳致小鼠急性肝损伤肝组织MDA和SOD的影响(±s,n=10)Tab 2 Effect of GTA on MDA content and SOD activity of liver homogenates and liver index in acute liver injury induced by CCl4in mice(±s,n=10)
注:与空白对照组比较,aP<0.05,b P<0.01;与模型对照组比较,c P<0.05,d P<0.01
组别 剂量/g·kg-1 MDA/nmol·mg-1 SOD/U·mg-1 肝脏指数/%空白对照组 - 3.6±1.5 47.8±9.6 5.2±0.4模型对照组 - 5.9±2.6b 39.2±5.0a 6.5±1.0b联苯双酯 0.1 3.8±0.8c 40.9±9.3 5.2±0.3d GTA高剂量组 2.0 3.3±1.2d 52.2±8.2d 5.1±0.5d GTA中剂量组 1.0 3.8±3.1d 43.6±10.6 5.8±0.3c GTA低剂量组 0.5 3.8±1.1c 40.6±9.8 6.14±0.28

图3 GTA对CCl4所致急性肝损伤小鼠肝脏病理组织学的影响(HE,×400)Fig 3 Pathohistology of acute liver injury induced by CCl4treated with GTA in mice(HE,×400)
4 讨论
ALT和AST是诊断肝脏疾病中应用最广泛的酶。由于整个肝脏内转氨酶含量约为血中含量的100倍,如果释放的酶全部保持活性,只要1%的肝细胞坏死,便足以使血清中酶活性增加1倍。又由于肝细胞内转氨酶浓度比血清高1 000~5 000倍,在肝细胞膜损伤通透性增加时,即使无坏死,细胞内转氨酶也可由于此种浓度差而泄漏入血中。因此血清转氨酶活性(尤其是ALT)是肝细胞损害的敏感指标。当肝细胞病变好转时,ALT随之下降[7]。
MDA是自由基攻击生物膜中的多价不饱和脂肪酸引发脂质过氧化而形成的一种醛基物质。MDA含量可反映体内脂质过氧化的程度,从而间接反映细胞损伤程度[8]。SOD对机体的氧化与抗氧化平衡起着至关重要的作用,此酶能清除超氧阴离子自由基(O-2),保护细胞免受损伤。由于SOD活力的高低间接反应了机体清除氧自由基的能力,而MDA的高低又间接反应了机体细胞受自由基攻击的严重程度,因此MDA的测定常常与SOD的测定相互配合。
饮酒对肝脏的影响已引起人们的重视,过量饮酒是造成人体肝脏损伤的重要原因之一。在动物实验中,为更好地反映人类酒精性肝病的特征,本实验选用56度白酒替代纯酒精造模。小鼠腹腔注射56度红星二锅头白酒0.05 mL/10 g和0.1%CCl4花生油溶液0.01 mL·g-116 h后,空白对照组小鼠肝脏呈红褐色,表面光滑,质地柔软,边缘锐利;两种模型组肝脏肉眼观察体积明显增大,呈土黄色,质脆,表面可见白色斑点,质地较脆,边缘变钝,且小鼠血清ALT、AST水平均升高,肝匀浆MDA水平升高、SOD活力降低,说明56度白酒和CC14肝损伤模型诱导成功。GTA各给药剂量组肝脏肉眼观察大小及颜色均界于模型组与空白对照组之间,GTA高剂量组能明显降低酒精或CCl4诱导急性肝损伤小鼠血清ALT、AST的水平,肝脏指数及肝匀浆MDA的含量,升高肝匀浆SOD活力,此外从组织病理切片发现GTA给药组的肝细胞病变明显改善。可见GTA对白酒或CCl4诱导的急性肝损伤有保护作用,提示GTA的抗氧化作用可能是其抗肝损伤作用的机制之一。
GTA是采用碱溶酸沉法从灵芝总三萜中制备的含有总三萜酸的粗提物,以齐墩果酸作为对照品,香草醛-高氯酸染色后紫外-可见分光光度法测得三萜酸含量为45.8%。因此,灵芝三萜酸类成分可能是灵芝保肝作用的活性成分之一,如何富集灵芝三萜酸类物质以提高纯度及探讨灵芝三萜酸单体物质的保肝活性,还有待进一步研究。
[1]李鹏,魏晓霞,许建华.灵芝提取物抗肿瘤作用的实验研究[J].中国现代应用药学,2011,28(9):789-792.
[2]胡娟.灵芝胶囊治疗慢性乙型肝炎86例分析[J].职业与健康,2003,9(3):103-104.
[3]Shi Y,Sun J,He H,etal.Hepatoprotective effects of Ganoderma lucidum peptides against d-galactosamine-induced liver injury in mice[J].J Ethnopharmacol,2008,117(3):415-419.
[4]张文晶,余明莲,吴楠.灵芝三萜对α-萘异硫氰酸酯致大鼠肝损伤的保护作用[J].解放军药学学报,2011,27(4):318-320.
[5]李保明,刘超,王洪庆,等.灵芝总三萜酸含量测定方法的研究[J].中国中药杂志,2007,32(12):1234-1236.
[6]胡德坤,沈业寿.天麻多糖-2对小鼠四氯化碳肝损伤和酒精性肝损伤的保护作用[J].中国中医药信息杂志,2007,14(12):29-31.
[7]梁扩寰.肝脏病学[M].北京:人民卫生出版社,1995:208.
[8]Choudhary M,Jetley UK,Khan AM,etal.Effect of heavy metal stress on proline,malondialdehyde,and superoxide dismutase activity in the cyanobacteriumSpirulinaplatensis-S5[J].Ecotox Environ Safe,2007,66(2):204-209.
