阿司匹林对大鼠醋酸胃溃疡愈合的影响
2013-01-04王国忠肖薇李波齐齐哈尔医学院病理生理教研室黑龙江齐齐哈尔161006
王国忠,肖薇,李波 (齐齐哈尔医学院病理生理教研室,黑龙江 齐齐哈尔161006)
阿司匹林(aspirin,Asp)是解热、消炎、镇痛和治疗风湿的标准药物,国内外文献报道Asp还可治疗动脉硬化、癌症、老年痴呆[1]。Asp还有预防心脑血管疾病的作用[2]。Asp药理作用如此广泛,以至于该药用药频度(DDDs)排序名列前茅[1]。但是,Asp有损伤胃肠道的不良反应:Asp通过抑制环加氧酶活性,减少前列腺素E2的生成,使胃酸分泌增多,加重溃疡[3];通过促进胃泌素的表达使胃酸分泌增多抑制溃疡愈合[4],还可通过抑制表皮生长因子(epidermal growth factor,EGF)的表达抑制溃疡愈合[5]。对于Asp引起胃肠道溃疡的机制还不完全清楚[6]。EGF与 TGF-α有35%的序列同源性,并且结合同一受体[7]。Asp是否也能通过抑制TGF-α的表达来抑制溃疡愈合以及通过其他机制影响溃疡愈合呢?目前还不清楚。为此,该项研究探讨了Asp对转化生长因子-α(transforming grouth factor-α,TGF-α)、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、胃黏液和胃黏膜血流(gastric macosal blood flow,GMBF)的影响,进而探讨对溃疡愈合的影响及机制。这对进一步阐明Asp的药理作用和不良反应,在临床上合理应用Asp,保护人们的健康具有重要意义。
1 材料与方法
1.1 材料
1.1.1 仪器 奥林巴斯光学显微镜、Motic Med 6.0数码医学图像分析系统、LRH-250-A型生化培养箱为日本产品。ML191型激光多谱勒血流仪为澳大利亚产品。RM2015型Leica切片机为德国产品。
1.1.2 试剂 阿司匹林为美国Alfa Aesar公司产品(货号为a12488)。TGF-α兔抗鼠一抗(货号为bs-0066R)和PCNA兔抗鼠一抗(货号为bs-2007R)为北京博奥森生物技术有限公司产品,购于北京赛诺科为生物有限公司,其山羊抗兔辣根过氧化物酶标二抗(货号为CW0103)以及DAB显色试剂盒(货号为CW0125,批号17909F)为康为世纪生物科技有限公司产品,购于北京赛诺科为生物有限公司。阿尓新蓝为中国上海化学试剂厂产品(批号20080612)。
1.1.3 实验动物 清洁级 Wistar大鼠,♂,体质量200~220 g,购于大连医科大学实验动物中心。许可证号:SCXK(辽)2008-0002。
1.2 方法
1.2.1 溃疡模型复制及分组 按先前报道的方法[3]复制大鼠醋酸溃疡模型并分组,简述如下:乙醚麻醉大鼠,剑突下腹正中切口,开腹后将胃拉出,将内径6 mm的塑料管紧贴于胃体与幽门交界处,向管内注入99.5%(V/V)的醋酸75μL,25 s后移除醋酸,将胃放回腹腔,依次缝合腹壁,第3天即出现典型的消化性溃疡结构。8 d后随机分为如下3组:模型对照组,在8~15 d每天禁食5 h;盐水组对照,在8~15 d每天禁食4 h后用灌胃法给予生理盐水,然后再禁食1 h;阿司匹林组,在8~15 d每天禁食4 h后用灌胃法给予阿司匹林50 mg·kg-1体质量,然后再禁食1 h。在模型复制的第16天收集标本进行指标检测。
1.2.2 TGF-α和PCNA表达的检测 用免疫组化Elivison二步法检测TGF-α和PCNA在胃黏膜中的表达,简述如下:4%福尔马林固定接触醋酸部位的胃黏膜标本,石蜡包埋、做4μm厚切片、烘片,脱蜡至水,抗原修复,3%过氧化氢阻断内源性过氧化物酶,滴加一抗,TGF-α一抗稀释比为1∶200,PCNA一抗稀释比为1∶200,4℃水箱过夜,滴加二抗,稀释比为1∶500,37℃温箱孵育1 h,DAB显色,苏木素复染,0.1%HCl分化,蓝化,脱水透明,封固。TGF-α和PCNA在光镜下显示为棕色。每组8只大鼠随机取4只大鼠胃做标本,每个标本取1张切片,每张切片随机取2个视野,然后用 Motic Med 6.0数码医学图像分析系统检测溃疡边缘TGF-α和PCNA的积分光密度。
1.2.3 胃黏液的检测 采用Schiff-阿尓新蓝染色法,其方法简述如下:溃疡边缘组织切片到水,阿尓新蓝染色,Schiff试剂染色,1%盐酸酒精分化,常规脱水,二甲苯透明,封片。中性胃黏液染成红色,酸性胃黏液染成蓝色,然后用Motic Med 6.0数码医学图像分析系统检测溃疡边缘中性和酸性胃黏液,二者之和作为胃黏液的积分光密度。
1.2.4 溃疡边缘胃黏膜血流的检测 在溃疡边缘选出3点放置激光多普勒血流仪测定探头进行测定,取均值,血流量单位以多普勒信号的电压值(mV)表示。
1.3 统计学分析 计量数据用±s表示,用SPSS 18.0统计分析软件进行分析,组间差异采用单因素方差分析中的最小显著差法(LSD)进行分析,P<0.05为差异显著,P<0.01为差异非常显著。
2 结果
2.1 各组溃疡边缘TGF-α、PCNA表达和胃黏液分泌的差异 图1显示用免疫组化方法检测TGF-α在溃疡边缘胃黏膜中的表达,棕色为TGF-α染色,由图1可见,模型对照组和盐水对照组TGF-α表达量相似,较阿司匹林组多。

图1 阿司匹林对胃黏膜TGF-α表达的影响(×400)Fig 1 Effects of aspirin on expression of TGF-αin gastric mucosa(×400)
图2显示用免疫组化方法检测PCNA在溃疡边缘胃黏膜中的表达,棕色为PCNA染色,由图2可见,模型对照组和盐水对照组PCNA表达量相似,较阿司匹林组多。

图2 阿司匹林对胃黏膜PCNA表达的影响(×400)Fig 2 Effects of aspirin on expression of PCNA in gastric mucosa(×400)
图3显示溃疡边缘胃组织Schiff-阿尓新蓝染色,中性胃黏液染成红色,酸性胃黏液染成蓝色,由图3可见,模型对照组和盐水对照组胃黏液量相似,较阿司匹林组多。

图3 阿司匹林对胃黏液的影响(×100)Fig 3 Effects of aspirin on gastric mucus(×100)
2.2 各组溃疡边缘TGF-α、PCNA、胃黏液的积分光密度差异 结果见表1。
表1 各组TGF-α、PCNA和胃黏液积分光密度的差异(±s,n=8)Tab 1 Difference of the integral light density of TGF-α,PCNA and gastric mucus in each group(±s,n=8)

表1 各组TGF-α、PCNA和胃黏液积分光密度的差异(±s,n=8)Tab 1 Difference of the integral light density of TGF-α,PCNA and gastric mucus in each group(±s,n=8)
注:与阿司匹林组比较,aP<0.01,b P<0.05
组别 TGF-α PCNA 胃黏液模型对照组 12.0±3.0a 18.5±3.7a 20.9±3.2b盐水对照组 12.7±2.62a 19.2±3.4a 21.0±2.8b阿司匹林组 8.1±2.4 13.0±2.7 16.4±4.9
2.3 各组溃疡边缘GMBF的差异 结果见图4。
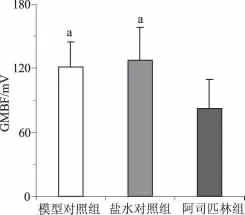
图4 阿司匹林对胃黏膜血流的影响Fig 4 Effects of aspirin on GMBF
3 讨论
先前报道[3],模型对照组、盐水对照组、阿司匹林组在模型复制的第16天,溃疡面积分别为(8.6±3.0),(9.2±2.5),(12.0±2.6)mm2,阿司匹林组与模型对照组、盐水对照组相比,P<0.05,模型对照组与盐水对照组相比无统计差异。表明阿司匹林能够延迟溃疡愈合。
胃组织能够分泌TGF-α,它作用于EGF受体,控制细胞增殖、分化和迁移,加速损伤上皮的修复[8]。从实验结果图1来看,溃疡边缘TGF-α在模型对照组和盐水对照组表达基本相同,而阿司匹林组减少;TGF-α的积分光密度在模型对照组和盐水对照组无显著差异,而Asp组与模型对照组和盐水对照组相比有非常显著差异(P<0.01,见表1),表明Asp有抑制TGF-α表达,阻碍损伤的胃黏膜上皮的修复,进而抑制了溃疡的愈合。
PCNA是一种相对分子质量为36 kDa核蛋白,是DNA聚合酶的辅助蛋白,在细胞周期的S期高表达,是反映细胞增殖活性的重要生物学指标[9]。胃黏膜细胞是体内细胞更新最快的细胞之一,以维持黏膜屏障的作用。从实验结果图2来看,PCNA在模型对照组、盐水对照组表达基本相同,而阿司匹林组减少;PCNA的积分光密度在模型对照组和盐水对照组无显著差异,而Asp组与模型对照组和盐水对照组相比有非常显著差异(P<0.01,见表1),表明Asp抑制PCNA的表达,从而抑制了胃黏膜细胞的增殖、更新,进而抑制了溃疡的愈合。
胃黏膜细胞分泌的胃黏液附着在胃黏膜表面,是防御有害因子侵袭的第一道防线[10]。从实验结果图3来看,溃疡边缘胃黏液在模型对照组和盐水对照组基本相同,而阿司匹林组减少;胃黏液的积分光密度在模型对照组和盐水对照组无显著差异,而Asp组与模型对照组和盐水对照组相比有非常显著差异(P<0.01,见表1),表明Asp也有抑制胃黏液生成的作用,进而也抑制了溃疡的愈合。
GMBF为胃黏膜提供氧和营养物质,维持胃黏膜细胞的更新,是胃黏膜防御有害因子侵袭的重要因素[10]。从实验结果图4来看,溃疡边缘GMBF在模型对照组和盐水对照组基本相同,而阿司匹林组减少;表明Asp有减少GMBF的作用,由此抑制了胃黏膜细胞的更新,进而抑制了溃疡的愈合。
由上述推测,阿司匹林抑制溃疡愈合的机制可能是:阿司匹林通过抑制TGF-α、PCNA的表达和减少GMBF,导致胃黏膜增殖、修复能力降低、胃黏液生成减少,抑制了溃疡的愈合。这些机制在临床上合理应用阿司匹林具有重要意义。为此,长期大剂量应用阿司匹林时,应重视胃黏膜保护药的应用。
[1]尹桂华.阿司匹林的新用途[J].中国医院药学杂志,2006,26(8):1007-1008.
[2]李静,牛珉,孙向红,等.阿司匹林安全性和有效性分析[J].中国医院药学杂志,2012,32(17):1405-1407.
[3]王国忠,姜行康,孙佳玉,等.阿司匹林对大鼠胃溃疡愈合的影响及其机制[J].中国老年学杂志,2011,31(15):2906-2908.
[4]袁胜龙,李明明,张鸿雁,等.阿司匹林与幽门螺杆菌对胃酸分泌的影响[J].中国医院药学杂志,2011,31(1):21-24.
[5]李成军,马丹丹,祝友朋,等.阿司匹林对大鼠胃溃疡愈合的影响和机制[J].中国老年学杂志,2011,31(15):2898-2990.
[6]Sostres C,Lanas A.Gastrointestinal effects of aspirin[J].Nat Rev Gastroenterol Hepatol,2011,8(7):385-394.
[7]张静,房涛,马义腾,等.表皮生长因子及其受体、转化生长因子-α在实验性胃溃疡愈合中的作用[J].河北北方学院学报(自然科学版),2012,28(4):59-62.
[8]Osaki LH,Curi MA,Alvares EP,etal.Early weaning accelerates the differentiation of mucous neck cells in rat gastric mucosa:possible role of TGF alpha/EGFR [J].Differentiation,2010,79(1):48-56.
[9]da Silva LM,Allemand A,Mendes DA,etal.Ethanolic extract of roots from Arctium lappa L.accelerates the healing of acetic acid-induced gastric ulcer in rats:Involvement of the antioxidant system[J].Food Chem Toxicol,2013,51:179-187.
[10]Wang GZ,Huang GP,Yin GL,etal.Aspirin can elicit the recurrence of gastric ulcer induced with acetic acid in rats[J].Cell Physiol Biochem,2007,20(1-4):205-212.
