婴儿双歧杆菌的耐氧驯化及应用特性研究
2012-12-28敏胡颖罗爱平4朱秋劲
吴 敏胡 颖罗爱平,4朱秋劲,3,4
何腊平2,4朱建荣3胡 萍2,3,4
(1.铜仁职业技术学院,贵州 铜仁 554300;2.贵州大学生命科学学院,贵州 贵阳 550025;3.贵州省乳品工程技术研究中心,贵州 贵阳 550018;4.贵州大学食品科学工程研究中心,贵州 贵阳 550025)
婴儿双歧杆菌的耐氧驯化及应用特性研究
吴 敏1胡 颖2罗爱平2,4朱秋劲2,3,4
何腊平2,4朱建荣3胡 萍2,3,4
(1.铜仁职业技术学院,贵州 铜仁 554300;2.贵州大学生命科学学院,贵州 贵阳 550025;3.贵州省乳品工程技术研究中心,贵州 贵阳 550018;4.贵州大学食品科学工程研究中心,贵州 贵阳 550025)
研究婴儿双歧杆菌的生长促进剂,并对活化菌种进行耐氧驯化培养,探讨婴儿双歧杆菌在搅拌花生酸奶加工中的应用。结果表明:酵母浸出液对婴儿双歧杆菌活化影响最大,酪蛋白胨次之,磷酸氢二钾最小,三者最佳水平组合:酵母浸出液0.4%,酪蛋白胨0.2%,磷酸氢二钾 0.1%。菌种被连续活化三代后凝乳时间稳定至3.5h。通过对4种因素婴儿双歧杆菌生长的影响研究发现:鲜牛奶与花生乳配比的影响最大,其次是蔗糖,再次是接种量,最后是葡萄糖。当鲜牛奶与花生乳配比1∶1,蔗糖6%,葡萄糖2%,接种量5%,婴儿双歧杆菌达到最佳生长状态,活菌数达到2.5×109CFU/mL。
婴儿双歧杆菌;耐氧驯化;搅拌酸奶;花生;发酵剂
双歧杆菌(Bifidobacteria)具有厌氧、无芽胞、无运动等属性,属于革兰氏阳性杆菌,对氧十分敏感,且耐酸耐热性、以及凝乳性能较差,最适pH 6.5~7.0,最适生长温度37~42℃[1]。双歧杆菌是由法国巴斯德研究所的 Henry Tissier于1899年从母乳喂养的婴儿粪便中分离得到[2]。它是发现最早的生理性细菌之一,具有维持肠道正常菌群平衡、抗腹泻、抗便秘、抗感染、抗肿瘤、抗癌变等生理功能,而且双歧杆菌在生长过程中会产生多种维生素、游离氨基酸等营养物质,工业生产中常常将其应用于牛奶生产中,具有改善牛奶营养价值的作用[3]。由于双歧杆菌的重要生理功能,使得以双歧杆菌为益生菌生产的产品一直被消费者青睐,资料[4]显示:日本上市的含双歧杆菌的乳制品就占据了1/3乳制品市场。
目前双歧杆菌制品的开发利用主要为双歧杆菌与双歧因子搭配的保健食品,如双歧杆菌与寡糖、葡萄糖酸、精氨酸配合[5]。
但由于双歧杆菌对营养要求高,对环境的抵抗力差,这给双歧杆菌的生产和实际应用带来了很大的困难。然而,不同的菌株有不同程度的耐氧力,有些菌株在经人工耐氧驯化后可在有氧的环境中生长,刚分离到的双歧杆菌属专性厌氧菌,要将所分离得到的双歧杆菌应用到生产实践中需先进行耐氧驯化[6]。
本试验对婴儿双歧杆菌进行了活化及耐氧驯化,将制得的稳定发酵剂应用于搅拌花生酸奶中,并对其应用特性进行了研究。
1 材料与方法
1.1 试验材料
花生仁:铜仁珍珠豆型花生仁,质量符合《NY 5303——2005无公害食品 花生》要求;
新鲜牛奶:来自贵阳三联乳业有限公司,质量符合《NY 5045——2001无公害食品 生鲜牛乳》要求;
婴儿双歧杆菌:北京弗蒙特生物技术有限公司;
蔗糖、葡萄糖、磷酸二氢钾、磷酸氢二钾、蛋白胨、酪蛋白胨、酵母浸出液、半胱氨酸、可溶性淀粉、吐温-80、琼脂等:均为市售产品。
1.2 试验设备
恒温培养箱:PYX-DHS-3540,上海跃进医疗器械厂;
电加热压力蒸汽灭菌器:LS-B 75L-Ⅱ,江阴滨江医疗设备有限公司;
电热恒温水浴锅:DK-98-ⅡA,天津泰斯特仪器有限公司;
真空干燥箱:ZK-1型,上海锦昱科学仪器有限公司;
组织捣碎机:JJ-2型,江苏省金坛市杰瑞尔电器有限公司;
电子天平:FA2004N,上海民桥精密科学仪器有限公司;
数显高速分散均质机:FJ300-S,上海双旭电子有限公司。
1.3 试验方法
1.3.1 婴儿双歧杆菌生长促进剂筛选 婴儿双歧杆菌活化过程中往往需加入一定量生长促进剂,提高菌种活力。常用的生长促进剂有酵母浸出液、酪蛋白胨、磷酸氢盐、玉米浸提液、大豆提取液、半胱氨酸等[7]。A(酵母浸出液,设置水平为0.3%,0.4%)、B(酪蛋白胨,设置水平为0.2%,0.3%)、C(磷酸氢二钾,设置水平为0.1%,0.2%)3种生长促进剂被作为婴儿双歧杆菌生长促进剂筛选试验的因素,根据L4(23)正交试验表进行试验设计。婴儿双歧杆菌生长促进剂筛选试验评分标准见表1。
1.3.2 婴儿双歧杆菌活化
(1)培养基配方:鲜牛奶500mL,酵母浸出液2.5mL,蛋白胨0.75g,酪蛋白胨0.75g,磷酸氢二钾0.5g,磷酸二氢钾0.5g,葡萄糖10g,半胱氨酸0.25g[8]。
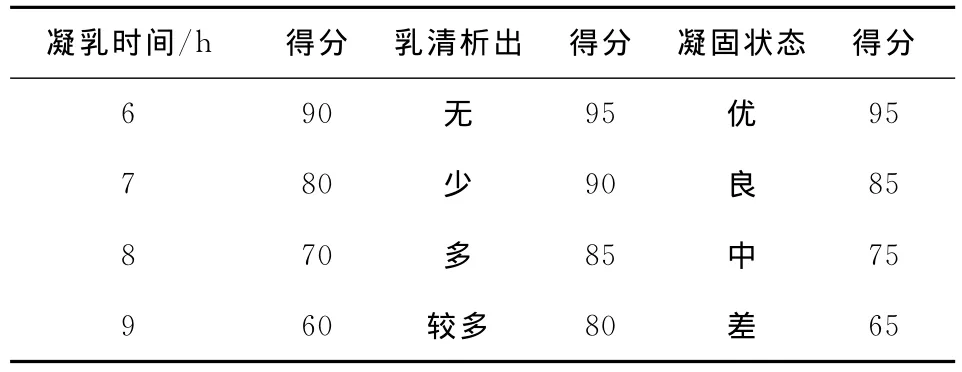
表1 婴儿双歧杆菌生长促进剂筛选试验评分标准表Table 1 Growth promoters screening test score of standard meter of Bifidobacterium infantis
(2)以上组分加热溶解后分装试管,密封后在115~120℃的条件下灭菌15~20min,冷却后备用。
(3)在无菌条件下以原料乳5%的接种量接种婴儿双歧杆菌,然后置于(37±1)℃培养,待培养基凝固,即得第一代活化菌种F1,放冰箱冷藏,待用。按同样的操作方法重复以上步骤,得婴儿双歧杆菌第四代活化菌种F4。
1.3.3 婴儿双歧杆菌耐氧驯化 婴儿双歧杆菌耐氧驯化通过逐级降低鲜牛奶培养基中抗氧化剂含量的方法进行。
葡萄糖常用作抗氧化剂使用,能够降低培养基中氧含量及氧化还原电势。本试验选用葡萄糖作为抗氧化剂,通过逐级降低葡萄糖在培养基中的含量:2%→1.5%→1%(→0)的方法进行,第一次驯化是在含2%葡萄糖的鲜牛奶培养基中进行,驯化培养3~4代作为第一代菌种;然后按照同样的方法逐级递减鲜奶培养基中葡萄糖的含量得到第二代和第三代菌种。
1.3.4 婴儿双歧杆菌在花生乳中生长驯化
(1)花生乳的制备:
新鲜花生仁→烘烤(110℃,30min)→手搓去皮→浸泡(0.5%NaHCO3,20~24h)→磨浆(兑水4~5倍)→过滤→均质→原料花生乳
(2)婴儿双歧杆菌在花生乳中的培养驯化通过逐级增加鲜牛奶培养基中花生乳含量(20%→27.7%→33%)进行,即在花生乳80%鲜牛奶培养基中驯化为第一次驯化,驯化培养3~4代;在27.7%花生乳72.3%鲜牛奶培养基中驯化为第二次驯化,驯化培养3~4代,在33%花生乳67%鲜牛奶培养基中驯化为第三次驯化,驯化培养3~4代。
通过不断调整培养基配方比例,对婴儿双歧杆菌进行花生乳的培养驯化,每个培养基配方条件下重复3次操作。
1.3.5 影响婴儿双歧杆菌生长的最佳条件 鲜牛奶与花生乳配比、蔗糖、葡萄糖、接种量等对婴儿双歧杆菌生长具有一定的影响。D(鲜牛奶与花生乳配比,水平设置为2∶1,1∶2,1∶1)、E(蔗糖,水平设置为6%,7%,8%)、F(葡萄糖,水平设置为1.0%,1.5%,2.0%)和 G(接种量水平设置为3%,4%,5%)被选为影响婴儿双歧杆菌生长的4个因素,设计L9(34)正交试验。
婴儿双歧杆菌生长的最佳组合试验评分标准见表2。

表2 影响婴儿双歧杆菌生长的最佳组合评分标准表Table 2 Optimal combination scoring standards table of impacting Bifidobacterium infantis growth
1.3.6 工作发酵剂制备及检验 将筛选出的婴儿双歧杆菌最佳水平组合进行扩大培养,制备工作发酵剂,并对其进行感观、酸度、婴儿双歧杆菌活菌数等质量检验。
(1)感官检验按 GB 2746——1999执行,酸度检验按GB 2746——1999执行,婴儿双歧杆菌检验按 GB/T 4789.34——2003执行。
(2)检验培养基BBL配方:蛋白胨15g,酪蛋白胨15g,可溶性淀粉1g,氯化钠10g,酵母浸出液4g,葡萄糖40g,半胱氨酸1g,琼脂40g,西红柿浸出液800mL,吐温-80 2mL,肝提取液160mL,加蒸馏水2 000mL(调pH至7.0±0.1)。
将检验培养基的各组分混合加热溶解、校正至pH 7.0,分装培养皿,115~120℃高压灭菌15~20min。
(3)西红柿浸出液制备:新鲜西红柿洗净、称重、切碎,加入等量蒸馏水,100℃水浴加热90min,间歇搅拌,用绒布过滤,校正pH达到7.0,分装至锥形瓶,115℃高压灭菌15~20min。
(4)肝提取液制备:250g新鲜猪肝经绞碎后加 500mL蒸馏水,混匀,置冰箱冷藏过夜。次日煮沸15~20min,绒布过滤,收集滤液,补加水至原量,再分装至锥形瓶。
(5)菌落计数:根据平皿内菌落数,乘以相应的稀释倍数,计算出每毫升样品中双歧杆菌活菌数。
2 结果与分析
2.1 婴儿双歧杆菌生长促进剂筛选结果
婴儿双歧杆菌生长促进剂能够提高婴儿双歧杆菌的生长活力,降低凝乳时间。参考婴儿双歧杆菌生长促进剂筛选试验评分标准表1,对4个试验的3项指标:凝乳时间、乳清析出和凝固状态进行评分,评分结果及分析见表3。

表3 婴儿双歧杆菌生长促进剂筛选试验结果表Table 3 Growth promoters screening test results tables of Bifidobacterium infantis
由表3可知,影响婴儿双歧杆菌活力的生长促进剂的主次关系是A>B>C,根据各因素的最好水平选取的最佳组合是A2B1C1,即酵母浸出液0.4%,酪蛋白胨0.2%,磷酸氢二钾0.1%。
2.2 婴儿双歧杆菌活化结果
培养基凝固时间是评定婴儿双歧杆菌活力主要指标。培养基凝固时间短,婴儿双歧杆菌活化程度高,活力强,反之则弱。婴儿双歧杆菌活化结果见图1。
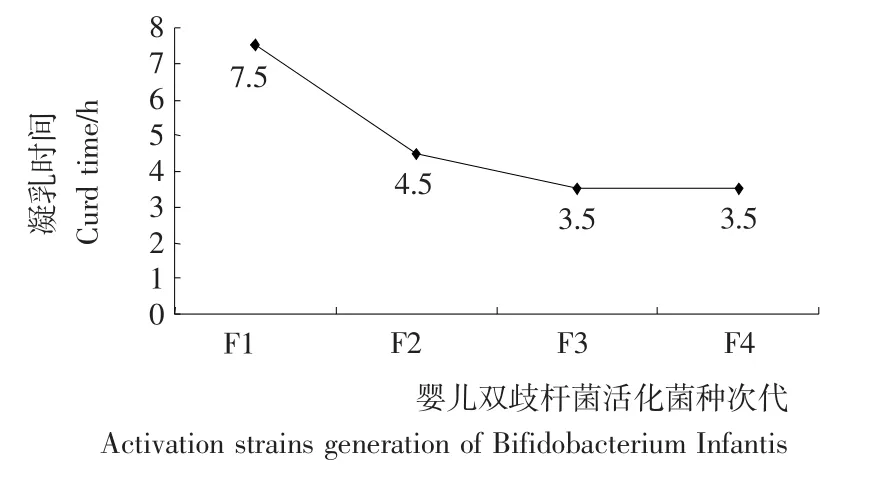
图1 婴儿双歧杆菌活力趋势图Figure 1 Vitality trend chart of Bifidobacterium infantis
由图1可知,随着婴儿双歧杆菌活化代数逐渐增加,凝乳时间逐渐下降,表明婴儿双歧杆菌活化程度逐渐提高。但是,当婴儿双歧杆菌活化至第四代F4时,其凝乳时间和第三代F3凝乳时间相同,表明婴儿双歧杆菌活力已经达到稳定,即婴儿双歧杆菌活化3代即可达到活化目的。
2.3 婴儿双歧杆菌耐氧驯化结果
葡萄糖作为抗氧化剂,能够降低培养基中氧化还原电势和氧含量,加入葡萄糖的量不同,对氧的抑制能力不同。婴儿双歧杆菌在不同浓度葡萄糖的鲜牛奶培养基中生长驯化结果见图2。由图2可知,婴儿双歧杆菌随驯化代数不断增加,培养基凝乳时间逐渐降低,表明婴儿双歧杆菌逐渐适应氧环境中生长。婴儿双歧杆菌在2%葡萄糖的鲜牛奶培养基中连续驯化培养3代,凝乳时间达到稳定为6.5h,在1.5%葡萄糖的鲜牛奶培养基中连续驯化培养3代,凝乳时间达到稳定为4.5h,在1%葡萄糖的鲜牛奶培养基中驯化培养1代,凝乳时间达到稳定为4h(传统酸奶发酵时间),达到耐氧驯化目的。

图2 婴儿双歧杆菌耐氧驯化趋势图Figure 2 Resistance to oxygen domesticated trend chart of Bifidobacterium infantis
2.4 婴儿双歧杆菌在花生乳中生长驯化结果
婴儿双歧杆菌菌种一般冷冻保存于脱脂牛奶粉末中,适应牛奶中生长,难以适应花生乳中生长,要改变其适应性,就要在花生乳中进行生长驯化,提高其适应能力,驯化结果见图3。
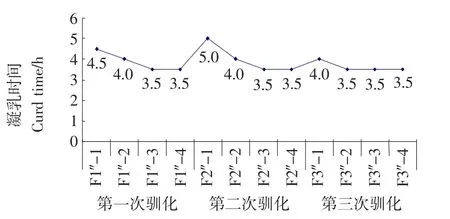
图3 婴儿双歧杆菌在花生乳中生长驯化趋势图Figure 3 Bifidobacterium infantis grow in peanut-milk domestication trend chart
由图3可知,在3次驯化过程中,培养基凝固时间都随驯化代数增加而下降。第一次驯化过程中,驯化第3代F1″-3和第4代F1″-4凝乳时间相同(3.5h),表明婴儿双歧杆菌在20%花生乳中驯化3代其活力达到稳定;第二次驯化过程中,驯化第3代F2″-3和第4代F2″-4凝乳时间相同(3.5h),表明婴儿双歧杆菌在27.7%花生乳中驯化3代其活力达到稳定;第三次驯化过程中,驯化第2代F3″-2和第3代F3″-3凝乳时间相同(3.5h),表明婴儿双歧杆菌在33%花生乳中驯化2代其活力达到稳定。
在第二次第三代F2″-3驯化之后,婴儿双歧杆菌凝乳时间变化幅度趋于同一水平直线,表明婴儿双歧杆菌适应花生乳中生长,达到驯化目的。
2.5 婴儿双歧杆菌生长的最佳组合结果
2.5.1 婴儿双歧杆菌活菌计数 婴儿双歧杆菌在检验培养基BBL中生长的菌落形态特征为菌落中等大小,表面光亮,凸起,边缘整齐呈奶油色,质地柔软、细腻,菌落大小为2~3mm,见图4(9号试验,稀释107倍)。婴儿双歧杆菌属于革兰氏阳性杆菌(G+),对其进行革兰氏染色[9],经显微镜检查呈紫色,见图5,表明所检菌为婴儿双歧杆菌。婴儿双歧杆菌活菌计数见表4。
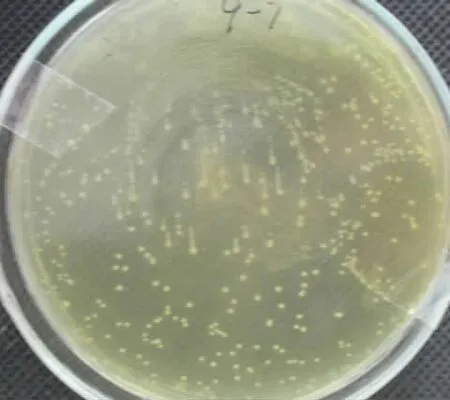
图4 婴儿双歧杆菌菌落形态图Figure 4 Morphology figure

图5 婴儿双歧杆菌菌体细胞形态图Figure 5 Bacteria somatic cell shape charts
2.5.2 婴儿双歧杆菌生长的最佳组合结果 对L9(34)正交试验设计的9个试验进行色泽、乳清析出、凝固性和婴儿双歧杆菌活菌数评分,评分结果及分析见表5。
由表5可知,影响婴儿双歧杆菌生长的因素的主次关系是D>E>G>F,根据各因素的最好水平选取的最佳组合是D3E1F3G3,即鲜牛奶与花生乳配比1∶1,蔗糖6%,葡萄糖2%,接种量5%。
2.6 工作发酵剂检验结果
按鲜牛奶与花生乳配比1∶1,蔗糖6%,葡萄糖2%,接种量5%,制备工作发酵剂,检验结果如下:工作发酵剂色泽呈乳白色,组织光滑、均匀细腻,有酸牛乳和花生清香之气味,无气泡、无龟裂、无变色等现象。酸度大于等于95°T。婴儿双歧杆菌活菌数为2.5×109CFU/mL,高于 GB 2726——1999《酸牛乳》中规定的1×106CFU/mL,高达2 000多倍。

表4 婴儿双歧杆菌活菌计数表Table 4 Bifidobacterium infantis living bacterium count tables /(CFU·mL-1)
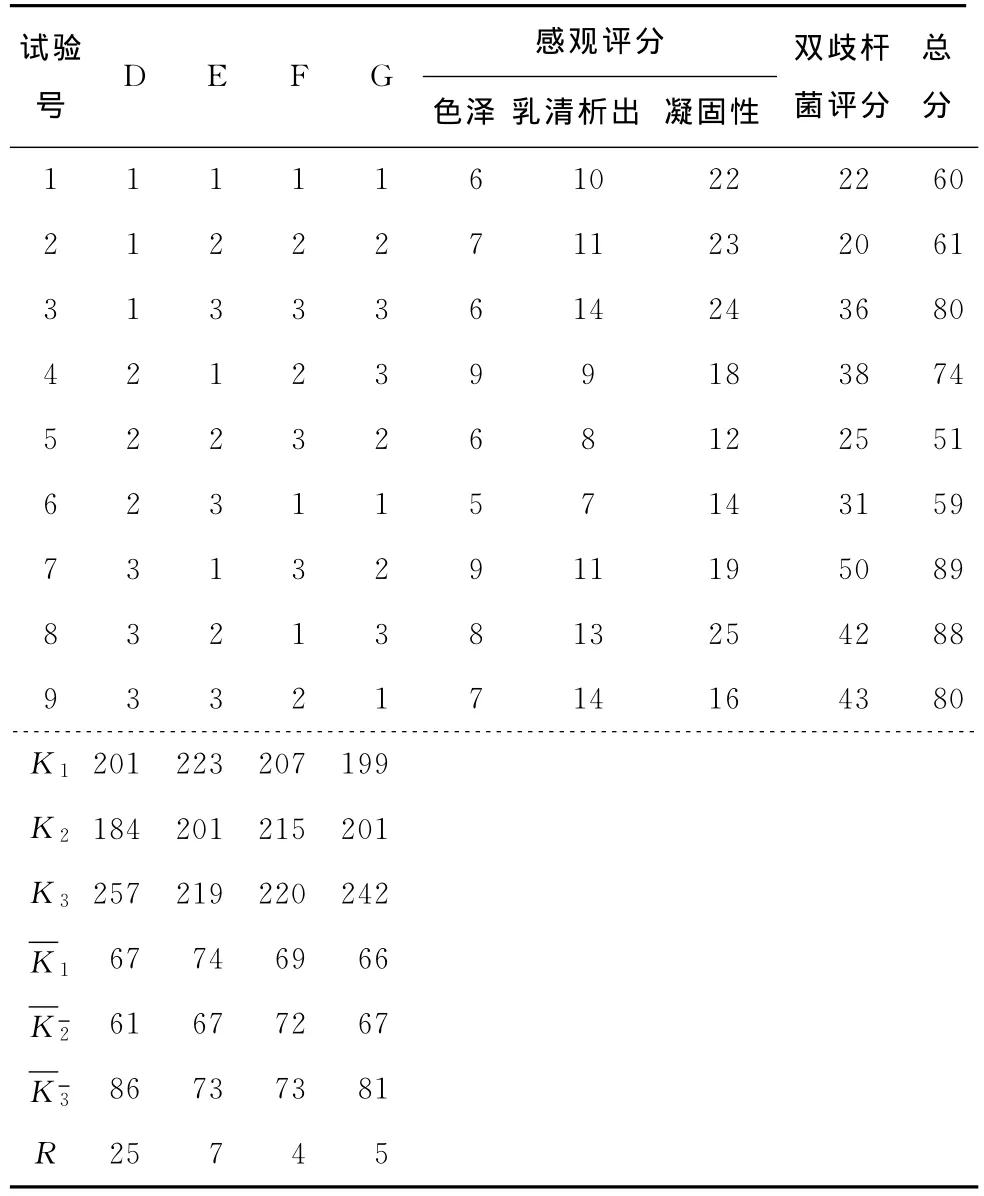
表5 婴儿双歧杆菌生长的最佳组合结果分析Table 5 Bifidobacterium infantis growth results tables of the best combination
3 结论与分析
本试验对婴儿双歧杆菌的生长促进剂进行了筛选,结果表明酵母浸出液对婴儿双歧杆菌活化影响最大,酪蛋白胨次之,磷酸氢二钾最小,三者最佳水平组合为酵母浸出液0.4%,酪蛋白胨0.2%,磷酸氢二钾0.1%。在菌种活化试验中连续活化3代凝乳时间稳定至3.5h。
对活化后菌种进行了牛乳中的驯化培养,为婴儿双歧杆菌在搅拌花生酸奶的应用进行了研究。发现鲜牛奶与花生乳配比对婴儿双歧杆菌生长影响最大,其次是蔗糖,再次是接种量,最后是葡萄糖。当鲜牛奶与花生乳配比1∶1,蔗糖6%,葡萄糖2%,接种量5%,婴儿双歧杆菌达到最佳生长状态,活菌数达到2.5×109CFU/mL。这为婴儿双歧杆菌在搅拌花生酸奶中的应用提供了一定的理论和数据参考。
1 陈文学,史俊华.双岐杆菌的研究进展[J].中国微生态学杂志,2000,12(5):298~300.
2 熊三玉,管斌,孔青,等.两歧双歧杆菌耐氧耐酸耐胆盐优良菌株的选育[J].中国酿造,2007(6):32~35.
3 尤丽新,蔡丹,任丽丽,等.两歧双歧杆菌在牛初乳中的发酵特性研究[J].中国乳品工业,2006,34(10):27~28.
4 孙力军,李令勇,高房昌.耐氧短双歧杆菌的分离驯化及其应用特性的研究[J].中国微生态学杂,2003,15(5):251~255.
5 吕志勇,吕志刚.双歧杆菌的保健功能及其产品研发[J].安徽农业科学,2006,34(19):5 031~5 032.
6 杜少平,杨础华,石笛,等.两歧双歧杆菌耐氧耐酸优良菌株的选育[J].现代食品科技,2009,25(8):916~919.
7 孙力军,李令勇,高房昌.耐氧短双岐杆菌的分离驯化及其应用特性的研究[J].中国微生态学杂志,2003,15(5):251~255.
8 郑桂富,王允祥.多菌种混合发酵花生酸乳的工艺研究[J].食品工业科技,2001(1):44~46.
9 中华人民共和国卫生部.GB/T 4789.34——2008食品卫生微生物学检验双岐杆菌检验[S].北京:中华人民共和国卫生部、中国国家标准化管理委员会,2008.
10 Goldin B R,Gorbach S L.Effect of Lactobacillus acidophilus dietary supplements on 1,2-dimethylhydrazine dihydrochlorideinduced intestinal cancer in rats[J].J.Natl.Cancer Inst.,1980,64(2):263~265.
Studies on oxygen tolerance test and application characteristics ofBifido b acterium infan tis
WU Min1HU Ying2LUO Ai-ping2,4ZHU Qiu-jin2,3,4
HE La-ping2,4ZHU Jian-rong3HU Ping2,3,4
(1.Tongren Vocational and Technical College,Tongren,Guizhou554300,China;2.School of Food Science,Guizhou University College of Life Science,Guiyang,Guizhou550025,China;3.Guizhou Dairy Engineering Technology Research Center,Guiyang,Guizhou550018,China;4.Guizhou University Food Science and Engineering Research Center,Guiyang,Guizhou550025,China)
This paper screened specificallyBifidobacterium infantis,and researched the activation method of inoculating culture on oxygen resistance strains,groped for the strain the application in mixing of peanut yoghourt.Results indicated that the yeast leaching solution for the strain activation had the biggest influence,and then in proper order were respectively casein peptone,dipotassium phosphate,and three best combinations were obtained that yeast leaching solution 0.4%casein peptone 0.2%,dipotassium phosphate 0.1%.The milk coagulation time stability to 3.5hafter the strains was continuously activation three generations.Through the four factors on the influence growth ofBifidobacterium infantisfound:ratio of milk and peanut-milk existed the biggest influence,followed by sucrose,once again,was the inoculation amount,and finally the glucose.When milk and peanut-milk ratio 1∶1,sucrose 2%,glucose 6%,inoculation quantity 5%,Bifidobacterium infantisgot to achieve the best growth state,living bacterium number reached 2.5×109CFU/mL.
Bifidobacterium infantis;oxygen tolerance test;stirred yoghourt;peanut;starter
10.3969/j.issn.1003-5788.2012.02.005
国家科技部农业技术成果转化项目(编号:2009GB2F200329);贵阳市重大科技专项(编号:筑科农合同字第2-017号)
吴敏(1968-),女,铜仁职业技术学院副教授,硕士。E-mail:wumin20070417@163.com
朱秋劲
2011-12-30
