HO-1 siRNA表达载体的构建及其稳定转染SGC7901细胞系的建立
2012-12-25张涛白芳云白飞虎
张涛,白芳云,白飞虎
(1.宁夏医科大学,宁夏银川 750004;2.宁夏医科大学总医院,宁夏银川 750004)
血红素加氧酶(heme oxygenase,HO)是血红素分解代谢过程中的限速酶,人体内的CO主要是由HO代谢产生的。目前认为HO有3种形式:氧应激诱导型(HO-1)、组成型(HO-2)及尚未明确的HO-3。HO-1是血红素降解的一种限速酶,其将血红素分解产生CO、Fe2+和胆绿素。研究表明,HO-1不仅在机体生理状态下发挥作用,更主要的是在机体非正常状态或应激状态中发挥作用。大量研究证实HO-1参与体内各种氧化应激损伤及炎症反应,发挥抗炎、抗凋亡及细胞保护作用[1]。近年来大量研究发现,HO-1与肿瘤增殖、血管发生、凋亡等生物学行为密切相关[2]。本实验将通过构建抑制HO-1表达的siRNA表达载体,脂质体转染SCG7901细胞,利用G418筛选稳定转染的细胞系并进行筛选鉴定,为进一步进行HO-1在肿瘤发生过程中可能存在的相关机制研究奠定基础。
1 材料与方法
1.1 主要试剂
感受态大肠杆菌E.coli DH5α和SGC7901细胞为第四军医大学西京消化病医院实验室制备和保存;高保真PyrobestTMDNA聚合酶、T4DNA连接酶、限制性内切酶EcoRⅠ和XhoⅠ购自TaKaRa公司;RTPCR反应试剂盒及质粒提取试剂盒购自北京天根生物公司;PCR引物由Invitrogen公司合成;转染试剂Lipofectamine 2000为Invitrogen公司产品;RPMI 1640培养液为Hyclone产品;新生牛血清购自杭州四季青责任有限公司;G418购自Amresco公司;DEPC购自上海生工生物工程技术服务有限公司;总RNA提取Trizol购自Promega公司;兔抗人HO-1单克隆抗体和兔抗人β-actin单克隆抗体购自EPITOMICS公司;辣根过氧化物酶标记的山羊抗兔IgG-HRP购自TakaRa公司。
1.2 主要仪器
二氧化碳(CO2)培养箱:3110 SeriesⅡ水套,美国Thermo Scientific公司;超净工作台:单人单面VS-840-1,苏州净化设备仪器厂;倒置荧光显微镜:IXTIA22FL/PH,日本 Olympus。
1.3 表达载体的构建和鉴定
参照本小组前期实验[3]合成1条 HO-1小干扰RNA序列AACTTTCAGAAGGGCCAGGTG;将合成的目的基因片段与pEGFP-C1载体连接,转化感受态细菌DH5α,提取质粒用紫外分光计测定A260/A280值和浓度,内切酶EcoRⅠ和XhoⅠ双酶切后进行琼脂糖凝胶电泳初步鉴定,并送南京金斯瑞生物技术有限公司测序进一步验证。按照相同的方法,制备1个阴性对照表达载体,序列为GTTCTCCGAACGTGTCACGTA。
1.4 G418筛选浓度的测定
将处于对数生长期的SGC7901细胞用胰酶消化吹悬后计数,按照每孔2 000个细胞接种于24孔板,加入含有不同浓度的G418的完全细胞培养液(浓度梯度为 0、100、200、300、400、500、600、700、800、900、1 000、1 100 μg·ml-1),并各做 1 个复孔,培养约 7 d后可见各组均有细胞死亡,培养14 d后可见600 μg·ml-1G418及更高浓度组细胞均死亡,而其他组虽也有细胞死亡但未完全死亡,因此确定G418筛选浓度为 600 μg·ml-1。
1.5 转染和加药筛选
细胞培养用含有10%胎牛血清的RPMI-1640培养基,在37℃条件下、5%CO2饱和湿度培养箱中培养。转染前24 h接种SGC7901细胞至24孔板,每孔细胞约2.0×105个,转染时细胞融合度达到80% ~90%。按照Lipofectamine 2000说明书配制质粒和脂质体复合物,转染体系为200 μl,每孔终体积为500 μl,放入37℃、5%CO2饱和湿度培养箱中继续培养6 h后换液,同时设立空白对照组以及阴性对照组,空白对照组以等量培养基代替转染体系,阴性对照组中加入阴性对照表达载体。转染细胞培养48 h后加入含有G418的筛选培养基继续培养。
1.6 稳定转染细胞的单克隆化
加压筛选后,每3 d更换1次培养液,约20 d后开始出现细胞克隆,40 d后可见成簇生长的细胞零散在培养孔中,小心消化吹散使其在培养孔中扩大培养,待到阳性细胞长满培养孔后获得混合克隆。随后按照有限稀释法进行单克隆化操作:预先对96孔板除第1排之外的所有孔加入100 μl培养液,接着将混合克隆稀释至1 ×106个·L-1,按 200 μl·孔-1接种于 96 孔板的第1排,从中吸取100 μl细胞液接种于第2排,混匀后,从第2排中吸取100 μl接种于第3排,直到第8排,最后1排均丢弃100 μl细胞液,待细胞贴壁生长后,倒置显微镜下观察,标记只含有1个细胞的培养孔,每天记录细胞生长情况,约15 d后,挑选单克隆细胞株进行培养。
1.7 RT-PCR检测HO-1转录水平的表达
用Trizol一步法提取细胞总RNA,反转录制备cDNA,进行PCR反应。利用prime5.0软件设计HO-1上下游引物,上游引物5'-GGAGGAGGAGATTGAGCG-3',下游引物5'-GGATGTTGAGCAGGAACG-3',扩增产物大小为452 bp。内参基因GAPDH的上游引物5'-ATC ACCATCTTCCAGGAGCGA-3';下游引物5'-AGCCTTCT CCATGGTGGTGAA-3',扩增产物大小为105 bp。扩增条件:95℃预变性5 min,95℃变性30 s,60℃退火30 s,72℃ 延伸 30 s,45个循环,最后 72℃ 延伸10 min。PCR产物以1.0%琼脂糖凝胶电泳,紫外灯下拍照。
1.8 蛋白质印迹法检测HO-1翻译水平的表达
用6MM培养皿培养细胞,待细胞长满后,预冷PBS洗2~3次,每个培养皿中加200 μl蛋白裂解液(含蛋白酶抑制剂),冰上作用5 min,超声充分碎裂,4℃ 12 000 r·min-1离心5 min,用BCA法进行蛋白定量,再加入5×上样缓冲液煮沸5 min,离心后-80℃冻存备用。10%SDS-PAGE电泳,恒流20 mA 60 min电泳,半干法进行转膜20 V 25 min。用含10%脱脂奶粉的TBST室温封膜1 h,按照1∶500封闭一抗4℃摇床过夜,次日室温复温1 h,TBST洗膜4次,每次4 min,加入辣根过氧化物酶标记的山羊抗兔IgG二抗(稀释度1∶1 500),摇床70转,室温封闭1 h,TBST洗膜4次,每次4 min。ECL试剂暗室曝光显影。
2 结 果
2.1 酶切及测序结果
对提取的质粒进行定量,浓度为 0.45 μg·μl-1,A260/A280=1.9,双酶切后琼脂糖凝胶电泳结果见图1。
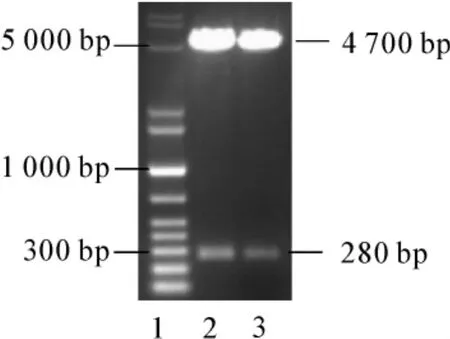
图1 琼脂糖凝胶电泳结果
2.2 转录水平的表达
采用RT-PCR检测HO-1 mRNA表达水平,结果表明转染干扰载体的细胞表达水平明显下调(图2)。

图2 RT-PCR检测转录水平的表达
2.3 翻译水平的表达
采用蛋白质印迹法检测HO-1蛋白表达水平,结果表明转染干扰载体的细胞表达水平明显下调(图3)。
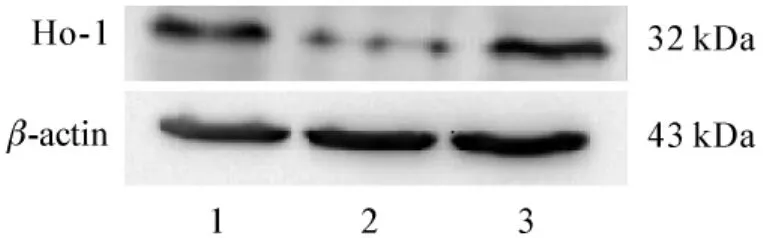
图3 蛋白质印迹法检测翻译水平的表达
3 讨 论
脂质体2000是一种阳离子制剂,其功能是通过与核酸复合发挥作用,使其能够克服细胞膜的静电作用而被细胞吸收,可以将核酸物质转染进入绝大部分的细胞系中[4]。但是针对不同的细胞系,其转染效率并不尽相同,有时候会表现得非常低,如果此时在瞬时转染条件下进行相关实验,结果往往不尽人意,有人已经证明瞬时转染和稳定转染条件下,对细胞所产生的影响并不相同[5]。相比而言,稳定转染会比瞬时转染带来更好、更稳定和更理想的实验结果,所以我们有必要进行稳定筛选来建立稳定转染的细胞系。
HO-1与肿瘤的关系日益受到关注,研究表明,与周围的正常组织相比,HO-1 在肝癌[6]、黑素瘤[7]、前列腺癌[8]、Kaposi肉瘤[9]、胰腺癌[10]中表达上调;而抑制HO-1的表达,利用锡原卟啉(SnPPIX)抑制HO-1的活性或siRNA靶向敲除HO-1表达的黑素瘤细胞增殖力缺失[7],可降低胰腺癌、肺癌、肝癌的生长[11]。
本课题组前期的实验研究已经证明,HO-1与胃癌的发生发展关系紧密,尤其是在胃癌腹膜转移的过程中,可能发挥着促进的作用[3,12]。为了进一步研究,我们建立稳定转染的HO-1小干扰RNA的细胞系,以明确HO-1与胃癌及其腹膜转移之间的关系以及可能存在的分子机制。
[1]许俊,秦旭平.血红素加氧酶与炎症性疾病[J].生命的化学,2010,30(5):770-773.
[2]刘立青,张黎,程力,等.HO-1与肿瘤的发生发展[J].中国现代普通外科进展,2010,13(1):57-59.
[3]祁妮娜,白飞虎.血红素加氧酶-1小干扰RNA对人胃癌9811-P细胞体外侵袭的影响[J].中国现代医学杂志,2011,21(17):1953-1957.
[4]DALBY B,CATES S,HARRIS A,et al.Advanced transfection with Lipofectamine 2000 reagent:primary neurons,siRNA,and high-throughput applications[J].Methods,2004,33(2):95-103.
[5]贺涛,张玲,崔宏,等.瞬时转染和稳定转染对RNAi抑制肝癌细胞系EGHC9901 AFP基因表达的影响[J].军医进修学院学报,2010,31(11):1134-1136.
[6]DOI K,AKAIKE T,FUJII S,et al.Induction of haem oxygenase-1 nitric oxide and ischaemia in experimental solid tumours and implications for tumour growth[J].Br J Cancer,1999,80(12):1945-1954.
[7]WAS H,CICHON T,SMOLARCZYK R,et al.Overexpression of heme oxygenase-1 in murine melanoma:increased proliferation and viability of tumor cells,decreased survival of mice[J].Am J Pathol,2006,169(6):2181-2198.
[8]MAINES M D,ABRAHAMSSON P A.Expression of heme oxygenase-1(HSP32)in human prostate:normal,hyperplastic,and tumor tissue distribution[J].Urology,1996,47(5):727-733.
[9]MCALLISTER S C,HANSEN S G,RUHL R A,et al.Kaposi sarcoma-associated herpesvirus(KSHV)induces heme oxygenase-1 expression and activity in KSHV-infected endothelial cells[J].Blood,2004,103(9):3465-3473.
[10]SUNAMURA M,DUDA D G,GHATTAS M H,et al.Heme oxygenase-1 accelerates tumor angiogenesis of human pancreatic cancer[J].Angiogenesis,2003,6(1):15-24.
[11]惠亮亮,白飞虎.血红素加氧酶-1对肿瘤生物学行为的影响研究进展[J].第四军医大学学报,2009,30(20):2245-2247.
[12]惠亮亮,白飞虎,杨力,等.血红素氧合酶-1在胃癌腹膜转移中的表达及意义[J].中华消化杂志,2009,29(9):521-524.
