活性SET7/9融合蛋白的表达与纯化
2012-12-25高丽丽余卫平
高丽丽,余卫平
(东南大学医学院病理学与病理生理学系,江苏南京 210009)
SET7/9含有SET结构域,是蛋白赖氨酸甲基化转移酶 (proteinlysinemethyltransferases,PLMTs或PKMTs)家族成员。有报道称之为SET7,也有报道称之为SET9[1-2]。近年来发现SET7/9催化的非组蛋白甲基化作用能引起蛋白稳定性改变和基因表达变化等多种分子效应,涉及到染色体结构、细胞周期及凋亡等方面。因研究需要,我们建立了活性GST-SET7/9融合蛋白(SET7/9融合蛋白)表达系统与纯化方法。
1 材料与方法
1.1 菌株和载体
本实验所需的大肠杆菌CM1061菌株、大肠杆菌BL21(DE3)表达菌株、pCMV-SET7/9质粒均由本课题组保存;原核表达载体质粒pGEX-6P-3由Amersham Biosciences公司提供。
1.2 主要试剂
PCR产物纯化、质粒提取试剂盒为QIAGEN公司产品;PCR酶、限制性内切酶购自 TaKaRa公司;T4 DNA连接酶由New England Biolabs公司提供;Glutathione Agarose吸附柱为Sigma公司产品;人组蛋白H3由 upstate公司提供;Adenosel-L-Methionine,S-K[methyl-3H]由PerkinElmer公司提供;Bio-Rad蛋白测定试剂盒由BIO-RAD公司提供;引物合成、测序均在INVITROGEN公司完成。
1.3 pGEX-SET7/9原核重组表达载体的构建
1.3.1 设计与合成寡聚核苷酸引物 目的基因为含SET结构区的SET7/9基因片段,位于pCMV-SET7/9全基因序列的第268~1 365个核苷酸。通过NCBI GenBank确定pCMV-SET7/9的cDNA序列,选择EcoRⅠ和XhoⅠ作为酶切位点,采用DNA Star软件设计SET7/9引物。SET7/9引物上游:5'-ACCGAATTCCAT GGATAGCGACGAC-3',含EcoRⅠ酶切位点及启始密码子;SET7/9引物下游:5'-CTCCTCGAGTCATTACTTT TGCTGGGTGGCCTG-3',含终止密码子及XhoⅠ酶切位点。
1.3.2 扩增目的基因 以pCMV-SET7/9质粒为模板,PCR扩增目的基因。等量去离子水代替模板作为阴性对照。其反应条件为94℃ 13 min热启动;94℃1 min,60 ℃ 1 min,72 ℃ 2 min,35个循环;最后72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳后,纯化回收,产物纯化后测序确认。
1.3.3 构建pGEX-SET7/9表达载体 将原核表达载体pGEX-6P-3转入大肠杆菌CM1061菌株。挑取单个菌落培养,大量提取质粒DNA。将纯化后的PCR产物和pGEX-6P-3质粒分别用核酸内切酶EcoRⅠ与XhoⅠ进行酶切,电泳鉴定并用PCR产物纯化试剂盒纯化,氯仿抽提法回收。用T4 DNA连接酶连接含SET7/9的基因片段与表达载体,获得pGEX-SET7/9重组质粒。
接种转化有重组质粒的大肠杆菌BL21(DE3)单菌落至10 ml含氨苄青霉素抗性的LB液体培养基中,37℃振荡培养过夜。次日按1∶100的比例转接过夜培养菌至15 ml含氨苄青霉素液体培养基中,37℃继续振荡培养至OD600nm为0.6左右,均分该培养物为两部分:一部分加入异丙基β-D硫代半乳糖苷(IPTG)至终浓度为1 mmol·L-1以诱导SET7/9融合蛋白表达,在诱导培养的不同时间(0、1、2、3、4 h)收取菌液,各取1 ml培养物离心后留沉淀置-70℃保存待用;另一部分不加IPTG,相同方法收取不同时间段的细菌沉淀作对照。将收集到的细菌菌体用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS PAGE)法,检测与鉴定含pGEXSET7/9质粒的阳性菌落。
1.4 SET7/9融合蛋白的表达与提纯
挑取单一阳性菌落接种在10 ml含青霉素抗性的LB液体培养基中,37℃振荡培养过夜,次日按1∶100的比例转接于500 ml含青霉素抗性的培养基中,于37℃振荡培养至OD600nm为0.6左右,加入IPTG至终浓度为1 mmol·L-1以诱导GST-SET7/9表达,继续培养5.0 h。离心收取菌体用5 ml PBS重新悬浮细胞于4℃超声破碎以裂解细菌,利用Glutathione Agarose吸附柱提纯SET7/9融合蛋白,产物进行SDS-PAGE电泳检测,确定目的蛋白所在部位。
1.5 SET7/9融合蛋白的组蛋白甲基化作用分析
采用Bio-Rad蛋白测定试剂盒检测纯化的SET7/9融合蛋白浓度,组蛋白甲基化转移酶(HMT)测定法分析蛋白活性。通过LS6000IC型液闪仪(BECKMAN公司)测得的每分钟脉冲数(CPM)反映蛋白质HMT活性。
2 结 果
2.1 pGEX-SET7/9重组质粒的PCR鉴定
pGEX-SET7/9重组质粒通过PCR扩增,其目的基因长度为1 123 bp,与分子质量参照物(DNA Ladder)相比,PCR扩增产物的大小与预测结果一致(图1)。
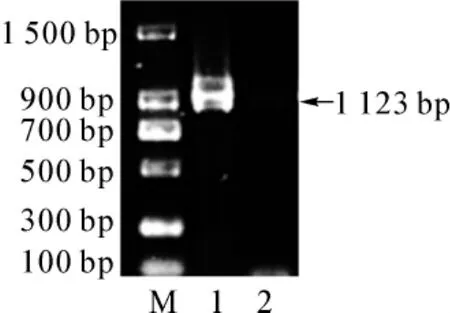
图1 PCR扩增SET7/9结果(1%琼脂糖凝胶电泳)Fig 1 Amplification of SET7/9 with PCR(1%agarose gel)
2.2 SET7/9融合蛋白的表达与纯化
SET7/9融合蛋白进行SDS-PAGE蛋白电泳,经考马斯亮蓝R-250染色发现,含重组质粒的诱导菌在分子质量大约77 kD位置出现一蛋白条带。已知目的基因表达的多肽分子质量为50 kD,与融合蛋白共同表达分子质量约为77 kD,故获得的纯化蛋白分子质量与理论估计值相一致(图2)。

图2 提纯SET7/9融合蛋白的SDS-PAGE结果Fig 2 SDS-PAGE showing the purification of SET7/9 protein
2.3 SET7/9融合蛋白的组蛋白甲基化作用
采用HMT测定法可见,孵育30、60、120 min后的样本,纯化SET7/9融合蛋白组CPM值均明显高于对照组(GST蛋白质组),与对照组相比分别增加21.7%、19.8%、22.1%,且与作用时间呈正相关,表明融合蛋白SET部分具有HMT活性(表1)。

表1 纯化SET7/9蛋白的组蛋白甲基化作用分析Tab 1 Histone methylation analysis of the purified SET7/9 protein
3 讨 论
SET7/9蛋白分子质量大约为50 kD,其表达基因位于第4号染色体4q28。SET7/9所含的SET结构域具有由β折叠环绕成的类似绳结的三级结构[3-5]。最初发现SET7/9是靶向组蛋白H3第4位赖氨酸(H3K4)的甲基化转移酶,但进一步研究发现SET7/9只对游离的H3K4而非核小体H3K4有高度活性[1-2,4]。此外,SET7/9 还能使膜相关受体、转录因子、肿瘤抑制因子等蛋白赖氨酸甲基化,从而调节这些非组蛋白的功能[6-7]。
SET7/9对非组蛋白赖氨酸的甲基化作用会产生复杂的生物学效应,如甲基化p53的K372位点可增加p53稳定性及其对靶基因的活化作用;甲基化衍生因子(elongation factor,E2F1)的K185位点可抑制该蛋白的乙酰化和磷酸化,并激活蛋白泛素化,抑制凋亡;还可使成视网膜母细胞瘤蛋白(retinoblastoma protein,pRb)、雌激素受体 α (estrogen receptor α,ERα)等蛋白甲基化,影响它们的生物学效应[6-7]。可见SET7/9催化的非组蛋白赖氨酸甲基化作用可能与肿瘤等疾病的发病机制相关[6-7]。
为了开展SET7/9对非组蛋白甲基化修饰及其效应的研究,我们需要创建SET7/9蛋白表达系统。本项工作所构建的pGEX-SET7/9重组质粒在原核细胞中能够表达SET7/9融合蛋白。纯化的SET7/9融合蛋白通过HMT活性测定有明显的组蛋白甲基化作用,表明pGEX-SET7/9能够表达高活性的SET7/9融合蛋白[8]。这会为我们后续相关工作提供帮助。
[1]WANG H B,CAO R,XIA L,et al.Purification and functional characterization of a histone H3-lysine 4-specific methyltransferase[J].Mol Cell,2001,8(6):1207-1217.
[2]NISHIOKA K,CHUIKOV S,SARMA K,et al.Set9,a novel histone H3 methyltransferase that facilitates transcription by precluding histone tail modifications required for heterochromatin formation[J].Genes Dev,2002,16(4):479-489.
[3]QIAN C,ZHOU M M.SET domain protein lysine methyltransferases:structure,specificity and catalysis[J].Cell Mol Life Sci,2006,63(23):2755-2763.
[4]WILSON J R,JING C,WALKER P A,et al.Crystal structure and functional analysis of the histone methyltransferase SET7/9[J].Cell,2002,111(1):105-115.
[5]XIAO B,JING C,WILSON J R,et al.Structure and catalytic mechanism of the human histone methyltransferase SET7/9[J].Nature,2003,421(6923):652-656.
[6]高丽丽,余卫平.PLMT家族成员SET7/9的非组蛋白甲基化作用[J].生命科学,2011,23(8):773-778.
[7] EA C K,BALTIMORE D.Regulation of NF-κB activity through lysine monomethylation of p65[J].Proc Natl Acad Sci USA,2009,106(45):18972-18977.
[8]余卫平,方娟娟,DONG W F,等.含RIZ1 PR结构域融合蛋白的原核表达、提纯与功能分析[J].东南大学学报:医学版,2006,25(4):240-243.
